应用高通量测序分析云南昭通不同栽培模式苹果园根际土壤微生物种群
2019-08-08许姗姗杨光柱孔宝华李云国蔡兆翔谭安超曹克强
许姗姗,杨光柱,阚 望,孔宝华*,李 毅,马 钧*,李云国,蔡兆翔,谭安超,曹克强
(1.云南农业大学植物保护学院,云南 昆明 650201;2.云南省农业科学院园艺作物研究所,云南 昆明 650205;3.昭通市水果技术推广站,云南 昭通 657000;4.河北农业大学植物保护学院/国家苹果产业技术体系病虫害防控研究室,河北 保定 071001)
1 材料与方法
1.1 土样的采集
选取云南鲁甸县文屏镇砚池山村闸上(N27°08′57.54″、E103°31′48.30″)、鲁甸县桃源乡大水塘村(N27°11′01.05″、E103°38′01.47″)、昭阳区苏家院镇顺山海升公司的苹果果园(N27°17′32.64″、E103°31′46.81″)。3种不同果园:粗放果园、普通果园、精品果园。
于 2016年7-8月在供试3个果园内分别选择5株苹果树采集土壤,采用5点取样法,去除土壤表层的腐殖质,在距树干基部0.5 m 处分别设置5个取样点,每份约300 g,过2 mm 筛后;分装,液氮中冷冻 3~4 h,然后转移至-80 ℃ 或液氮中长期保存,干冰运输至百迈克生物公司(BioMarker)进行DNA提取与测序,并在云南三标农林科技有限公司检测各项理化性质。
1.2 土壤理化性质测定
高温外加热重铬酸钾氧化容量法测定土壤有机质,紫外分光光度校正因数法测定硝态氮,2 mol/L KCl 浸提-靛酚蓝比色法测定铵态氮,滤纸条法测定有效磷,乙酸铵浸提-火焰光度计法测定速效钾,磷钼酸比色法测定蔗糖酶活性(以24 h后1 g土中含葡萄糖的毫克数表示),3、5-二硝基水杨酸比色法测定纤维素酶活性(以24 h后1 g土中含葡萄糖的毫克数表示),苯酚钠-次氯酸钠比色法测定脲酶活性(以24 h后1 g土中含NH3-N的毫克数表示),磷酸苯二钠比色法测定碱性磷酸酶活性(以24 h后1 g土释放的酚的毫克数表示),高锰酸钾滴定法测定过氧化氢酶活性(以1 g土消耗0.1 mol/L KMnO4的毫升数表示),采用水浸提电位法测定pH,水土比为2.5∶1[8]。
1.3 土壤微生物高通量多样性测序分析
使用DNA提取试剂盒(天根生化科技(北京)有限公司),提取样品土壤微生物总DNA。
根据保守区设计得到引物,细菌主要是基于16S区,真菌主要基于18S区或ITS区(内转录间区)设计通用引物。采用细菌通用引物515F/806R ( F5’-AYTGGGYDTAAAGNG-3’,R5’-AYTGGGYDTAAAGNG -3’),以DNA为模板,扩增16srDNA的V4可变区片段。同时采用真菌ITS1-ITS2区通用引物ITS1F/ITS2(5’-CTTGGTCATTTAGAGGAAGTAA-3’,5’-GCTGCGTTCTTCATCGATGC-3’),在引物末端加上测序接头,以样本DNA为模板,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库基于Illumina HiSeq 2500测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行测序。通过对 Reads 拼接过滤,使用QIIME[1](version 1.8.0)软件中的UCLUST对Tags在97 %的相似度水平下进行OTUs(Operational Taxonomic Units)聚类,并基于Silva(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释和多样性分析。
2 结果与分析
2.1 三类苹果园土壤理化性质
土壤理化性质检测结果(表1)表明在3种不同栽培模式苹果园采集的根际土壤中有机质、硝态氮、铵态氮、有效磷、速效钾、蔗糖酶、纤维素酶、脲酶的含量均是普通果园和精品果园高于粗放果园,且差异较大,只有pH、碱性磷酸酶和过氧化氢酶的含量为粗放果园高于普通果园和精品果园,粗放果园pH呈中性,普通果园和精品果园的pH呈酸性,差异较大。总体来说,普通果园和精品果园的土壤状况优于粗放果园。

表1 三类栽培模式果园的土壤理化性质
2.2 三类苹果园操作分类单元OTUs(Operational Taxonomic Units)检测到土壤微生物的物种数量
在97 %的相似度水平下,得到每个样品的OTU个数(图1),精品果园根际土所含细菌、真菌的种水平上的微生物数量均最多,普通果园次之,粗放果园最少,同一果园不同样本之间存在差异。
2.3 三类苹果园根际土壤微生物的主要门
对三类栽培模式苹果园根际土壤细菌物种进行分析,共同高频检测到Proteobacteria、Acidobacteria、Actinobacteria、Chloroflexi、Gemmatimonadetes、Bacteroidetes、Firmicutes、Verrucomicrobia优势细菌门与Ascomycota、Mortierellomycota、Basidiomycota、Chytridiomycota、Cercozoa、Glomeromycota优势真菌门。
2.4 三类果园根际土壤微生物的主要属与种
在属水平上对样品和OTU 类型(样品所含菌属)进行聚类,对聚类后各样品中不同OTU(不同菌属)所含序列的丰度作热图(图2~3,见封3)。结果显示普通果园与精品果园高频检测出的细菌属菌群亲缘关系比较接近,而粗放果园高频检测出的细菌属菌群差别较大, 亲缘关系较远。
粗放果园、普通果园与精品果园的高频检出的真菌属的种群总体为亲缘关系相近的真菌属在聚在同一个果园,然而精品果园高频检测到的真菌属种群亲缘关系更远。3类果园根际土壤中的真菌种群各不相同。
3类果园检测到的细菌与真菌种(表2)各不相同,具有特有的细菌与真菌种,只有粗放果园与普通果园存在Verticilliumdahliae、Verticilliumleptobactrum2个共同的真菌属不同的种。
3 讨 论
研究表明普通果园与精品果园高频检测到的细菌属菌群亲缘关系比较接近,而粗放果园高频检测到的细菌属菌群差别较大,亲缘关系较远。
粗放果园、普通果园与精品果园的高频检测到的真菌属的种群总体为亲缘关系相近的真菌属聚在同一个果园,但是精品果园高频检测到的真菌属种群亲缘关系更远,结果表明栽培模式与真菌菌群相关,精品果园栽培模式更有利于根际土壤微生物多样性。在3种不同栽培模式苹果园采集的根际土壤理化性质不同,栽培方式影响土壤理化性质,从而影响微生物种群,最终影响苹果生长与健康。
在3种果园中,均能检测到植物致病菌,如粗放果园的Plenodomus-biglobosus[9],普通果园的Paraphoma-chrysanthemicola与Aspergillus-sydowii等[10-11],精品果园的Nigrospora-oryzae等;也能检测到有益微生物、生物防治菌,内生菌等,如粗放果园的Thiobacillusspp.、Pseudomanosspp.、Flavobacteriumspp.[12-13],Minimedusa-polyspora[14]Glomus-aggregatum[15]与Funneliformisspp.[16]等,普通果园的Aspergillus-niger[17]、Phialocephala-fortinii[18]等,精品果园的Bacillus-coagulans[19]、Debaryomycesspp.[20]等,能够降低土壤中可交换钠的含量,促进土壤中盐分的渗出,降解土壤有害物质。从粗放果园高频检测到生物防治菌对植物生长的促进作用。此外,还分离到一些环境微生物、昆虫病原菌及人类致病菌。此外,实验还检测到Torula-hollandica、Torula-masonii、Mortierella-sarnyensis等的微生物,对其生态功能值得今后研究。粗放果园中的有益微生物Thiobacillus、Pseudomanos、Flavobacterium、Mortierella、Minimedusa、Funneliformis,其中Thiobacillus在普通果园中也存在,Pseudomanos、Flavobacterium、Mortierella、Minimedusa、Funneliformis在普通果园和精品果园中均有存在,分布较为广泛;有害微生物Plenodomus在精品果园中也有存在。普通果园的有益微生物Aspergillus、Phialocephala在精品果园中存在,有害微生物Erysiphe、Verticillium、Fusicladium在普通、精品果园中均有存在。精品果园中有益微生物Bacillus、Debaryomyces在普通、精品果园均有存在;有害微生物Nigrospora在粗放果园中存在。其他检测到的微生物在3类果园中均有存在。3类果园土壤中微生物均存在拮抗或者协同关系,值得今后进一步研究。
续表2 Continued table 2
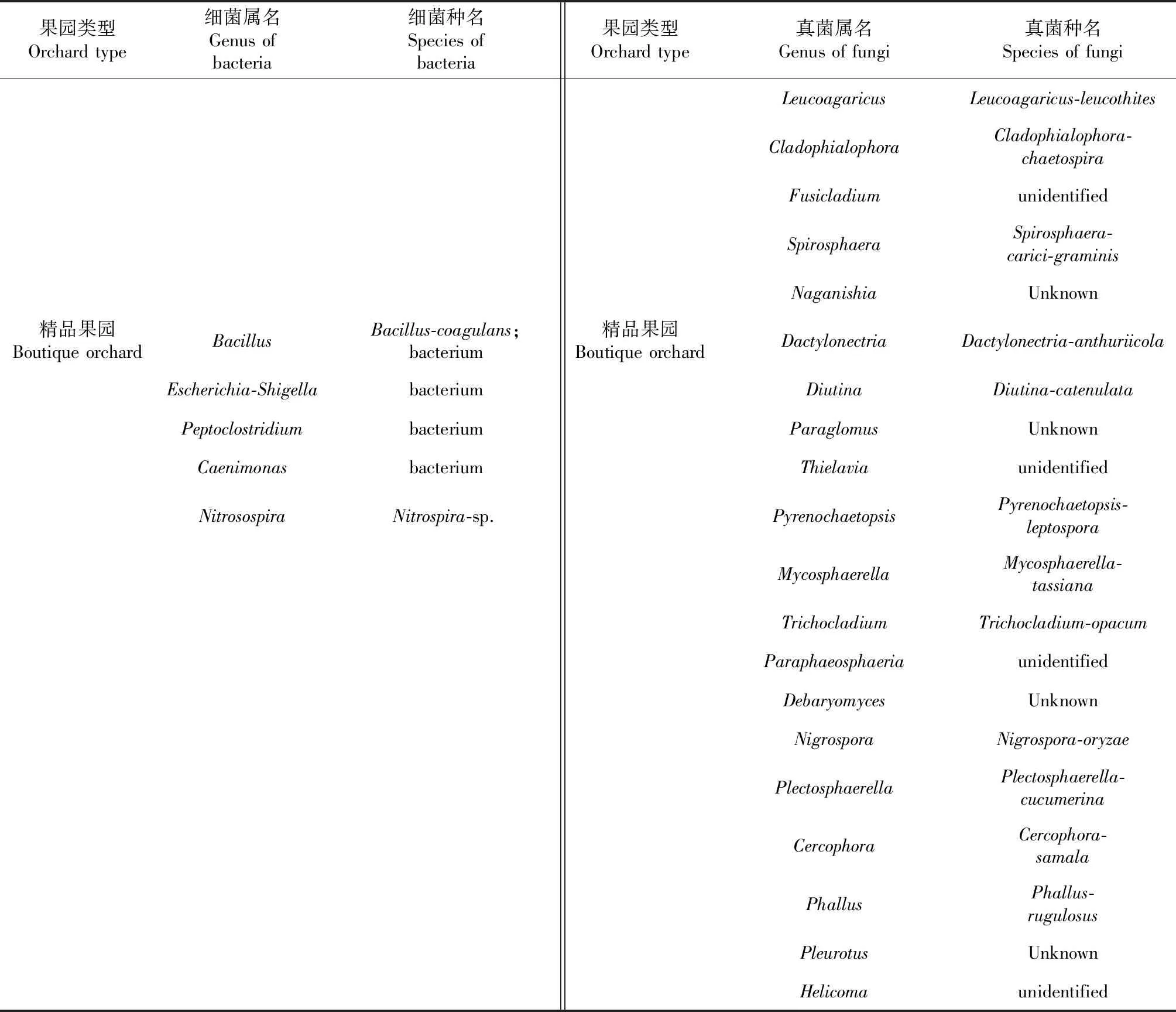
果园类型Orchard type细菌属名Genus of bacteria细菌种名Species of bacteria果园类型Orchard type真菌属名Genus of fungi真菌种名Species of fungiLeucoagaricusLeucoagaricus-leucothitesCladophialophoraCladophialophora-chaetospiraFusicladiumunidentifiedSpirosphaeraSpirosphaera-carici-graminisNaganishiaUnknown精品果园Boutique orchardBacillusBacillus-coagulans;bacterium精品果园Boutique orchardDactylonectriaDactylonectria-anthuriicolaEscherichia-ShigellabacteriumDiutinaDiutina-catenulataPeptoclostridiumbacteriumParaglomusUnknownCaenimonasbacteriumThielaviaunidentifiedNitrosospiraNitrospira-sp.PyrenochaetopsisPyrenochaetopsis-leptosporaMycosphaerellaMycosphaerella-tassianaTrichocladiumTrichocladium-opacumParaphaeosphaeriaunidentifiedDebaryomycesUnknownNigrosporaNigrospora-oryzaePlectosphaerellaPlectosphaerella-cucumerinaCercophoraCercophora-samalaPhallusPhallus-rugulosusPleurotusUnknownHelicomaunidentified
云南昭通果园土壤微生物与中国渤海湾苹果土壤微生物比较,有些菌群相同,有些不同。 渤海湾苹果根际土壤中主要有Verticillium、Xanthomadaceae、Pseudomonas、Bacillium及Arthrobacterium、Chaetomium等具有拮抗作用的微生物[5]。在巴西苹果园根际土壤之中也有Pseudomonas、Rhodanobacter属的菌群[7]。云南昭通优势菌群也有Bacillium、Pseudomonas属的菌群,表明这两个属的菌群具有更广泛的适应性。在云南苹果园根际土壤高频检测到的Arenimonas、Lactobacillus、Rhodanobacter、Edaphobacter、Sulfuriferula、Thiobacillus、Pseudomanos、Altererythrobacter、Flavobacterium、Staphylococcus、Terrimonas、Bacteroides、Crossiella、Pedobacter、Thermomonas、Massilia、Sphingopyxis、Acidiphilium、Modestobacter、Ktedonobacter、Bacillus、Escherichia-Shigella、PeptoclostridiumCaenimonas、Nitrosospira等为云南昭通特有的菌群,在巴西苹果园并未检测到,值得今后进一步关注。
4 结 论
研究结果为中国南方苹果果树栽培和果园管理以及生物菌肥的使用提供依据,为云南昭通苹果园根际土壤有益微生物的研究与应用奠定基础。
