木薯MeASR3基因的克隆及表达分析
2019-08-08铁韦韦丁泽红吴春来
颜 彦,铁韦韦,丁泽红,吴春来,胡 伟
(中国热带农业科学院热带生物技术研究所, 海南 海口 571101)
【研究意义】木薯(Manihotesculenta)是三大薯类之一,全球第六大粮食作物,具有抗旱、耐瘠薄、适应性广、块根淀粉产率高等特性。目前全球资源日趋紧缺,木薯作为一种高淀粉的生物能源作物,受到越来越多的重视[1]。ASR (abscisic acid, stress, ripening-induced)基因是在植物中发现的一类胁迫响应基因,广泛参与植物的干旱胁迫应答,并能提高植物的耐旱性。因此,对木薯ASR基因进行克隆及表达分析,有利于解析ASR基因在木薯耐旱机制中发挥的作用及调控途径。【前人研究进展】Iusem等在1993年首次发现ASR基因,因其表达受ABA、胁迫和成熟诱导而得名[2]。Hu等研究表明,在烟草中过表达TaASR1基因能提高转基因株系对干旱胁迫的耐受能力,在抗氧化系统中也发挥着重要作用[3]。玉米ZmASR1蛋白在维持干旱胁迫下玉米产量发挥着重要作用[4]。将香蕉MpASR基因在拟南芥中过表达,能提高拟南芥对渗透胁迫的耐受性[5]。【本研究切入点】基于ASR在植物中的重要功能,目前在水稻、玉米、大豆、番茄和苹果等多种植物中均鉴定出多个ASR基因[6],而木薯中仅有1个ASR基因被克隆[7]。【拟解决的关键问题】克隆木薯MeASR3基因,分析该基因的基本生物信息学特征,检测MeASR3在ABA处理和多种非生物胁迫下的表达模式,为揭示ASR基因在木薯耐旱机制中的作用提供参考。
1 材料与方法
1.1 材料
1.1.1 植物材料 选取木薯KU50为研究对象,从基地采回木薯茎秆,将其切成包含3~4个芽眼的小节,插入混有营养土和蛭石的小盆中生长。两个月后,选取发育良好且生长一致的木薯幼苗分别进行4种处理,每个处理组均有空白对照,具体为100 μmol/L ABA喷施木薯幼苗2、6、10、24、48、72 h后取叶片,10 mmol/L H2O2浇灌木薯幼苗2、6、10、24、48、72 h后取叶片,200 mmol/L NaCl浇灌木薯幼苗2 h、6 h、3 d、14 d、18 d、24 d后取叶片,300 mmol/L甘露醇浇灌木薯幼苗2 h、6 h、3 d、14 d、18 d、24 d、36 d后取叶片。将采好的样品经液氮速冻后立即放入超低温冰箱保存。
1.1.2 菌株、载体和试剂 大肠杆菌(E.coli)Top10、pGM-T载体、2×TaqMasterMix、RNA提取试剂盒购自天根生化科技有限公司,荧光定量SYBR GreenⅠ试剂盒购自宝生物有限公司, 限制性内切酶、T4DNA连接酶、反转录试剂盒购自赛默飞世尔科技有限公司。引物合成和测序由上海生工完成。甘露醇、脱落酸等生化试剂为进口分析纯试剂。
1.2 实验方法
1.2.1 总RNA提取及cDNA合成 提取不同处理下木薯叶片的总RNA,具体步骤参照天根公司RNA提取试剂盒的操作说明。随后,利用反转录试剂盒将提取的总RNA反转录成cDNA,保存在-20 ℃冰箱备用。
1.2.2 基因克隆 根据已有水稻、玉米等植物ASR基因序列,搜索木薯数据库寻找其同源序列,设计引物(ASR3F:5’-ATGGCCGAAGAAAAGCAC’;ASR3R:5’-GAAGAGATGGTGATGTCTT-3’) 以木薯叶片的cDNA为模板进行扩增目的基因,采用天根公司2×TaqMasterMix说明书上推荐的PCR扩增体系和程序。将PCR扩增产物经琼脂糖凝胶电泳检测,确定条带大小正确,回收产物后连接到pGM-T载体并转化大肠杆菌Top10,挑取单克隆在LB液体培养基中培养,进行菌液PCR鉴定,将阳性克隆送公司测序。
1.2.3 生物信息学分析 利用在线工具ProtParam (http://web.expasy.org/protparam/)预测MeASR3蛋白的理化性质;利用NCBI数据库的Blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)查找与MeASR3同源的其他物种的相关序列,进而使用Clustal X进行多重序列比对;利用MEGA软件中Neighbor-Joining (NJ)法构建进化树。
1.2.4 基因的表达分析 利用实时荧光定量PCR对目的基因进行表达分析。以反转录的cDNA为模板,木薯MeEF1基因为内参,设计引物(MeASR3引物:QASR3F:5’-CACAACCCAAATCCTTCT-3’,QASR3R:5’-GGTTTCTCCTCGTCCTTA-3’;MeEF1引物:QEF1F:5’-TGAACCACCCTGGTCAGATTGGAA-3’,QEF1R:5’-AACTTGGGCTCCTTCTCAAGCTCT-3’)进行检测。按照SYBR GreenⅠ试剂盒操作说明 设置荧光定量PCR的反应体系和反应程序。样品和内参均设置了3个技术重复,结果分析计算采用2-ΔΔCt法[8]。
2 结果与分析
2.1 MeASR3基因的克隆及序列分析
基于木薯数据库中的序列信息,找到一个与水稻ASR家族具有较高同源性的cDNA序列,将其命名为MeASR3。以获得的木薯幼苗叶片cDNA为模板,设计ASR3F/ASR3R引物扩增得到目的基因(图1)。将目的基因连接到pGM-T载体并转化大肠杆菌Top10,通过菌液PCR鉴定出阳性单克隆送测序,将测序正确的质粒保存在-20 ℃冰箱。
M:DL2000 marker;1:基因cDNA全长扩增结果M: DL2000 marker; 1: PCR product of the full-length cDNA of MeASR3图1 木薯MeASR3基因克隆Fig.1 PCR product of MeASR3 from cassava

甜橙(XP_006473073.3);毛果杨(XP_006383629.2);ABB基因型香蕉(ACZ60124.1);欧洲栓皮栎(XP_023913272.1)Citrus sinensis (XP_006473073.3); Populus trichocarpa (XP_006383629.2); Musa ABB Group (ACZ60124.1); Quercus suber (XP_023913272.1)图2 MeASR3与其它植物ASR蛋白的多序列比对分析Fig.2 Homologous sequence alignment of MeASR3 and ASR proteins from other plants
利用在线软件ProtParam对序列进行分析,发现该基因包含一个459 bp的完整开放阅读框,编码153个氨基酸,蛋白质分子量为17.51 kD,原子总数为2384,分子式为C766H1144N224O249S1;理论等电点为5.87,属酸性蛋白;亲水性平均数为-1.414,为亲水性蛋白。MeASR3中富含丙氨酸(Ala,20个,占13.1 %),谷氨酸(Glu,25个,占16.3 %),组氨酸(His,16个,占10.5 %),赖氨酸(Lys,17个,11.1 %)等氨基酸,与其他植物中报道的ASR的氨基酸组成比例较一致[9-11]。
2.2 MeASR3同源序列比对和进化树分析
利用NCBI Blast进行检索其他已知植物中与MeASR3同源的氨基酸序列,利用ClustalX软件对这些序列进行比对,随后利用MEGA软件对这些蛋白质序列进行进化关系分析。结果表明MeASR3蛋白含有ABA/WDS 超家族的保守结构域以及2个富含His的功能域,这是ASR家族蛋白的主要特征功能域(图2)。进化树结果表明MeASR3与橡胶树来源的ASR蛋白(XP_021673222.1)亲缘关系最近(图3)。上述结果表明MeASR3可能具有ASR家族的功能。
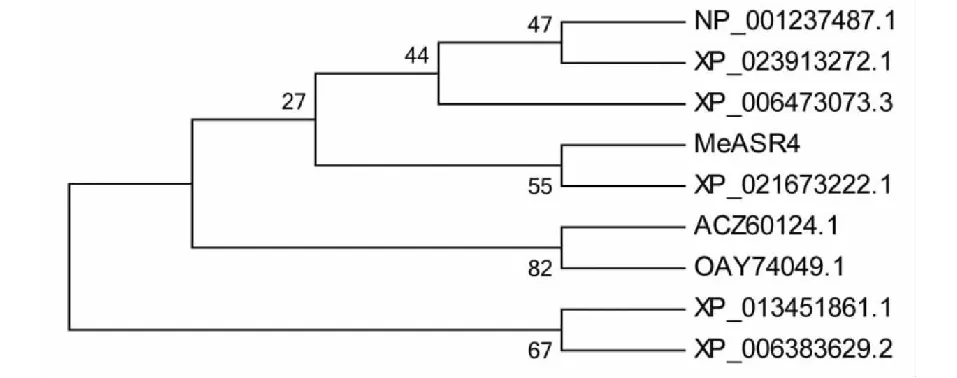
欧洲栓皮栎(XP_023913272.1);大豆(NP_001237487.1);甜橙(XP_006473073.3);橡胶树 (XP_021673222.1);ABB基因型香蕉(ACZ60124.1);菠萝(OAY74049.1);蒺藜苜蓿(XP_013 451861.1);毛果杨(XP_006383629.2)Quercus suber (XP_023913272.1); Glycine max (NP_001237487.1); Citrus sinensis (XP_006473073.3); Hevea brasiliensis (XP_021673222.1); Musa ABB Group (ACZ60124.1); Ananas comosus (OAY74049.1); Medicago truncatula (XP_013451861.1); Populus trichocarpa (XP_006383629.2)图3 基于ASR蛋白序列构建的系统发育进化树Fig.3 Phylogenetic analysis of MeASR3 and ASR proteins from other plants
2.3 MeASR3基因的表达分析
以木薯MeEF1基因为内参,利用实时荧光定量PCR的方法研究了木薯MeASR3基因在多种处理下的表达模式,结果表明,该基因与木薯的逆境响应密切相关(图4)。在ABA处理下,MeASR3的表达水平先下降随后恢复至正常水平,在处理6 h时表达水平最低。在H2O2的处理下,MeASR3的表达呈现整体上调的趋势,在处理2 h时表达量最高。在高盐胁迫下,MeASR3的表达均上调,在处理18 d时表达量提高了约2.5倍。在甘露醇处理后2 h至14 d之间,MeASR3的表达均无太大变化,但在处理18 d时表达量增加到对照的11倍左右。
3 讨 论
为了应对复杂的自然环境,植物进化形成了一套完整的信号转导途径以应对复杂多变的生长环境。ASR(abscisic acid, stress, ripening-induced)基因是在植物中发现的一类胁迫响应基因,广泛参与植物的果实成熟、糖代谢以及胁迫应答等重要的生理过程[12-15]。因此,对ASR基因的克隆和分析有助于解析植物在逆境胁迫下的抵御机制。
本研究利用PCR的方法从木薯品种KU50中成功克隆到一个ASR家族的基因,命名为MeASR3。该基因包含一个459 bp的完整开放阅读框,编码153个氨基酸,为亲水性蛋白。与其他物种的ASR蛋白进行多序列比对,发现该基因的氨基酸序列含有ASR家族蛋白的主要特征功能域。进化关系的分析结果表明MeASR3与橡胶树来源的ASR蛋白(XP_021673222.1)聚为一类,验证了木薯与橡胶树同属于大戟科,具有较近的亲缘关系。
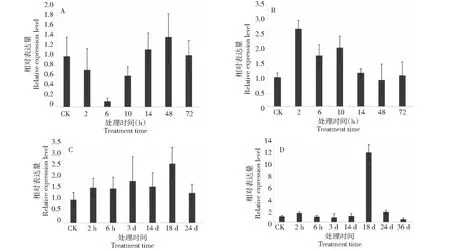
A: ABA处理(100 μmol/L ABA); B: 氧化胁迫处理(10 mmol/L H2O2); C: 盐胁迫处理(200 mmol/L NaCl); D: 模拟干旱处理(300 mmol/L甘露醇)A: ABA treatment (100 μmol/L ABA); B: Oxidative stress (10 mmol/L H2O2); C: Salt stress (200 mmol/L NaCl); D: Drought stress (300 mmol/L mannitol)图4 MeASR3在多种处理下的表达模式Fig.4 Expression patterns of MeASR3 in response to various treatments
对木薯MeASR3进行多种处理下的表达分析,发现ABA处理下该基因的表达水平先下调随后恢复至对照水平,表明该基因在ABA响应中可能发挥负调控作用。这个结果与水稻OsASR1、OsASR2和OsASR3以及茶树CsASR3在ABA处理下的表达情况一致[11,16]。在高盐胁迫和氧化胁迫下,该基因的表达受诱导;在甘露醇模拟的干旱胁迫下,该基因前期表达无显著变化,但在处理18 d时表达量增加到对照的11倍左右。上述结果表明MeASR3在木薯抵御盐胁迫、干旱胁迫以及氧化胁迫中均可能发挥正向调控功能。
4 结 论
克隆获得木薯MeASR3基因,cDNA长度为459 bp,编码153个氨基酸,Gene bank登录号为XM_021744431.1。在ABA处理下,该基因的表达水平先下调随后恢复至对照水平;在盐胁迫、干旱胁迫以及氧化胁迫下,该基因的表达呈上调趋势。以上结果表明MeASR3基因可能在ABA以及多种胁迫下的信号转导途径中发挥着不同功能。Chen等发现草莓FaASR蛋白通过与ABA互作进而调控草莓的果实成熟过程[17]。将番茄ASR1基因和盐角草SbASR1基因在烟草中分别进行超表达,发现在盐胁迫下,转基因植株的耐盐性均得到提升,同时植株体内Na+含量降低,表明这两个ASR基因可能通过参与信号通路进而调节植物Na+的含量,最终提升植株的耐盐性[18-19]。Li等人发现在拟南芥和水稻中超表达OsASR5能提高植株的抗旱能力,进一步研究发现该基因能调控ABA的合成、参与ABA和H2O2介导的气孔开闭,同时还能作为分子伴侣蛋白与逆境响应相关的蛋白质结合,通过上述3种途径OsASR5调控植株的耐旱性[20]。此外,ASR基因在植物抗重金属、糖代谢以及抗病中均具有重要作用[21-23]。本研究为后续深入探索MeASR3参与的信号通路及其互作蛋白及调控机制奠定了基础。
