双水相萃取法测定灯盏花及提取物中灯盏花乙素含量
2019-08-08杨万林李晚谊李智敏吴丽华杨德志杨亚玲王家金
肖 丹,胡 昕,杨万林,李晚谊,李智敏,吴丽华,张 庭,杨德志,杨亚玲,王家金*
(1.云南省农业科学院药用植物研究所,云南 昆明 650205;2.云南省农业科学院农产品加工研究所,云南 昆明 650223;3.昆明理工大学 生命科学与技术学院,云南 昆明 650500)
【研究意义】灯盏花主要产于云南、广西、贵州等地,又称灯盏细心,为菊科植物短葶飞蓬的干燥全草,其主要成分为黄酮类化合物,有效成分为灯盏花乙素[1]。具有清除活性氧自由基、溶解血栓、增强脑部血液流动和降低血管阻力等作用[2],临床上多用于治疗心脑血管等疾病[3~6]。作为国家重点开发的中药材,灯盏花在云南丽江、红河等地实现大规模种植。【前人研究进展】目前,灯盏花中有效成分——灯盏花乙素的提取主要为水浸提法、超声波提取法、溶剂回流法等[7]。《中华人民共和国药典》2015版药典中即采用溶剂回流的方法提取灯盏花乙素,而后再利用HPLC法测定灯盏花中灯盏花乙素含量。但使用双水相萃取技术提取灯盏花中灯盏花乙素的报道很少。【本研究切入点】双水相萃取是一种基于液-液萃取的技术,其以操作简单、萃取条件温和易于放大等一系列优点,已经广泛应用于天然产物分离、生物提取等领域[8-9]。近年来,有报道使用一种水溶性低级醇-盐双水相体系分离技术提取分离药用植物中的有效成分,克服传统双水相萃取中因聚合物粘度大造成的不易收集,不易回收等缺点[10-13]。【拟解决的关键问题】通过以无毒无害的低级醇(乙醇)与盐形成双水相体系,将其应用于灯盏花中灯盏花乙素的提取分离。
1 材料与方法
1.1 实验材料和试剂
灯盏花药材由云南易思高生物科技有限公司提供;灯盏花乙素对照品购自上海麦克林生化科技有限公司;乙醇、(NH4)2SO4、H3PO4、NaCl、Na2CO3、Na2SO4Na3PO4和NaOH均为分析纯,甲醇为色谱纯、水为超纯水。
1.2 实验仪器与色谱条件
KQ100DB型超声波清洗仪(昆山市超声仪器有限公司);pH计(雷磁PHS-3C);FA1004型万分之一分析天平(上海恒平科学仪器有限公司);HC-3018R高速冷冻离心机(安徽中科中佳科学仪器有限公司);德国IKA Lab Dancer小舞灵漩涡混匀器。
Agilent 1260高效液相色谱仪(配备四元泵、VWD检测器、自动进样器、柱温箱),色谱条件:Agilent TC-C18色谱柱(4.6 mm×150 mm,5 μm),流动相为甲醇-0.1 %磷酸溶液(40∶60),检测波长为335 nm,流速为1 mL/min,柱温箱为25 ℃。
1.3 实验方法
1.3.1 灯盏花粗提液的制备 将干燥后的灯盏花全草打粉至80目,取细粉0.1 g(精密称定),将其置于25 mL具塞离心管中,加入10 mL甲醇,密塞,称重,超声1 h,放冷称重,甲醇补足重量。然后于4000 r/min离心10 min,取上清液,加水稀释至50 mL,作为灯盏花乙素粗提液。
1.3.2 双水相萃取分离灯盏花乙素 考虑双水相体系的性质,选择乙醇作为提取溶剂。取10 mL灯盏花乙素粗提液至15 mL 离心管中,加入一定量的(NH4)2SO4和无水乙醇,调pH值至6,涡旋1 min,使其充分混合。然后以4000 r/min离心5 min,促使其分相。下层即为盐相,上层为乙醇萃取相。读取上下层体积之后(相比=萃取相体积/水相体积),用注射器移除下层水相。为防止萃取相中存在的盐对高效液相色谱仪造成腐蚀,萃取相中加甲醇0.5 mL进行脱盐处理,最后甲醇定容至2 mL,过0.45 μm有机相滤膜之后,取10 μl进HPLC进行分析。
1.3.3 灯盏花乙素含量测定 采用HPLC法测定灯盏花粗提液中灯盏花乙素含量。根据灯盏花乙素标准曲线计算其浓度,然后再按下式计算灯盏花乙素含量(%):
式中,R为萃取效率(%);Cu为灯盏花乙素在萃取相中的浓度(mg/mL);Vu为萃取相的体积(mL);m为称取的灯盏花粉末的质量(mg)。
2 结果与分析
2.1 双水相体系的形成与灯盏花乙素的萃取过程
所使用的乙醇能与水完全互溶,通过乙醇-水体系统加入(NH4)2SO4,利用盐析作用,促进乙醇与水相的分离。双水相体系的形成是(NH4)2SO4与乙醇争夺水分子的过程,随着盐浓度的增大,盐会夺取水分子,促使乙醇从盐相析出,使水分子离开乙醇相,最终出现分相,上层为乙醇相,下层为盐水相。为研究不同条件下,双水相体系中乙醇相的变化,通过以下公式计算相比Rv∶Rv=Vend∶Vin,式中,Vend为乙醇相的体积,Vin为加入的乙醇的初始体积。当Rv趋近于1时表示乙醇与水完全分离。
当初始乙醇的量较小时,促使溶液分相所需要加入的(NH4)2SO4量比较大;当初始乙醇的量较大时,促使溶液分相所需要加入的(NH4)2SO4量会相对减少,同时,相比Rv>1,说明双水相形成过程中有部分水进入乙醇相,导致溶液的分相能力变差。这主要是乙醇的水化能力较大,初始的量较大时,会影响其分相能力,不利于灯盏花乙素的富集。此外,无机盐的盐析能力越大,分相能力也越强。故选择合适的盐和加入合适量的乙醇,有助于双水相体系的形成。
灯盏花乙素属于黄酮类化合物,分子中含有多个酚羟基和羰基,在pH较高和较低情况下,会发生酚羟基氢离子的电离和羰基的质子化,最终变成大极性离子。由于酚羟基的存在,灯盏花乙素相当于多元弱酸,一般会以质子化阳离子形态、分子形态和失质子化阴离子形态存在。根据相似相溶的原理,弱极性的分子形态灯盏花乙素易富集于乙醇相中,而大极性离子形态的灯盏花乙素则易于分配在水相中。因此,溶液酸碱度对灯盏花乙素的分配起很重要作用。分子形态的灯盏花乙素结构上的酚羟基和羰基与乙醇羟基之间的氢键也非常有利于提高灯盏花乙素的分配比,使其易富集于乙醇中。
2.2 双水相体系的优化
2.2.1 不同盐对灯盏花乙素萃取率和相比的影响 乙醇能与水无限互溶,为使其分相,分别加入NaCl、(NH4)2SO4、Na2CO3、Na3PO4和Na2SO4几种盐与乙醇形成双水相体系。结果表明,只有(NH4)2SO4、Na2CO3和Na2SO4可以与乙醇形成双水相体系,但其对灯盏花乙素萃取率存在明显差异。加入相同的盐量,相比也存在差异。如图1所示,从中可以看出(NH4)2SO4对灯盏花乙素的萃取效果最好,并且使用(NH4)2SO4时乙醇相比更接近1。因此,研究中选择(NH4)2SO4作为分相盐。
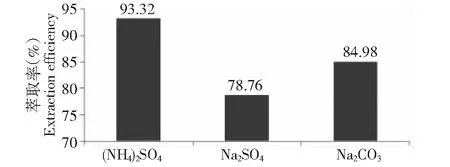
图1 盐种类对萃取率的影响Fig.1 Effect of the types of salt on extraction efficiency of scutellarin
2.2.2 (NH4)2SO4含量对灯盏花乙素萃取率的影响 乙醇加入量为1.5 mL,保持其他实验条件不变,分别考察盐质量分数为5 %、8 %、10 %、15 %、20 %、25 %和30 %时对萃取率的影响。如图2所示,在盐质量分数小于8 %时,溶液无法形成双水相,当盐质量分数大于8 %时,随着盐质量分数的增加,萃取率逐渐增加,当(NH4)2SO4质量分数为25 %时萃取率最高为93.4 %。故研究中,确定(NH4)2SO4最优质量分数为25 %。
2.2.3 乙醇用量对灯盏花乙素萃取率的影响 分别考察了不同量的乙醇(0.5,1,1.5,2,2.5和3 mL)对灯盏花乙素萃取率的影响。由图3可见,当乙醇的用量为0.5、1 和1.5 mL时,萃取率即能达到90 %以上,此时相比Rv均较接近于1。当乙醇用量逐渐增加时,萃取率反而有所下降,究其原因是,在盐的质量分数一定时,部分乙醇溶解于盐相之中,导致未达最优相比,萃取率降低。考虑到乙醇量较小时所使用盐的量较大,故选择1.5 mL即为最优的乙醇用量。

图2 (NH4)2SO4质量分数对萃取率的影响Fig.2 Effect of (NH4)2SO4 mass fraction on extraction efficiency of scutellarin
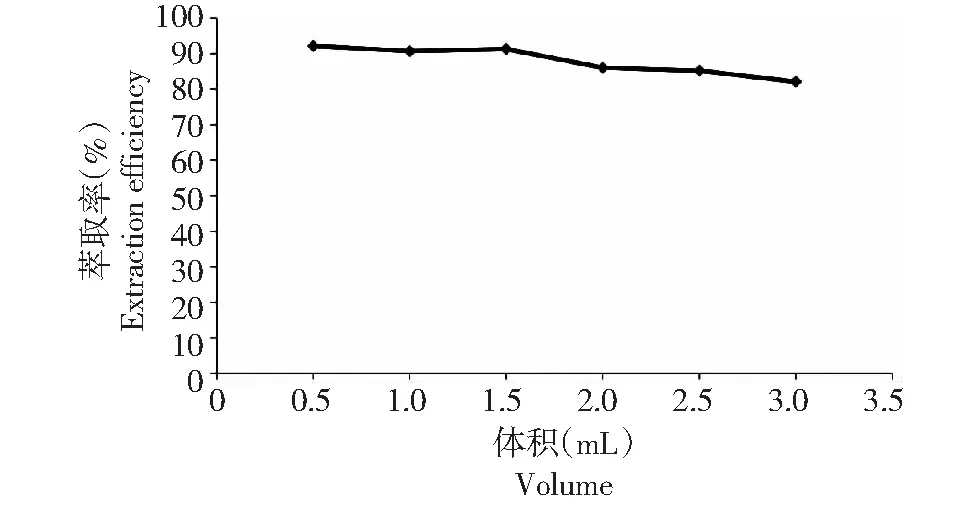
图3 乙醇用量对萃取率的影响Fig.3 Effect of the volume of ethanol on extraction efficiency of scutellarin
2.2.4 pH对灯盏花乙素萃取率的影响 在保持乙醇的用量为1.5 mL和盐的质量分数为25 %的条件下,调节体系的pH值在3~9,如图4所示。pH值为3~6时,灯盏花乙素的萃取率逐渐升高,pH值为6时,萃取率最高为94.3 %。当pH值大于7时,灯盏花乙素的萃取率较低。究其原因灯盏花乙素在弱酸性条件下呈分子状态,极性较小,在乙醇中的分配比更大。当溶液pH值较低时灯盏花乙素上的羰基会被质子化,pH值较高时氢离子又会被电离,都会形成极性较大的分子,分配比较低[14-15]。故选择pH=6.0为最优条件。
2.3 样品分析
2.3.1 线性范围 取适量灯盏花乙素对照品,加入甲醇溶解,使浓度为0.2 mg/mL,即得对照品储备液。取对照品溶液,分别稀释至0.1,0.075,0.050,0.020,0.010 和0.005 mg/mL,按照上述相同的色谱条件进样,以峰面积为纵坐标,对照品浓度为横坐标,绘制标准曲线,即得回归方程:Y=27.15X-194.36,r=0.9989,线性范围:0.005~0.1 mg/mL。
2.3.2 样品测定 在已优化的双水相萃取条件下,采用本方法萃取灯盏花粗提液中的灯盏花乙素,然后进HPLC 检测灯盏花乙素含量,色谱图如图5所示,结果见表1。试验中对灯盏花粗提液进行2个水平的加标回收实验(n=6),检测结果见表2。
由色谱图可见,经双水相萃取之后,可以进一步降低灯盏花中其它杂质的干扰,灯盏花乙素的色谱峰峰型也变的更好,与相近峰的干扰也较小。究其原因是乙醇-盐双水相体系能显著去除粗提液中极性物质分子和大分子杂质的干扰,在一定程度上纯化灯盏花乙素。由表1和图6可知,经过双水相萃取之后,灯盏花中灯盏花乙素已经被富集到乙醇相中,该方法萃取率达到94.2 %,并且双水相体系萃取后的检测结果为2.46 %,与2015版药典检测结果灯盏花乙素含量2.43 %更为接近。从表2可知,该方法准确性较好,能有效分离富集灯盏花粗提液中的灯盏花乙素,完全满足对灯盏花样品中灯盏花乙素含量的测定。

图4 pH对萃取率的影响Fig.4 Effect of pH on extraction efficiency of scutellarin

表1 粗提液样品检测结果

表2 粗提液中灯盏花乙素的加标回收率及相对标准偏差(n=6)
3 讨 论
在前人研究中,多使用95 %乙醇或三氯甲烷作为提取液[7],回流提取灯盏花乙素,然后提取液经过旋蒸等方法浓缩,甲醇定容后进行分析。也有通过大量甲醇超声提取灯盏花乙素,进行检测[16]。该方法使用甲醇提取之后,通过双水相方法富集提取液,简单快速、准确性高,并且所使用的双水相体系绿色环保、易于放大研究。本研究以乙醇与(NH4)2SO4制备双水相体系,利用双水相萃取提取灯盏花乙素粗提液中的灯盏花乙素,并最终对灯盏花乙素含量进行测定,研究表明双水相体系具有良好的净化性能,能有效降低灯盏花提取液中的大分子物质和极性分子的干扰。研究结果为灯盏花中灯盏花乙素的提取、含量测定提供了一种绿色环保、简单有效的方法。

A:双水相萃取样品;B:灯盏花粗提液 A: The sample after ATPS; B: Breviscapus crude extract图5 灯盏花粗提液与双水相萃取液的HPLC图谱Fig.5 HPLC analysis of breviscapus crude extract and the sample after ATPS

图6 双水相萃取灯盏花粗提液效果Fig.6 Effect of extracting the scutellarin from crude extract by ATPS
4 结 论
对灯盏花样品进行的检测和加标回收实验表明,采用乙醇与(NH4)2SO4双水相体系,且(NH4)2SO4质量分数为25 %,乙醇用量为1.5 mL,pH 6.0时,萃取灯盏花乙素粗提液中灯盏花乙素,方法准确性较高,结果可靠,且操作简单,绿色无污染;同时该双水相体系具有很好的净化性能,能显著降低灯盏花中其它物质的干扰。
