自噬在高糖条件下视网膜色素上皮细胞表达血管内皮生长因子促进RF/6A细胞血管生成中的作用△
2019-08-07李蓉姚杨杜军辉姚国敏王小娣张进
李蓉 姚杨 杜军辉 姚国敏 王小娣 张进
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的严重微血管并发症,也是全球工作人群致盲的首位眼病[1-2]。DR发生的病理机制十分复杂,普遍认为,高血糖是导致视网膜微血管慢性损伤的主要因素,最终促使病理性视网膜新生血管形成,即疾病晚期进入增生型DR(proliferative DR,PDR)期,从而严重威胁患者视力[3]。视网膜色素上皮细胞(retinal pigment epithelium,RPE)可分泌多种细胞因子,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)是促进新生血管形成的关键因子[4-6]。有研究证实,VEGF与眼内新生血管疾病的发生发展密切相关,VEGF的增加可显著促进PDR患者视网膜新生血管的形成[7]。
自噬是一种细胞内降解机制,通过溶酶体降解自身细胞质成分来满足细胞自身的代谢需要及细胞器的更新,从而维持细胞内环境稳态[8]。我们前期研究发现,缺氧或高糖条件下的自噬激活能够显著促进视网膜内皮细胞RF/6A的迁移和管腔样结构的形成[9-10]。RPE在生理状态下保持着基本的自噬水平,且随着年龄增长和疾病发生而改变[11]。基于此,本研究观察高糖条件下人RPE细胞自噬水平的变化对其VEGF蛋白表达、RF/6A细胞迁移和管腔样结构形成的影响,为进一步研究自噬在DR中的作用提供实验依据。
1 材料与方法
1.1 材料人RPE细胞株(ARPE-19,取5~10代细胞用于实验)、RF/6A细胞(武汉普诺赛生命科技有限公司);DMEM培养基、2.5 g·L-1胰蛋白酶及胎牛血清(美国Gibco公司);青霉素、链霉素(美国Hyclong公司);Transwell小室、Matrigel基质胶(美国BD公司);3-MA(美国Selleck公司);兔多抗自噬标志性蛋白微管相关蛋白1 轻链 3(microtubule-related protein 1 light chain 3,LC3)B(#2775),兔多抗Beclin-1(#3738)(美国Cell signaling公司),兔抗人自噬相关的特异性基因3(autophagy-related gene 3,Atg3;11262-2-AP,武汉三鹰生物技术有限公司);兔多抗GAPDH(AB-P-R 001,杭州贤至生物有限公司);HRP标记羊抗兔二抗(BA1054,武汉博士德生物工程有限公司);人VEGF ELISA试剂盒(欣博盛生物科技有限公司);倒置相差显微镜(日本Olympus公司,型号IX51);微型高速离心机(美国Labnet公司,型号C2500-R-230V);全自动酶标仪(美国Thermo scientific公司,型号Multiskan MK3)。
1.2 方法
1.2.1 细胞分组及处理2.5 g·L-1胰蛋白酶消化ARPE-19及RF/6A细胞,用DMEM培养基(含体积分数10%胎牛血清、100×103U·L-1青霉素和100 mg·L-1链霉素)终止消化,收集细胞PBS清洗后,吹打混匀制成单细胞悬液,传代至培养皿中,在37 ℃、含体积分数5%CO2饱和湿度条件下常规培养。取对数生长期的ARPE-19细胞按每孔500×103个接种于6孔板中,贴壁后将细胞分为对照组、高糖组、3-MA+高糖组,其中对照组在无糖DMEM中培养24 h;高糖组在DMEM培养基中加入30 mmol·L-1葡萄糖溶液处理24 h;3-MA+高糖组细胞先用10 mmol·L-13-MA处理24 h,然后处理方法同高糖组。此后,在RF/6A细胞培养液中分别加入以上三组ARPE-19细胞上清液,将RF/6A细胞也分为对照组、高糖组和3-MA+高糖组。
1.2.2 Western blot法检测各组ARPE-19细胞中LC3、Beclin-1和Atg3蛋白表达收集各组细胞,PBS洗3次,每次1 min,加入400 μL RIPA裂解液裂解细胞,离心提取总蛋白,BCA法测定蛋白浓度。取50 μg总蛋白上样,SDS-PAGE凝胶电泳,转膜,用含50 g·L-1脱脂奶粉的TBST溶液室温封闭2 h。滴加相应一抗,LC3、Beclin-1、Atg3及GADPH稀释比例均为11 000,4 ℃摇床孵育过夜。TBST充分洗膜,加入辣根过氧化物酶标记的羊抗兔二抗(150 000),室温下摇床孵育2 h,洗膜后ECL显色。凝胶成像分析系统对条带进行扫描分析,以GAPDH为内参,计算LC3-II/LC3-I比值及Beclin-1和Atg3蛋白相对表达量,每组重复测量3次,取其平均值。
1.2.3 ELISA法检测ARPE-19细胞外VEGF蛋白表达将处理好的细胞加入ELISA试剂盒的96孔酶标板中,每孔100 μL,加上覆膜,36 ℃反应 90 min;弃去板内液体,甩干后每孔加100 μL稀释后的生物素标记人VEGF抗体,加上覆膜,36 ℃温育 1 h;弃去液体,每孔加入350 μL的洗脱液洗3次,每次浸泡30 s;吸干液体,每孔加100 μL稀释后的酶结合稀释液或工作液,加上覆膜,36 ℃温育30 min;弃去孔内液体,甩干后洗板5次,每孔加入100 μL显色剂,酶标板加上覆膜37 ℃避光孵育15 min。结束后每孔加入100 μL终止液,立即用酶标仪在 450 nm 测定各孔吸光度(A)值。以VEGF标准品浓度为纵坐标,A值为横坐标,做直线相关回归分析,根据待测样本的A值在标准曲线上查出其VEGF浓度。
1.2.4 Transwell小室法检测RF/6A细胞的迁移能力取处于对数生长期的RF/6A细胞,2.5 g·L-1胰蛋白酶消化后,用DMEM培养基制成单细胞悬液,按每孔500×103个细胞均匀接种到6孔板中,37 ℃、含体积分数5%CO2饱和湿度条件过夜。按1.2.1分组处理细胞,胰蛋白酶消化收集,离心、去上清,PBS洗2次去掉残余血清,无血清培养基重悬细胞,调整细胞浓度至200×103mL-1。在24孔板中加入800 μL DMEM培养基(含体积分数10%胎牛血清、100×103U·L-1青霉素和100 mg·L-1链霉素),并放入Transwell小室,在上室分别接入200 μL各组细胞悬液,继续培养24 h。取出小室,PBS清洗一次,每次1 min,体积分数70%冰乙醇溶液固定细胞1 h,5 g·L-1结晶紫染液染色20 min,PBS清洗3次,每次1 min,干净棉球擦拭上室一侧未迁移细胞,显微镜下观察拍照、计数。
1.2.5 Matrigel胶法检测RF/6A细胞的管腔形成能力4 ℃过夜融化Matrigel胶,将每孔200 μL Matrigel胶加至24孔板,37 ℃孵育40 min。取按1.2.1方法处理过的细胞,按每孔200×103个接种于铺好胶的24孔板内,37 ℃、含体积分数5%CO2饱和湿度条件培养过夜。随机选取3个放大100倍的视野拍照,采用 Image J软件计算管腔数(每3个分叉处为1个血管腔),计算平均值。

2 结果
2.1 各组ARPE-19细胞中LC3-II/LC3-I比值、Beclin-1及Atg3蛋白相对表达量比较Western blot检测结果显示,对照组、高糖组和3-MA+高糖组细胞中LC3-II/LC3-I比值分别为0.405±0.095、0.932±0.024和0.635±0.048,Beclin-1蛋白相对表达量分别为0.205±0.035、0.590±0.120和0.425±0.082,Atg3蛋白相对表达量分别为0.277±0.035、0.539±0.071和0.389±0.019,各组整体比较差异均有统计学意义(LC3-II/LC3-I:F=52.92;Beclin-1:F=15.00;Atg3:F=23.38;均为P<0.01)。其中高糖组和3-MA+高糖组细胞中各指标均明显高于对照组,3-MA+高糖组细胞中各指标均明显低于高糖组,差异均有统计学意义(均为P<0.01)。见图1。
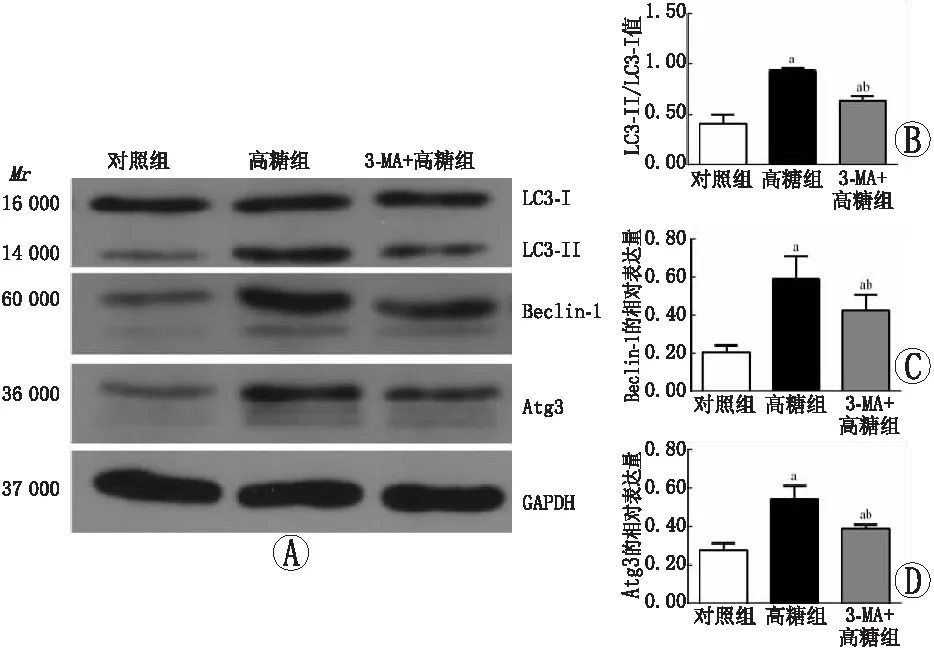
图1 各组细胞LC3-II/LC3-I、Beclin-1以及Atg3蛋白表达变化。A:LC3-II/LC3-I、Beclin-1和Atg3蛋白Western blot电泳图。B、C、D:各组细胞LC3-II/LC3-I、Beclin-1和Atg3蛋白相对表达量比较;与对照组比较,aP<0.01;与高糖组比较,bP<0.01(LSD-t检验,n=3);MA:甲基腺嘌呤
2.2 各组ARPE-19细胞外VEGF蛋白表达量比较ELISA检测结果显示,对照组、高糖组和3-MA+高糖组细胞上清液中VEGF蛋白表达量分别为(44.03±9.08)ng·L-1、(205.70±17.90)ng·L-1和(112.52±21.06)ng·L-1,各组整体比较差异有统计学意义(F=70.03,P<0.01)。其中高糖组和3-MA+高糖组细胞外VEGF蛋白表达量均明显高于对照组,3-MA+高糖组细胞外VEGF蛋白表达量明显低于高糖组,差异均有统计学意义(均为P<0.01)。
2.3 各组RF/6A细胞迁移数比较Matrigel胶法检测结果显示(图2),对照组、高糖组和3-MA+高糖组细胞迁移数分别为(125.60±6.35)个、(153.60±19.20)个和(67.40±7.95)个,各组整体比较差异有统计学意义(F=153.95,P<0.01)。其中高糖组细胞迁移数明显高于对照组,3-MA+高糖组细胞迁移数明显低于高糖组和对照组,差异均有统计学意义(均为P<0.01)。
2.4 各组RF/6A细胞管腔形成数比较细胞培养后24 h,各组细胞均有明显的管腔样结构形成,其中高糖组管腔形成较多,对照组和3-MA+高糖组管腔形成较少(图3)。对照组、高糖组和3-MA+高糖组细胞管腔形成数分别为(12.22±0.84)个、(18.44±1.68)个和(5.44±0.51)个;各组细胞管腔形成数整体比较差异有统计学意义(F=100.82,P<0.01)。其中高糖组细胞管腔形成数明显高于对照组,3-MA+高糖组细胞管腔形成数明显低于高糖组和对照组(均为P<0.01)。

图2 倒置显微镜下各组RF/6A细胞迁移情况(标尺=100 μm)。 A:对照组可见较多细胞迁移;B:高糖组迁移细胞明显多于对照组;C:3-MA+高糖组细胞迁移数明显少于高糖组和对照组;MA:甲基腺嘌呤。图3 倒置显微镜下各组RF/6A细胞管腔形成情况(标尺=100 μm)。A:对照组细胞管腔结构清晰可见;B:高糖组形成的管腔数明显多于对照组;C:3-MA+高糖组细胞形成的管腔数明显少于高糖组和对照组;MA:甲基腺嘌呤
3 讨论
本研究表明,高糖条件明显诱导RPE细胞的自噬激活,并促进RPE细胞表达VEGF蛋白以及RF/6A细胞的迁移和管腔形成过程;而抑制RPE细胞自噬能够降低其VEGF的表达水平和RF/6A细胞的血管形成。以上结果说明,自噬能够调控RPE细胞的VEGF表达,进一步促进高糖条件下视网膜血管生成。据此,调控RPE细胞表达关键细胞因子VEGF可能是自噬参与调控DR视网膜新生血管形成的重要途径。结合以往研究结果[9-10],我们认为自噬的激活可以一方面直接促进视网膜血管内皮细胞迁移和管腔形成,另一方面上调RPE细胞表达VEGF,间接促进视网膜血管内皮细胞血管形成,抑制自噬有望通过多种途径成为抑制视网膜病理性新生血管形成的新靶点。
RPE细胞具有多种复杂的生理生化功能,如屏障功能、吞噬功能、参与视循环代谢、抗氧化功能,其中分泌生长因子,如VEGF等参与自身的功能调节或多种眼部疾病的发生是RPE的重要功能之一[12]。研究证实,VEGF一方面能够促进血管内皮细胞分裂与增殖,增加血管通透性,诱导血管生成[4];另一方面还能上调血浆纤溶酶原激活物表达,引起血浆蛋白外渗,激活多元醇代谢途径,增加内皮细胞对葡萄糖的转运,诱发甘油二酯和蛋白激酶C机制,促进血管生长[5-6]。在DR的发生发展过程中,血-视网膜屏障破坏致使某些细胞因子渗入眼内,刺激视网膜VEGF的表达,眼内液中VEGF的含量也同时增高[13];另外内皮细胞上VEGF受体数目增多、亲和力增强,VEGF与受体结合后促使血管内皮细胞增殖,最终共同导致视网膜新生血管形成[14]。正常情况下,内源性血管抑制因子的影响占优势,故无病理性血管形成。在病理状态下,会导致血管生成因子表达的增多和(或)血管抑制因子降低,导致视网膜新生血管产生。在PDR患者眼内,VEGF表达升高而血管抑制因子表达降低可能是新生血管形成的主要原因[15]。本研究以ARPE-19细胞为观察对象,发现在高糖条件下,RPE细胞表达VEGF明显增加,进而促进RF/6A细胞的迁移和管腔形成,与既往研究结果相符。
一般情况下,处于正常范围内的自噬对细胞能够起到一定的保护与修复作用,以利于细胞应对各种应激[16]。LC3、Beclin-1、Atg3等被广泛用作自噬标记蛋白。在自噬体的形成过程中,ATG12-ATG5系统和 LC3(ATG8)两个泛素样结合系统负责自噬体膜的延伸,Atg3和ATG5是ATG12-ATG5泛素样蛋白结合系统的重要组成分子[17]。LC3以 LC3-I(胞浆型)和 LC3-II(膜型) 两种形式存在,当自噬形成时,LC3-I酶解掉一小段多肽,转变为LC3-II[18]。Beclin-1是酵母ATG6的同源基因,是其他自噬蛋白基因参与自噬形成过程的关键成分[19]。LC-II/LC-I常与Beclin-1、Atg3等蛋白水平相结合以评价细胞自噬水平的高低。3-MA是广泛用于自噬研究的Class III PI3K抑制剂,作用于早期自噬诱导阶段,特异性阻断自噬体的形成,使LC3-II/LC3-I下降,并抑制Beclin-1、Atg3的表达[20]。本研究结果表明,在高糖环境下,RPE细胞的自噬被激活,LC3-II/I、Beclin-1及Atg3蛋白表达增加;3-MA作用抑制自噬体的形成,导致以上蛋白表达下降。此外,10 mmol·L-1是用3-MA作用于ARPE-19 细胞的常用浓度[21],故本研究也同样采用此浓度用于实验。
总之,本研究结果初步提示除直接影响血管生成过程外,调控RPE细胞表达VEGF可能是自噬促进DR视网膜新生血管形成的另一重要途径。不过,自噬对RPE细胞表达VEGF的具体机制仍需进一步研究。此外,本研究将ARPE-19细胞上清液加入RF/6A细胞培养基中,只检测了上清液中的VEGF蛋白含量,故不能排除RPE细胞表达的其他生长因子对RF/6A细胞的影响,在后续研究中应利用VEGF特异性抑制剂等方法进行观察。
