室旁核IL-1β介导CRH神经元敏化参与大鼠慢性内脏痛
2019-08-07陈自洋饶竹青孙晓迪李竞进
陈自洋 饶竹青 孙晓迪 李竞进
(南京医科大学第一附属医院麻醉科,南京 210009)
慢性内脏痛是多因素导致的高发性和顽固性疾病,严重影响患病人的生活质量且耗费大量医疗资源[1]。由于引起慢性内脏痛的确切分子生物学机制尚不清楚,目前临床仍缺乏有效的药物治疗。下丘脑-垂体-肾上腺皮质轴(hypothalamic-pituitary-adrenal, HPA)是联系脑和肠道的关键轴,参与肠道功能调控,HPA轴功能亢进可导致慢性内脏痛病人内脏高敏[2]。促肾上腺皮质激素释放激素(corticotrophin-releasing hormone, CRH)是HPA轴最高级中枢下丘脑室旁核(paraventricular nucleus, PVN)分泌的重要应激激素,且参与慢性内脏痛调控[3,4]。研究显示,PVN内CRH神经元敏化介导了慢性内脏痛的发生与发展,但触发PVN内CRH神经元敏化的上游分子机制仍不明确。IL-1β是重要的促炎性细胞因子,在慢性疼痛的产生与维持过程中发挥重要作用,其主要通过增加神经元的兴奋性导致中枢敏化[5~7]。本文主要目的是首先观察PVN内IL-1β在慢性内脏痛中的作用,探讨PVN内IL-1β是否敏化CRH神经元,从而参与慢性内脏痛的调节,进而明确IL-1β是CRH神经元敏化的上游分子,为临床慢性内脏痛的防治提供新靶点及理论依据。
方 法
1.动物选择及分组
本研究获南京医科大学实验动物中心伦理委员会批准。清洁级健康雄性Sprague-Dawley (SD)大鼠32只,8日龄,采用随机数字表法分为4组(n= 8):假手术+ PBS组(Sham + PBS组)、假手术 + IL-1β抑制剂组(Sham + Gevokizumab组)、模型+ PBS组(CRD + PBS组)、模型+ IL-1β抑制剂组(CRD + Gevokizumab组)。同窝子鼠平均分入各组,Sham组大鼠不进行结直肠扩张,CRD组制备大鼠慢性内脏痛模型;出生后第8周,通过立体定位法室旁核微量注射0.5 μl的IL-1β抑制剂Gevokizumab 5 μg或PBS,2 h后测定内脏痛阈值;所有新生大鼠均与母鼠同笼直到第28 d,鼠乳喂养。母婴分离后,每4只子鼠1笼,保持室温23±1℃及12 h/12 h明暗光照,自由进食和进水。于出生后第8周评估大鼠内脏痛行为。
2.主要试剂和仪器
小鼠抗大鼠CRH(100 μg,35748,Abcam公司,美国),Alexa 488 驴抗鼠 IgG (500 μl,A21202,Life Technologies公司,美国),兔抗大鼠c-Fos(100 μl,190289,Abcam公司,美国),Alexa594驴抗兔IgG(500 μl,A21207,Life Technologies公司,美国),IL-1β抑制剂Gevokizumab(052,XOMA公司,美国),荧光显微镜(Olympus IX-81,日本),鼠脑立体定位仪(瑞沃德,深圳)。
3.慢性内脏痛模型制备
参照文献[8],通过对新生期大鼠反复结直肠扩张(colorectal distension, CRD)制备慢性内脏痛模型。新生大鼠于出生后第8、10、12 d,每天上午固定时间给予两次结直肠扩张,两次时间间隔30 min。结直肠扩张是将直径3 mm,长20 mm的血管成形术导管从肛门插入至清醒新生大鼠的降结肠,用0.3 ml水扩张产生60 mmHg的压力在结肠内留置1 min后,将其减压退出。Sham组大鼠除未进行结直肠扩张外,其它操作均与CRD组相同。
4.PVN内微量注射
各组大鼠饲养到第8周,体重200~250 g,七氟醚麻醉后,取仰卧位固定,备皮,碘伏消毒,固定于脑立体定位仪上,沿正中线切开头皮,骨膜,在相应位置用手术刀片纵行切开一个长切口,双氧水脱去骨膜,通过立体定位仪定位,亚甲蓝标记后用消毒过的微型钻头钻孔,术野滴少量人工脑脊液以防干燥。通过立体定位仪分别将载有IL-1β抑制剂Gevokizumab或 PBS 0.5 μl的微量注射器针尖缓慢(约1 min)插至下丘脑PVN (AP -1.6 mm,R ± 0.4 mm, H -7.8 mm),缓慢(约3 min)注射药物,留针10 min后缓慢(约1 min)拔出针尖。骨蜡封闭钻孔,缝合伤口,并用抗生素处理。
5.痛阈测定
大鼠出生后第8周,PVN内给药后2 h时,七氟醚麻醉后,将未充气的球囊涂石蜡油后插入结直肠内,将大鼠放置在20 cm×6 cm×8 cm的玻璃箱内观察,约15 min大鼠完全适应后开始实验。压力扩张范围10 mmHg~80 mmHg,每次扩张压力重复3次,取平均值,通过注射器持续、匀速缓慢加压,每10 mmHg为一压力梯度,每个压力停留10 s,间隔4 min,以肉眼观察出现明显的下腹壁抬离箱底或明显收缩变平时的最小压力为痛阈。
6.免疫荧光染色检测
内脏痛行为学测试结束后,七氟醚麻醉大鼠,迅速开胸暴露心脏经升主动脉插管,依次灌注0.9%生理盐水200 ml及4%多聚甲醛300 ml,大鼠灌注后取脑,多聚甲醛后固定于4 ℃ 过夜,然后放入30%蔗糖中脱水。脑组织冠状冰冻连续切片(厚度30 μm),贴片室温晾干后 PBS 漂洗,用含有0.3%Triton X-100的10%驴血清室温封闭2 h,加入兔抗大鼠c-Fos抗体以及小鼠抗大鼠CRH抗体,4℃孵育过夜后,PBS漂洗10 min×3 遍,暗室内加入Alexa 594驴抗兔IgG和Alexa 488驴抗鼠IgG,二抗室温孵育2 h,PBS漂洗10 min×5遍,室温避光晾干后,无水甘油封片,IX-81共聚焦显微镜下观察拍片、计数。
7.统计学处理
采用SPSS 19.0统计学软件进行数据分析,正态分布的计量资料以均数±标准差(±SD)表示,组间比较采用单因素方差分析,P< 0.05表示差异有统计学意义。
结 果
1.PVN内微量注射IL-1β抑制剂Gevokizumab对大鼠内脏痛行为的影响
与Sham + PBS组(59.1±4.2)、Sham + Gevokizumab组(55.9±3.8)相比,CRD + PBS组(38.3±3.1)大鼠痛阈值明显降低(P< 0.05,见图1);CRD +Gevokizumab组(46.2±4.3)较CRD + PBS组大鼠痛阈值明显增加(P< 0.05,见图1)。表明PVN内IL-1β参与了大鼠慢性内脏痛的调节。
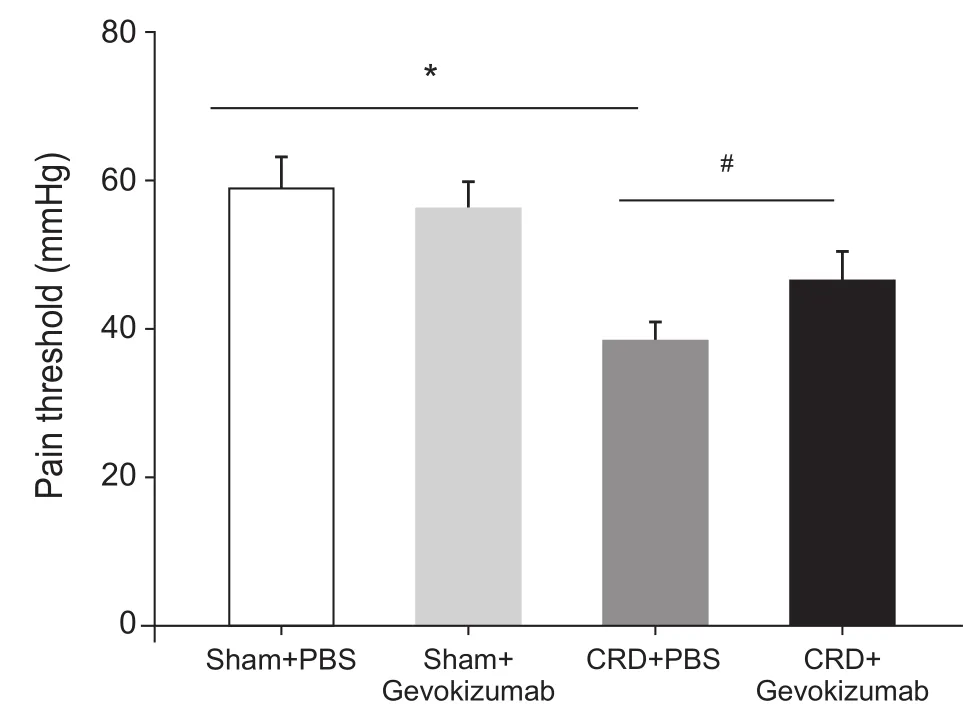
图1 各组大鼠痛阈值比较(n = 8,±SD)*P < 0.05,与 Sham + PBS 组、Sham + Gevokizumab组相比;#P < 0.05,与CRD + PBS组相比Fig.1 Comparison of pain thresholds in rats of different groups (n = 8,±SD)*P < 0.05, compared with Sham + PBS group and Sham + Gevokizumab group; #P < 0.05, compared with CRD + PBS group.
2.PVN内微量注射IL-1β抑制剂Gevokizumab对c-Fos表达的影响
c-Fos是神经元活化的标志物,免疫荧光结果 显 示, 与 Sham + PBS组 (61.2±8.1)、Sham +Gevokizumab组 (60.5±5.3)相 比,CRD + PBS组(101.3±8.9)大鼠PVN内c-Fos表达明显增加(P<0.05,见图2);CRD + Gevokizumab (80.8±4.8)组较CRD + PBS组大鼠c-Fos表达明显降低(P< 0.05,见图2)。表明PVN内IL-1β介导神经元敏化参与了大鼠慢性内脏痛的调节。
3.PVN内微量注射IL-1β抑制剂Gevokizumab对CRH神经元敏化的影响
免疫荧光结果显示,与Sham + PBS组(26.5±3.3)、Sham + Gevokizumab 组 (23.8±4.0)相比,CRD + PBS组 (58.2±6.5)大 鼠 PVN内 CRH与c-Fos共标比例明显增加(P< 0.05,见图3);CRD + Gevokizumab组 (42.1±3.4)较 CRD + PBS组大鼠CRH与c-Fos共标比例明显降低(P< 0.05,见图3)。表明PVN内IL-1β介导CRH神经元敏化参与了大鼠慢性内脏痛的调节。
讨 论
随着人们对高质量生活的追求,内脏性疼痛被更多的人们所重视。早期不良生活经历是导致成年后慢性内脏痛的重要因素,尤其是新生期,为伤害性感觉神经回路发育的关键时期,此时的伤害性刺激可以导致新生个体神经传入通路永久性的改变[9]。临床研究发现,慢性内脏痛病人与健康对照受试者相比,多有童年期不良生活应激的经历[10]。动物实验也显示,大鼠新生期CRD可导致其成年后慢性内脏高敏,是慢性内脏高敏的常用动物模型[11]。
大脑与远离它的肠道有丰富的网络联系,其中HPA轴是联系脑和肠道的关键环节, HPA轴持续亢进,可导致外周肠道释放多种促炎介质,激活内脏痛觉传导通路,从而引起慢性内脏痛[2]。HPA轴的最高级中枢位于PVN,既往研究显示PVN区是调控疼痛的关键脑区,在神经病理性疼痛、炎性疼痛中发挥重要作用[12,13]。最近研究发现,PVN区也参与了慢性内脏痛的调控[7]。目前大量研究证实,PVN内CRH神经元敏化是慢性内脏痛发病的重要机制[3,4,7],但介导CRH神经元敏化的上游分子机制尚不明确。
促炎细胞因子可以增强其周围神经元的兴奋性,产生兴奋后突触后电位,导致慢性疼痛的产生与维持[5]。其中IL-1β是一种典型的多功能促炎细胞因子,是引起炎症及免疫反应的关键因子之一,在内脏痛、神经病理性疼痛、炎性痛等慢性疼痛中发挥重要作用[11,14]。研究报道,慢性内脏痛大鼠
PVN内IL-1β表达明显增加[7];本研究进一步发现,PVN内微量注射IL-1β抑制剂Gevokizumab可缓解慢性内脏痛大鼠的内脏高敏。表明,PVN内IL-1β参与了大鼠慢性内脏痛的调控。然而, PVN内IL-1β是否通过介导CRH神经元敏化参与大鼠慢性内脏痛的调节仍不明确。

图2 各组大鼠c-Fos的表达数量(n = 4,±SD)*P < 0.05,与Sham + PBS组、Sham + Gevokizumab组相比;#P < 0.05,与CRD + PBS组相比Fig.2 Comparison of the number of c-Fos expression between different groups (n = 4,±SD)Representative images of immuno fl uorescence labeling for c-Fos (Red) in PVN (outlined by white dashed lines).A: Sham + PBS group; B: Sham + Gevokizumab group; C: CRD + PBS group; D: CRD + Gevokizumab group; E:quantitative analysis of c-Fos expression in PVN. *P < 0.05, compared with Sham + PBS group and Sham + Gevokizumab group; #P < 0.05, compared with CRD + PBS group.
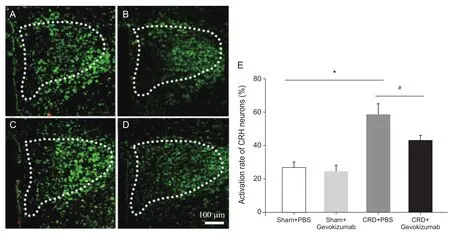
图3 各组大鼠CRH神经元的活化率(n = 4,±SD)*P < 0.05,与Sham + PBS组、Sham + Gevokizumab组相比;#P < 0.05,与CRD + PBS组相比Fig.3 Comparison of the activation rate of CRH neurons between different groups (n = 4,±SD)Representative images of immuno fl uorescence labeling for CRH (Green) and c-fos (Red) in PVN (outlined by white dashed lines). A: Sham + PBS group; B: Sham + Gevokizumab group; C: CRD + PBS group; D: CRD + Gevokizumab group; E:quantitative analysis of the activation rate of CRH neurons in PVN. *P < 0.05, compared with Sham + PBS group and Sham + Gevokizumab group; #P < 0.05, compared with CRD + PBS group.
本研究检测了c-Fos,作为即刻早期基因,其是神经元活化的标志物,可介导神经信号的一系列反应,在一些刺激所致的大脑区域被明显激活[15]。本研究结果显示,慢性内脏痛大鼠PVN内c-Fos表达较对照组明显增加;PVN内微量注射IL-1β抑制剂Gevokizumab可降低慢性内脏痛大鼠c-Fos表达的数量,提示PVN内IL-1β可导致神经元兴奋性增加,从而参与大鼠慢性内脏痛调节。我们进一步明确是否PVN内IL-1β介导了CRH神经元的兴奋性增加。结果显示,慢性内脏痛大鼠PVN内CRH神经元与c-Fos共标的比例明显增加;PVN内微量注射IL-1β抑制剂Gevokizumab可降低慢性内脏痛大鼠CRH神经元与c-Fos共标的比例,表明PVN内IL-1β介导了CRH神经元敏化。基于上述实验,我们认为PVN内IL-1β介导了CRH神经元敏化,进而参与了大鼠慢性内脏痛的发生与发展。既往研究发现,PVN内不存在IL-1β受体,其可能通过间接作用促进了CRH神经元敏化[16],其确切机制需进一步研究。
综上所述,PVN内IL-1β介导了CRH神经元敏化,进而参与大鼠慢性内脏痛的调节。本研究对进一步认识慢性内脏痛的病理生理机制,以及对临床上慢性内脏痛病人针对IL-1β这一潜在靶点进行干预从而缓解其内脏高敏具有重要的意义。然而,本实验只是从形态学方面观察了CRH神经元活化的特性,进一步的研究将应用电生理记录CRH神经元的放电频率,从而证实IL-1β与CRH神经元的相关性。
