基于稳定同位素分析中国南方沼蛤的食性
2019-08-06杜至力张锐坚
杜至力 张锐坚
摘要:沼蛤(Limnoperna fortunei)作为亚洲地区淡水环境中主要的土著双壳贝类群之一,其滤食生理活动对水环境产生重要的影响。本研究以沼蛤以及浮游生物(plankton)、悬浮有机颗粒(POM)和沉淀有机颗粒(SOM)为研究对象,检测以上研究对象的稳定碳同位素,分析沼蛤可能的食物来源。经同位素线性混合模型计算,POM(约占57.6 - 65.2%)是沼蛤的主要食物源,其次分别为浮游生物(约占19.8 - 28.2%)和SOM(约占10.2 - 21.1%)。
关键词:沼蛤;食性分析;稳定同位素
中图分类号:X174 文献标识码:A 文章编号:2095-672X(2019)04-0-02
Abstract:Limnoperna fortunei (L. fortunei ) is one of the most abundant freshwater bivalves in southeast Asia, with wide-ranging direct and indirect impacts on ecosystems. To estimate material flows in the habitats of L. fortunei, a stable-isotope analyses was applied to assess the feeding spectrum of L. fortunei in southern China. Using the isotope-mixing model, the contribution proportions to the diet of L. fortunei were estimated as 19.8%–28.2% for plankton, 57.6%–65.2% for particulate organic matter (POM) and 10.2%–21.1% for sediment organic matter. We conclude that POM is the principal food source of L. fortunei.
Keyword:Limnoperna fortunei; Feeding ecology; Stable isotope
1 簡介
沼蛤(Limnoperna fortunei),同种异名湖沼股蛤(Limnoperna lacustris),又称金贻贝(Golden mussl)、淡水壳菜,是一种亚洲淡水贻贝,属软体动物门(Mollusca),双壳纲 (Bivalvia),贻贝科(Mytilidae),股蛤属(Limnoperna)[1]。沼蛤原产于东南亚地区的淡水河流和湖泊中,曾入侵香港的原水供水系统,其在管道及泵房造成生物污损密度达每平方米11,000个[2]。由于沼蛤具有很强的适应性和群集性,沼蛤的侵入将影响原有水生食物链的平衡,并改变原水体中的底栖生物群落结构。
目前,本地区对沼蛤的研究集中在其作为生物污损物种的生理习性[3]和治理[4]等方向,而对它的食性分析及其对浮游生物的影响则较少。本研究选择原水管中附着生长的沼蛤为研究对象,应用稳定碳同位素比值法分析沼蛤可能的食物来源。
2 试验部分
2.1 样本采集和预处理
研究所用plankton样本、POM样本和SOM样本于2016年3 - 11月期间每月取自广东西江流域,采样点水质长期属于 I 类地表水。采用孔径为60 ?m的浮游生物网于水深2 - 8m,在垂直方向反复多次拖网采集plankton样本。采集30 L淡水并分装存于经酸洗预处理的聚乙烯瓶中,用于过滤分离提取POM样本。使用沉淀颗粒采集器于8 - 10m水深处采集SOM样本。在采集上述样本的同时,用深潜的方式采集河床深度为2 - 10m的沼蛤样本(体长 ≥ 22 mm)。所有样本采集后需迅速存于4℃冷藏环境中,然后运至实验室进行预处理。
上述样本在检测之前均需进行预处理。plankton样本首先进行冷冻干燥,然后研磨成粉末装在经酸洗预处理的聚乙烯袋中-80℃保存;用于过滤提取POM的水样,首先采用孔径为200 ?m的筛网去除大颗粒物,然后再用玻璃纤维滤膜过滤,用超纯水洗出过滤物,冰冻干燥并装在经酸洗预处理的聚乙烯袋中-80℃保存;SOM样本首先进行冰冻干燥,然后用300 ?m的钢筛网去除大颗粒物,并装在经酸洗预处理的聚乙烯袋中-80℃保存;在提取消化腺组织之前,沼蛤样本需采用经过滤的河水培养24小时,然后采用塑料刀解剖,所得的消化腺组织最后用超纯水超声清洗。10个沼蛤样本的消化腺组织为一个待测样本,每个待测样本首先冰冻干燥,并装在经酸洗预处理的聚乙烯袋中-80℃保存。
2.2 稳定碳同位素比值法
稳定碳同位素的检测参考Deniro等人的方法[5]。plankton样本、POM样本、SOM样本和沼蛤待测样本分别用450℃预灼烧后的玻璃研钵研磨成均一粉末,不同样本预处理的过程之间,需分别用水和无水乙醇将研钵冲洗干净并风干。研磨后的样本置于灼烧过的称量瓶中,密封-20℃保存待分析。此外,为了排除plankton样本中的无机碳类杂质干扰δ13C 测定,plankton样本需进行第二步的预处理(酸化处理),称取20–50 mg样本至小试管,加入1N HCl (GR) 于4℃下酸化4小时让CO2气泡放出,酸化过程中需确保HCl与plankton样本充分混合,每30 min震荡试管一次。酸化后离心分离吸出液体,50℃烘干,重新研磨成粉,置于灼烧过的称量瓶中,密封-20℃保存待分析。
分析用仪器为Elementar元素分析仪(Vario PYRO cube,德国Elementar),具体的操作参数为:氧化炉温度1120 ℃;还原炉温度650 ℃;TCD检测器温度60 ℃;元素分析仪载气流速230 ml/min;进同位素比质谱仪130 ml/min。
2.3 数据处理
数据分析采用SPSS软件(版本号19.0)。稳定同位素δ13C显著性差异(P < 0.05)分析采用Students t-test和单因素方差分析(one-way ANOVA, P < 0.05)。
参考Philips等人[6]的稳定同位素混合模型,分析沼蛤摄食plankton、POM和SOM的相对比例。按照Fukumori等人[7]对稳定同位素混合模型设定的贻贝类分段值0.8,则plankton、POM和SOM对沼蛤食物来源的贡献率计算采用式(1)标准的线性混合模型为:
3 结果
3.1 稳定同位素δ13C特征
Plankton、POM、SOM和沼蛤的平均δ13C值如表1所示。Plankton的δ13C值为-23.38‰ ~ -20.68‰;POM的δ13C值为-23.52‰ ~ -20.99‰;SOM的δ13C值为-26.72‰ ~ -19.30‰;沼蛤的δ13C值为-21.62‰ ~ -19.91‰。单因素方差分析结果显示,Plankton、POM、SOM和沼蛤的δ13C值存在显著差异。
3.2 沼蛤摄食plankton、POM和SOM的相对比例
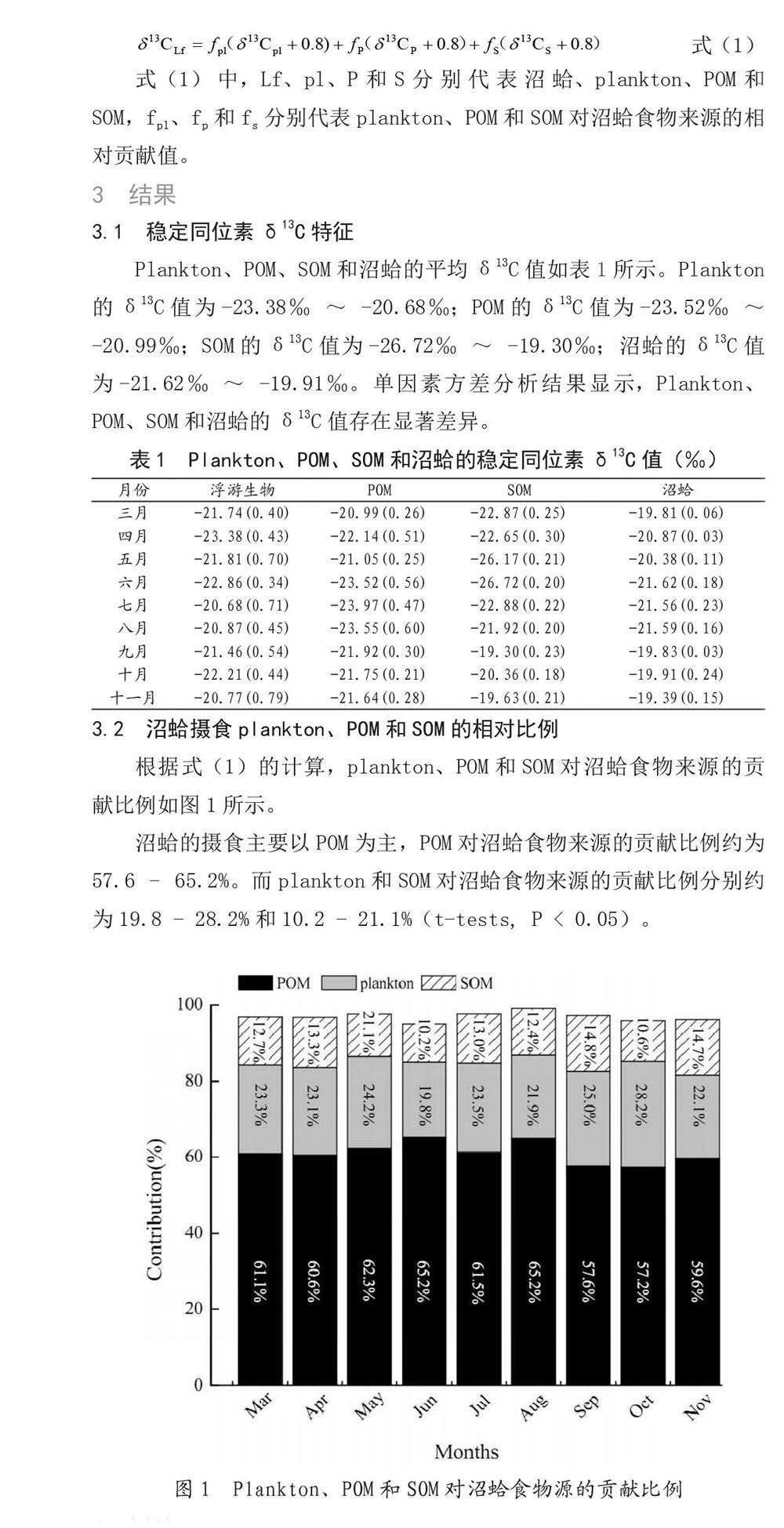
根据式(1)的计算,plankton、POM和SOM对沼蛤食物来源的贡献比例如图1所示。
沼蛤的摄食主要以POM为主,POM对沼蛤食物来源的贡献比例约为57.6 - 65.2%。而plankton和SOM对沼蛤食物来源的贡献比例分别约为19.8 - 28.2%和10.2 - 21.1%(t-tests, P < 0.05)。
4 讨论
由于表1中关于plankton、POM、SOM和沼蛤样本的稳定同位素δ13C 值存在显著差异,因此本文采用稳定同位素混合线性模型(见式(1))计算plankton、POM、SOM作为沼蛤食物来源的相对比例。图1所示,沼蛤主要摄食POM,其次分别为plankton和SOM。类似于同类型的研究,POM是滤食性贻贝的主要食物来源,珍珠贝(Pinctada fucata martensii)占总量78.0%的碳元素来自于POM[8],而菲律宾蛤仔(Ruditapes philippinarum)占總量61.0%的碳元素同样来自于POM [7]。另一方面,沼蛤的稳定同位素δ13C高于其主要食物源POM(0.67% - 2.41%),其原因可能在于POM中的稳定同位素δ13C会富集在沼蛤体内。
根据稳定同位素指纹数据,沼蛤倾向于从POM中积极摄食浮游藻类和异养微生物。尽管有研究[9]指出,部分滤食性贻贝不会选择性地摄食,但沼蛤则具备这种选择性摄食能力,其原因可能在于,沼蛤通过滤鳃进行选择性摄食。Wong等人[10]认为贻贝类生物是根据食物源的化学属性和表面特征进行选择性摄食,而不是按照实物粒径大小。
5 结论
本研究探讨了中国南方沼蛤的摄食特征,采用稳定同位素模型计算,POM(约占57.6 - 65.2%)是沼蛤的主要食物源,其次分别为浮游生物(约占19.8 - 28.2%)和SOM(约占10.2 - 21.1%)。
参考文献
[1]王祯瑞.中国动物志:软体动物门.双壳纲.贻贝目[M].北京:科学出版社,1997:28-42,210-213.
[2]Boltovskoy D, Karatayev A, Burlakova L, et al. Significant ecosystem-wide effects of the swiftly spreading invasive freshwater bivalve Limnoperna fortunei[J]. Hydrobiologia, 2009,636(1):271-284.
[3]莫顿.香港未经净化的食用水管道中附着沼蛤的生殖周期[J].海洋与湖沼,1982,13(4):312-319.
[4]徐梦珍.底栖动物沼蛤对输水通道的入侵及防治试验研究[D].北京:清华大学,2012.
[5]Deniro M J, Epstein S. 1978. Influence of diet on the distribution of carbon isotopes in animals. Geochimica Et Cosmochimica Acta.42(5):495-506.
[6]Phillips, D. L. 2001. Mixing models in analyses of diet using multiple stable isotopes: a critique. Oecologia,127(2): 166-170.
[7]Fukumori K, Oi M, Doi H, et al. 2008. Food sources of the pearl oyster in coastal ecosystems of Japan: Evidence from diet and stable isotope analysis. Estuarine Coastal and Shelf Science.76(3):704-709.
[8]Kanaya G, Nobata E, Toya T, et al. 2005. Effects of different feeding habits of three bivalve species on sediment characteristics and benthic diatom abundance. Marine Ecology Progress.299(1):67-78.
[9]Ward J E, Levinton J S, Shumway S E, et al. 1997. Site of particle selection in a bivalve mollusc. Nature.390(6656): 131-132.
[10]Wong W H, Cheung S G. 1999. Feeding behaviour of the green mussel, Perna viridis, (L.): Responses to variation in seston quantity and quality. Journal of Experimental Marine Biology and Ecology.236(2): 191-207.
