ADAMTS1基因在口腔鳞状细胞癌中的表达及其临床意义
2019-08-06张丽慧郑建云李子夏秦泗佳张耀超
张丽慧,郑建云,李子夏,梁 斌,秦泗佳,张耀超
(1陕西省西安医学院口腔医学系口腔组织病理教研室,西安 710075;2陕西省西安医学院第一附属医院病理科;*通讯作者,E-mail:zhanglihui222@163.com)
口腔癌是头颈部较常见的恶性肿瘤,大约占恶性肿瘤的7%,每年呈递增趋势增加,已经成为公共卫生领域的重大问题。口腔癌中约90%为鳞状细胞癌,而口腔鳞状细胞癌的总体生存率却在50%左右[1,2],所以对口腔鳞状细胞癌的早期诊断就显得尤为重要。含凝血酶敏感素基序的去整合素金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS)广泛存在于哺乳动物和无脊椎动物中,属于Zn2+依赖的金属蛋白酶家族,该家族中已有19个成员被发现,都是蛋白水解酶,并且蛋白水解功能可能与肿瘤的发生、发展、转移有关[3]。肿瘤的血管生成对于肿瘤的生长、浸润和转移有重要意义,新生血管的形成被认为是肿瘤进展的1个标志。抑制血管的生成就能抑制肿瘤的发展,而ADAMTS1的其中一个重要功能就是抑制血管新生[4]。本研究拟检测ADAMTS1蛋白在口腔鳞状细胞癌中的表达情况,并结合病例资料,初步探讨ADAMTS1在口腔鳞状细胞癌发生发展中的作用,为辅助临床上口腔鳞状细胞癌的早期诊断提供实验依据。
1 材料和方法
1.1 材料
收集西安医学院第一附属医院2016-06~2018-06间收治的48例口腔鳞状细胞癌手术患者的标本及相应的癌旁正常组织标本,所有标本均经过HE染色病理证实。其中男性34例,女性14例,年龄<50岁的16例,≥50岁32例;发生在舌部的22例,颊部的14例,其他部位12例;肿瘤直径<4 cm的32例,≥4 cm的16例;高分化24例,中分化18例,低分化6例;淋巴结转移10例,无淋巴结转移38例。
1.2 方法
1.2.1 主要试剂 兔抗人ADAMTS1多克隆抗体(北京博奥森生物技术有限公司);免疫组化试剂盒(北京中杉金桥生物技术开发公司);EDTA修复液(北京博奥森生物技术有限公司);DAB显色液(北京中杉金桥生物技术开发公司)。
1.2.2 试验方法 免疫组织化学S-P方法检测口腔鳞状细胞癌组织中ADAMTS1蛋白表达
石蜡标本常规连续切片,常规二甲苯脱蜡、水化后,3%过氧化氢灭活内源性过氧化物酶,EDTA缓冲液高压热抗原修复。加一抗(兔抗人ADAMTS1多克隆抗体1 ∶400稀释),然后加生物素标记的羊抗兔IgG,4 ℃冰箱过夜后,加霉素康生物素蛋白-过氧化酶,DAB显色,苏木素复染,行常规脱水、透明、中性树胶封片。PBS代替一抗作阴性对照。采用已经证实ADAMTS1表达阳性的人胎盘组织切片为阳性对照。
免疫组化染色根据半定量评分系统判定[5],通过染色密度和阳性染色细胞数来对ADAMTS1染色结果进行综合评分。①染色密度评分:0分,无染色;1分,弱染色;2分,中染色;3分,强染色;②阳性染色细胞百分比评分:0分,0%;l分,<33%;2分,33.67%;3分,>67%;总分=①×②。总分≥2和<2被认定为高表达(+)和低表达(-)。染色结果由两个有经验的病理科医师以双盲法进行诊断,一张切片至少选择5个高倍镜视野进行观察。
1.3 统计学方法
采用SPSS 16.0统计学软件进行统计学分析。计数资料采用χ2检验进行比较。检验水准α=0.05。
2 结果
ADAMTS1蛋白表达主要定位于细胞浆,少量位于细胞核,阳性表达呈黄色或棕黄色颗粒(见图1),阴性表达为无或少表达(见图2)。在口腔48例鳞状细胞癌组织中,ADAMTS1的阳性表达率为45.8%(22/48),癌旁组织为83.3%(40/48),口腔鳞状细胞癌组织中ADAMTS1蛋白的阳性表达率显著低于癌旁组织,两组差异有统计学意义(P<0.01);ADAMTS1表达与口腔鳞状细胞癌患者的年龄、性别、发病部位、肿瘤大小、有无淋巴结转移、病理分化程度等无关(P>0.05,见表1)。

图1 ADAMTS1在口腔鳞状细胞癌癌旁组织中的阳性表达Figure 1 Expression of ADAMTS1 in paracarcinoma tissues in oral squamous cell carcinoma (IHC,×400)
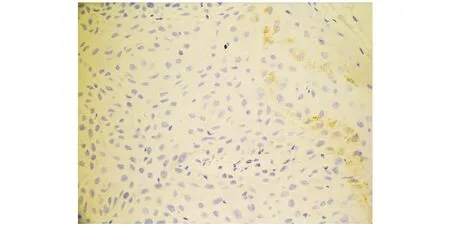
图2 ADAMTS1在口腔鳞状细胞癌组织中的阴性表达Figure 2 Negative expression of ADAMTS-1 in oral squamous cell carcinoma (IHC,×400)
3 讨论
口腔鳞状细胞癌是口腔癌中较为常见的恶性肿瘤,其总体生存率在50%左右,所以对口腔鳞状细胞癌的早期诊断和治疗就显得尤为重要。
ADAMTS1是在对小鼠结肠腺癌基因进行差异显示的筛选中发现的[6]。ADAMTS1定位于人染色体21q21-q22,编码含951个氨基酸的蛋白质,分子量约为100 kD。ADAMTS1可通过C-末端结合到血管内皮生长因子VEGF165的肝素结合区,从而阻断了VEGF受体VEGFR2的磷酸化,进而抑制内皮增殖和血管生成。它还可以特异性地抑制上皮细胞增生,阻滞成纤维细胞生长因子-2(FGF-2)诱导的血管生成,具有抗血管生成作用[4],这在抑制肿瘤的血管形成中会发挥作用。正常情况下,ADAMTS1在许多组织中都高表达,如心脏、肺、肝脏、骨骼肌和肾等中。
表1 ADAMTS1表达与口腔鳞状细胞癌临床病理特征的关系(例)
Table 1 Relationships between expression of ADAMTS1 and clinicopathological features of oral squamous cell carcinoma(cases)
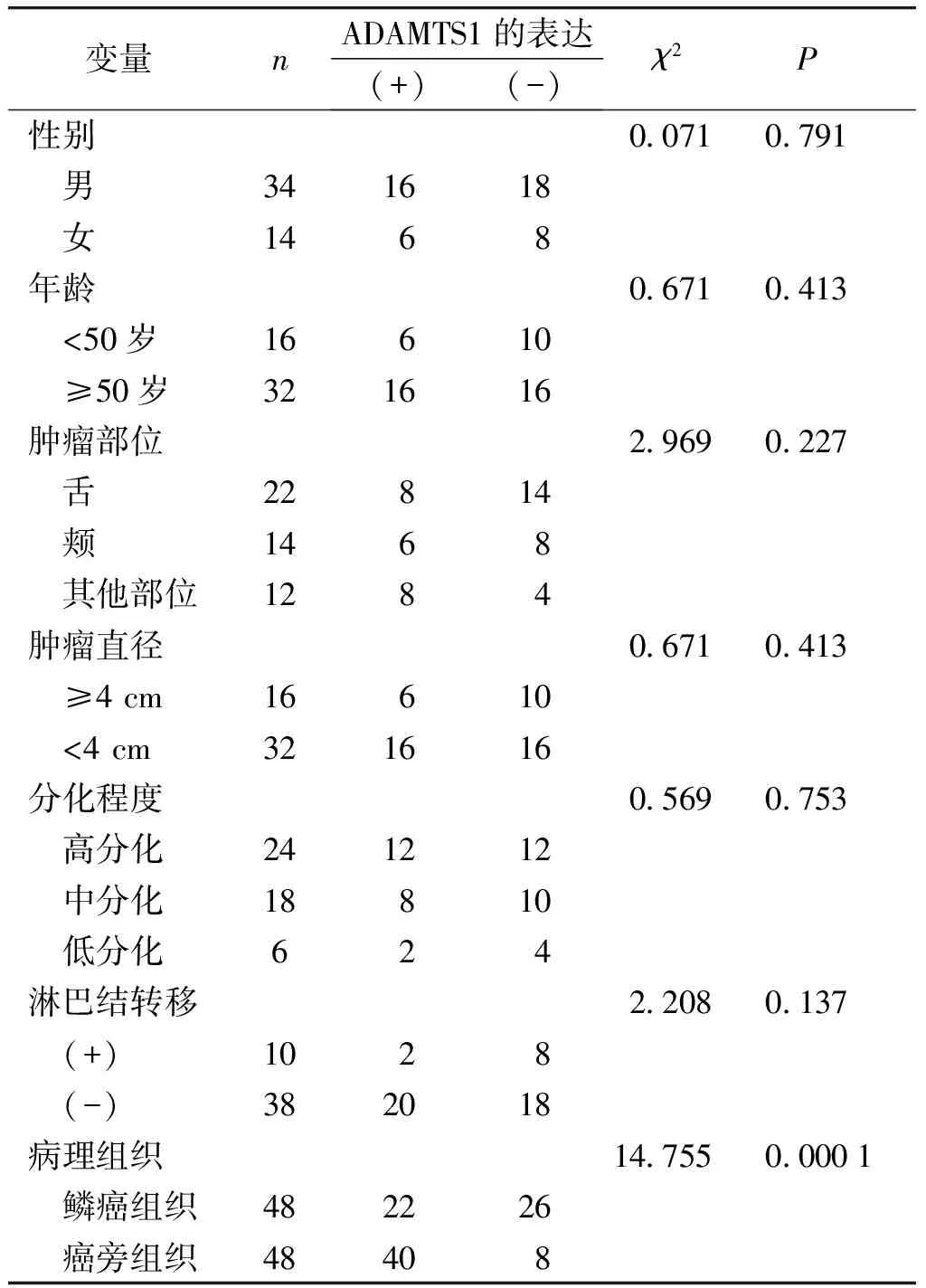
变量nADAMTS1的表达(+)(-)χ2P性别0.0710.791 男341618 女1468年龄0.6710.413 <50岁16610 ≥50岁321616肿瘤部位2.9690.227 舌22814 颊1468 其他部位1284肿瘤直径0.6710.413 ≥4 cm16610 <4 cm321616分化程度0.5690.753 高分化241212 中分化18810 低分化624淋巴结转移2.2080.137 (+)1028 (-)382018病理组织14.7550.0001 鳞癌组织482226 癌旁组织48408
有研究表明,ADAMTS1在胃癌中的表达水平低于其癌旁组织[7],食管鳞状细胞癌组织中ADAMTS1 mRNA的表达显著低于相应的癌旁组织[8];采用RT-PCR对10株非小细胞肺癌和98例非小细胞肺癌标本进行ADAMTS1 mRNA的检测,结果发现30%的细胞系表达降低[9]。在乳腺癌[10-12]组织、前列腺癌[13]、结肠癌[14]、皮肤鳞状细胞癌[15]组织中ADAMTS1的表达也均下调。
本实验采用免疫组化对48例口腔鳞状细胞癌及相应的癌旁正常组织中ADAMTS1蛋白的表达情况进行检测,发现ADAMTS1蛋白在口腔鳞状细胞癌中的表达显著下调,提示ADAMTS1可能是一种肿瘤生长抑制因子。
在有淋巴结转移的胃癌患者中ADAMTS1的阳性表达率明显高于无淋巴结转移者[7]。食管鳞状细胞癌中有淋巴结转移组的ADAMTS1 mRNA表达水平显著高于无淋巴结转移组[8]。也有学者发现结直肠癌中,有淋巴结转移的ADAMTS1阳性表达率低于无淋巴结转移者[16]。在本实验中,有淋巴结转移的口腔鳞状细胞癌患者,ADAMTS1阳性表达率与无淋巴结转移的患者相比较,两者无统计学意义。ADAMTSl在有淋巴结转移的不同肿瘤中表达不同,其差异可能与该基因在肿瘤中不同的作用机制以及肿瘤所处的肿瘤微环境有关。
Kilic等[17]研究表明ADAMTS1在胃癌的表达与肿瘤的分级、大小相关。而在本组实验中ADAMTS1的表达与口腔鳞状细胞癌患者的不同年龄、不同性别、不同发病部位、不同肿瘤大小及不同病理分化程度均无关,差异无统计学意义(P>0.05)。提示ADAMTS1对肿瘤作用的复杂性,在不同来源的肿瘤发生中有不同的作用,且存在组织特异性。
陈静等[6]研究发现胃癌组织中ADAMTS1基因启动子甲基化可能是胃癌组织及细胞中ADAMTSl基因表达沉默的一个机制之一。在结肠直肠癌组织中也存在ADAMTS1基因CpG岛的甲基化,而在正常或良性结肠直肠癌组织中却未发现其DNA甲基化[18]。Tyan等[19]研究发现乳腺肿瘤可以诱导间质成纤维细胞持续分泌ADAMTS1对机体进行侵袭,这可能也是其机制的一部分。
ADAMTS1可以抑制血管形成,在肿瘤生长、浸润、转移中发挥作用。本实验中ADAMTS1蛋白的阳性表达率显著性低于癌旁组织,提示ADAMTS1是一个肿瘤生长抑制因子,可能与肿瘤的发生发展有关,但由于它的复杂性,机制也不是很清楚,关于ADAMTS1蛋白在口腔鳞状细胞癌中对肿瘤进展影响的确切机制还有待进一步探索。
