SORL1基因多态性与新疆哈萨克族及汉族阿尔茨海默病的相关性
2019-08-06张玉洁孟新玲许奔奔
张玉洁,张 燕,孟新玲,刘 婷,陆 洁,许奔奔,徐 梦
(新疆医科大学附属中医医院脑病一科,乌鲁木齐 830000;*通讯作者,E-mail:269667188@qq.com)
阿尔茨海默病(AD)是老年人中最常见的神经退行性疾病[1]。根据世界卫生组织2016年痴呆症报告,全球29个国家每年有4 750万人患有痴呆症和770万例新病例[2],据估计,2030年痴呆症人数预计将达到7 560万人,到2050年将达到3倍,达到1.355亿人[3];其发病机制复杂,遗传因素的研究意义逐渐受到重视。近年全基因组关联研究(genome wide association studies,GWAS)及荟萃分析发现分拣蛋白相关受体1(SORL1)基因的多态性与AD风险相关[4,5],研究表明神经元在SORL1上具有风险或保护性变异,保护性变异神经元增加SORL1的表达,这可能降低散发性阿尔茨海默病的风险[6]。目前尚未见新疆哈萨克族AD患者SORL1基因相关研究,因此本研究采用病例对照方法探讨SORL1基因rs2070045位点及rs3824968位点多态性与新疆地区哈萨克族、汉族人群SAD患者的相关性,为AD的基因遗传学研究提供的一定基础数据。
1 研究对象与方法
1.1 研究对象
收集来自新疆各地2016-01~2018-02在新疆医科大学附属中医医院神经退行性疾病临床大数据库的AD患者共118例,均为散发性;其中哈萨克族58例,汉族60例,男性75例,女性43例,年龄在49-91岁之间,平均(74.6±7.85)岁。选择与病例组年龄、性别、地域环境因素、生活方式和民族习俗相匹配的,并无血缘关系的非AD患者或健康志愿者作为对照组,共139例,其中哈萨克族79例,汉族60例;男性75例,女性64例;年龄58-81岁,平均(72.7±6.21)岁。
本研究为病例对照研究,所有研究对象均签署知情同意书,通过新疆医科大学附属中医医院伦理委员会批准。
1.2 研究方法
1.2.1 DNA提取 空腹抽取受试者肘静脉血5 ml,EDTA抗凝,置于-80 ℃冻存,分批进行DNA的提取。
1.2.2 竞争性等位基因特异性PCR(KASP)技术及DNA测序检测SORL1基因位点多态性 研究中的SNP基因座信息来自公共数据库NCBI GeneBank数据库,查询基因SORL1标准序列(源自网络http//www.ncbi.nlm.nih.gov/gene bank/genebank)。其位点序列号为rs2070045及rs3824968。采用Primer Premier 3.0软件设计SNP rs2070045及rs3824968位点的KASP引物http://Primer3.ut.ee/),见表1。用Qiagen公司的HotStar Taq PCR试剂盒进行多重PCR,获得PCR产物经虾碱酶(SAP)(购于Promega)和外切酶Ⅰ(EXOⅠ)(购于Epicentre)纯化后用ABI公司的SNaPshot Multiplex kit进行延伸反应。延伸产物用虾碱酶(SAP)(购于Promega)纯化后在ABI3730xl上样。SNP分型采用GeneMapper4.1(Applied biosystems)进行序列比对分析。
1.3 统计学分析
采用χ2检验进行Hardy-Weinberg平衡定律吻合度检验,采用基因计数法描述SAD及对照组基因频率和基因型分布;其计数资料以例数和率(%)表示,SAD及对照组之间比较采用χ2检验和Firsher精确概率法;数据使用SPSS22.0进行处理。所有统计学检验均为双侧概率检验,检验水准以P<0.05为差异有统计学意义。
表1 SNP位点引物名称和PCR引物序列
Table 1 SNP site primer names and PCR primer sequences
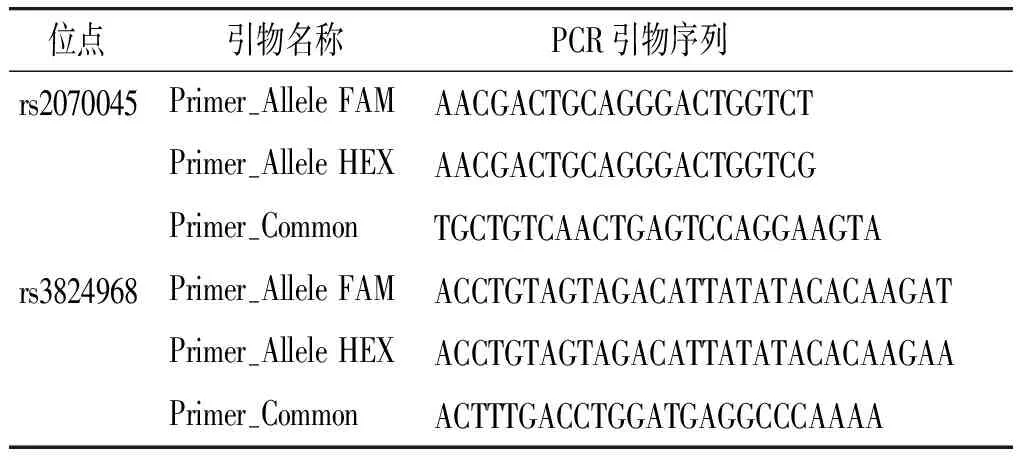
位点 引物名称 PCR引物序列rs2070045Primer-Allele FAMAACGACTGCAGGGACTGGTCTPrimer-Allele HEXAACGACTGCAGGGACTGGTCGPrimer-CommonTGCTGTCAACTGAGTCCAGGAAGTArs3824968Primer-Allele FAMACCTGTAGTAGACATTATATACACAAGATPrimer-Allele HEXACCTGTAGTAGACATTATATACACAAGAAPrimer-CommonACTTTGACCTGGATGAGGCCCAAAA
2 结果
2.1 Hardy-Weinberg平衡定律吻合度检验
汉族及哈萨克族病例组与及对照组SORL1基因rs2070045、rs3824968位点基因型分布均符合Hardy-Weinberg遗传平衡定律(P>0.05)。rs2070045位点哈萨克族AD组(P=0.114)、哈萨克族对照组(P=0.051)、汉族AD组(P=0.117)、汉族对照组(P=0.262)基因型分布均吻合度良好;rs3824968位点哈萨克族AD组(P=0.071)、哈萨克族对照组(P=0.070)、汉族AD组(P=0.137)、汉族对照组rs3824968(P=0.233)基因型分布均吻合度良好。
2.2 基因多态位点检测结果和电泳图、测序图、KASP分型图结果
AD患者电泳结果见图1。AD患者SORL1基因rs2070045、rs3824968位点测序峰图分析见图2。PCR反应程序结束后将样本置于ABI Q6中检测FAM及HEX荧光信号,收集荧光信号,仪器根据每个样本检测的荧光信号值自动分型,Homozygous为纯合子,Heterozygous为杂合子,KASP分型见图3。
2.3 病例组和对照组SORL1基因rs2070045、rs3824968位点基因型及等位基因频率比较
病例组与对照组SORL1基因rs2070045(χ2=0.671,P=0.715)、rs3824968(χ2=0.431,P=0.806)多态位点的基因型分布比较,差异均无统计学意义(见表2)。
两个基因多态性位点的等位基因频率rs2070045(χ2=0.791,P=0.374)和rs3824968(χ2=0.471,P=0.518)与阿尔茨海默病的相关性分析均没有发现差异有统计学意义(见表3)。
A. rs2070045位点B. rs3824968位点图1 AD患者rs2070045和rs3824968位点电泳图Figure 1 Electrophoresis map of rs2070045 locus and rs3824968 locus in AD patients
A. rs2070045位点测序结果B. rs3824968位点测序结果图2 AD患者rs2070045和rs3824968位点测序结果Figure 2 Sequencing results of rs2070045 locus and rs3824968 locus in AD patients
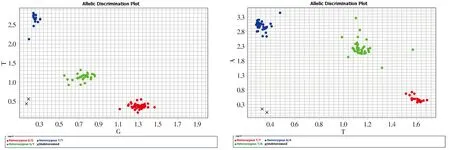
A. rs2070045 KASP分型 B. rs3824968 KASP分型图3 rs2070045和rs3824968 KASP分型图Figure 3 KASP typing of rs2070045 and rs3824968
表2 rs2070045及rs3824968在阿尔茨海默病组和对照组的基因型分布比较例(%)
Table 2 Comparison of genotype distribution of rs2070045 and rs3824968 between Alzheimer’s disease group and control groupcases(%)

组别rs2070045GGGTTTχ2Prs3824968AAATTTχ2PAD组57(48.3)42(35.6)19(16.1)0.6710.71549(41.5)44(37.3)25(21.2)0.4310.806对照组60(43.5)52(37.7)26(18.8)61(43.9)53(38.1)25(18.0)
*因汉族对照组一人rs2070045基因型未测出,因此少1例
表3 rs2070045及rs3824968在阿尔茨海默病组和对照组的等位基因频率比较例(%)
Table 3 Comparison of allele frequencies of rs2070045 and rs3824968 between Alzheimer’s disease group and control groupcases(%)

组别rs2070045GTχ2Prs3824968ATχ2P AD组156(66.1)80(33.9)0.7910.374142(60.2)94(39.8)0.4710.518 对照组172(62.3)104(37.7)175(62.9)103(37.1)
*因汉族对照组一人rs2070045等位基因未测出,因此少1例
2.4 按族别分层分析两个SNPs与阿尔茨海默病的相关性
我们进一步对阿尔茨海默病组rs2070045、rs3824968位点的基因型分布进行了族别分层分析。结果显示,阿尔茨海默病组的2个位点基因型分布在两个民族中及两民族之间差异均无统计学意义(P>0.05,见表4);rs2070045、rs3824968的等位基因在两个民族及两民族之间差异均无统计学意义(P>0.05,见表5)。
表4 阿尔茨海默病组rs2070045及rs3824968基因型分布在族别上的差异例(%)
Table 4 Differences in genotype distribution of rs2070045 and rs3824968 in Alzheimer’s disease groupcases(%)
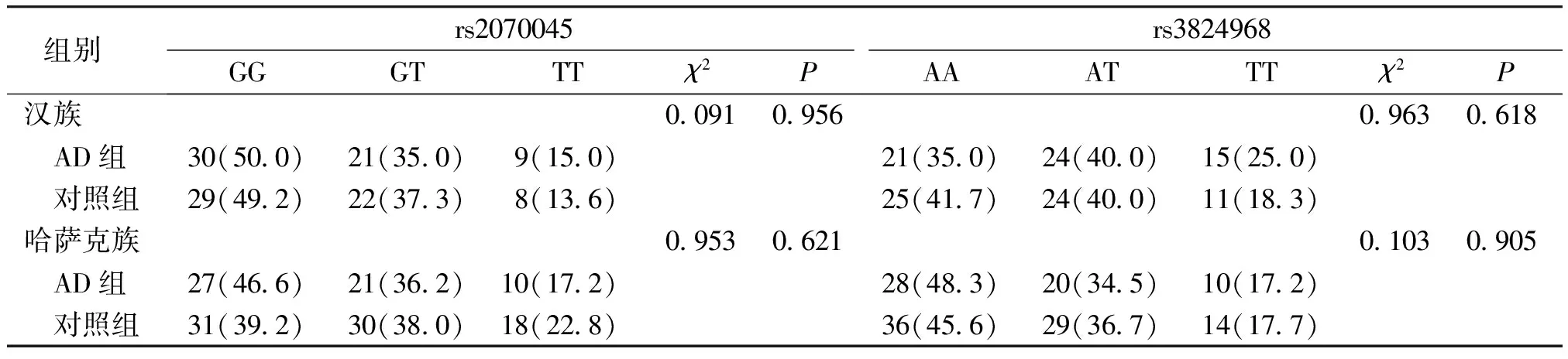
组别 rs2070045GGGTTTχ2Prs3824968AAATTTχ2P汉族0.0910.9560.9630.618 AD组30(50.0)21(35.0)9(15.0)21(35.0)24(40.0)15(25.0) 对照组29(49.2)22(37.3)8(13.6)25(41.7)24(40.0)11(18.3)哈萨克族0.9530.6210.1030.905 AD组27(46.6)21(36.2)10(17.2)28(48.3)20(34.5)10(17.2) 对照组31(39.2)30(38.0)18(22.8)36(45.6)29(36.7)14(17.7)
*哈萨克族与汉族AD间rs2070045位点基因型频率分布比较,χ2=0.177,P=0.915>0.05;不同民族AD患者rs3824968位点基因型频率分布比较,χ2=2.330,P=0.312>0.05;因汉族对照组一人rs2070045基因型未测出,因此少1例
表5 阿尔茨海默病组rs2070045及rs3824968等位基因频率在族别上的差异例(%)
Table 5 Differences in the frequency of rs2070045 and rs3824968 allele frequencies in the Alzheimer’s disease groupcases(%)
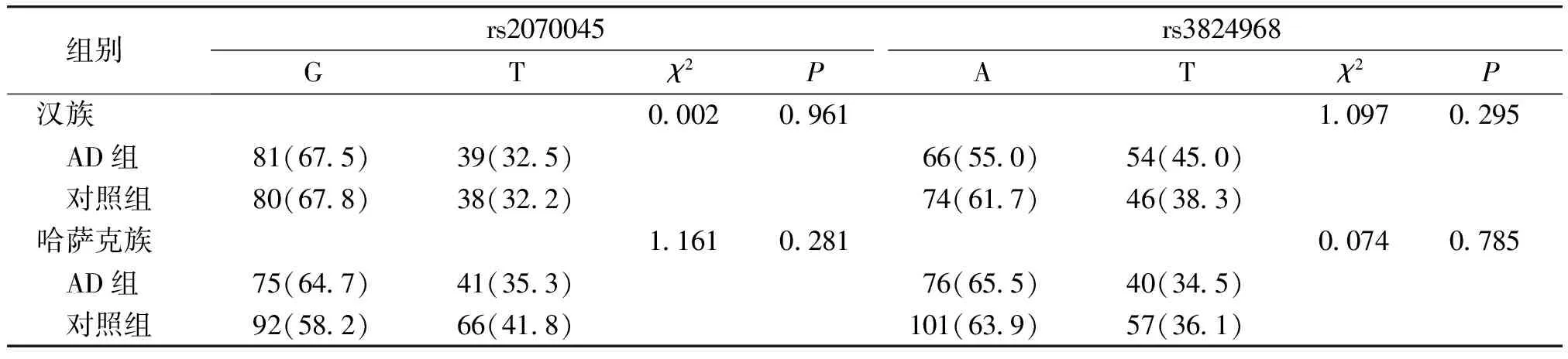
组别 rs2070045GTχ2Prs3824968ATχ2P汉族0.0020.9611.0970.295 AD组81(67.5)39(32.5)66(55.0)54(45.0) 对照组80(67.8)38(32.2)74(61.7)46(38.3)哈萨克族1.1610.2810.0740.785 AD组75(64.7)41(35.3)76(65.5)40(34.5) 对照组92(58.2)66(41.8)101(63.9)57(36.1)
*哈萨克族与汉族AD组rs2070045位点等位基因频率比较,χ2=0.213,P=0.644>0.05;不同民族AD患者rs3824968位点等位基因频率分布比较,χ2=2.722,P=0.099>0.05;因汉族对照组一人rs2070045等位基因未测出,因此少1例
3 讨论
SORL1基因位于11号染色体上,编码蛋白质,其具有许多不同功能的功能域,包括物质运输、分子伴侣活性、信号传导和细胞内分选。SORL1充当淀粉样前体蛋白(amyloid precursor protein,APP)的分选受体,其将来自内体的分子再循环回到反式高尔基体网络以减少Aβ产生,这是AD的病理生理学途径中的重要组分[7,8]。Raghavan等[9]发现,在没有SORL1基因的情况下,APP被释放到晚期内体中,在内体中它被β-蛋白酶和γ-蛋白酶切割产生淀粉样蛋白β。SORL1突变导致阿尔茨海默氏病的神经变性的机制与破坏其绑定APP的能力有关。细胞生物学实验表明[10],SORL1过度表达导致Aβ过量产生,而SORL1过表达显著降低细胞APP和细胞外Aβ。
我们首次分析了新疆哈萨克族人群SORL1基因rs2070045位点及rs3824968位点与AD的相关性。本研究结果未发现新疆汉族及哈萨克族SORL1基因rs2070045位点及rs3824968位点与AD有关联性;经族别分层后亦未发现这两位点在新疆汉族与哈萨克族有显著差异。Liu等[11]研究表明rs2070045以及它们的标记遗传变异导致欧洲人群的晚发性阿尔茨海默病(late-onset AD,LOAD)风险增加,Shen等[12]研究证实rs2070045与AD风险增加相关(OR=1.13,P=0.009),然而,亚组分析显示,rs2070045与AD易感性之间的关联在亚洲人和高加索人之间显著不同。Louwersheimer等[13]研究表明LOAD相关的SORL1 SNP在种族群体中是不同的,rs2070045-G等位基因通常与LOAD风险增加相关,且与脑脊液(cerebro-spinal fluid,CSF)中更高的tau水平和更多的海马萎缩之间显著关联。然而最近两个针对AD患者的CSF tau和p tau水平的GWAS中[14,15],未检测到与SORL1的关联。一项荟萃分析表明[16],rs2070045及rs3824968与AD风险增加显著相关,rs2070045-G等位基因显示AD风险增加(OR=1.08,P=0.02);当合并亚洲数据,rs2070045-G等位基因携带者的AD风险增加(OR=1.27,P=0.001)。亦有不同研究报道T等位基因是一种危险因素[17]。Alexopoulos等[18]研究表明rs3824968与CSF中较低的Aβ水平显著相关。其A等位基因可影响人脑区域(如小脑、颞叶皮质组织和壳核)的SORL1表达[11],Huang等[19]发现携带SORL1 rs3824968等位基因A与右后扣带、左中枕、内侧额叶和上颞回中表现出较小的灰质体积有关,SORL1之间的相互作用提高了等位基因A对壳核的有害和加速的老化效应。亦有学者研究认为T等位基因与严重海马萎缩相关(P<0.05)[13]。在中国人群中的两项研究[20,21]也报道了SORL1 rs3824968 A等位基因与AD风险增加有关,然而Shen等[12]研究表明没有足够的证据表明,rs3824968与AD之间存在显著相关性,亚组分析表明亚洲人的rs3824968与AD风险增加有关。
综上所述,SORL1 rs2070045、rs3824968与AD之间的关联在不同人群中并不一致,在不同种族的研究结果亦不一致。关于SORL1研究中,不同结果的可能潜在原因是AD病因非常复杂,多个不同的致病变异发生在SORL1的多个结构域(等位基因异质性),或者SORL1中遗传变异对AD风险的影响不足以在现有的数据中检测到,但是SORL1变体在APP代谢中的作用可能影响AD病理改变。此外,AD中SORL1变体之间关联性分析显示rs2070045和rs382496位点在亚洲数据集[20,22]中与AD风险相关,不幸的是,我们没有进行rs2070045、rs3824968位点单体型分析与AD危险度关联分析,因此无法验证SNP rs2070045及rs3824968与AD无关。我们怀疑SORL1 rs2070045及rs3824968可能与AD风险增加相关,并且基因连锁不平衡中存在关联趋势,换句话说,SORL1的SNP之间可能存在相互作用。此外,我们应该考虑地域因素是导致不同结果的可能原因,其他研究人群主要是关于南方的中国人口,但我们的研究是关于中国西北的。由于我们研究样本量相对较少,可能尚不能充分体现新疆哈萨克族及汉族人群整体基因分布情况,对于我们的结果有所限制。在人群筛选方面,目前AD诊断仍以症状为主,诊断标准以各类心理学检测评分作参考,难免存在评分上的主观性造成误差;或者新疆汉族及哈萨克族人群AD可能与SORL1基因rs2070045位点及rs3824968位点多态性确实无关联。
总的来说,这是新疆首次在汉族和哈萨克族人中进行的SORL1基因研究,我们研究显示SORL1基因rs2070045及rs3824968位点可能与新疆哈萨克族及汉族AD均无明显相关。SORL1基因变异与AD易感性之间的关联因不同种族人群而异,各民族研究结果并不一致,目前仍需提供大样本研究进一步验证,为AD早期诊断提供一定的依据。
