Neuropilin-1对人舌鳞状细胞癌TCa8113增殖、迁移能力、细胞凋亡及对化疗药物敏感性的影响
2019-08-06沈耀川余巧龙
沈耀川,郑 歆,余巧龙,陈 昕
(中国人民解放军第一七四医院口腔科,厦门 361000;*通讯作者,E-mail:dentistchenxin@163.com)
舌鳞状细胞癌是头颈部最常见的恶性肿瘤之一,也是最常见的口腔癌,约占口腔癌的1/3-1/2[1,2]。近年来舌癌的发病率越来越高,人们对其关注度也随之增加。舌癌对患者生存率及面容、口腔颌面部功能等影响均较大。目前以手术、化疗和放疗等为主的传统治疗方法未能取得令人满意的疗效[3-5]。舌癌组织中的血管密度可能影响其生长速度及预后。NRP-1最早是作为神经细胞导向调节因子受体被发现,是一类在脊椎动物中高度保守的分子量为130-140 kDa的糖蛋白[6-8]。近年来大量研究结果显示,人类的许多肿瘤组织上都有NRP-1的表达,包括前列腺癌、乳腺癌、黑色素瘤和胰腺癌,而在相应的正常组织中几乎不表达[9-11]。NRP-1作为血管生长因子的共受体,在肿瘤血管新生方面发挥着重要的调节作用。NRP-1在对各种肿瘤细胞的发生发展有重要作用。目前,已有相关文献报道,舌癌组织中有NRP-1的高表达[12,13],但尚没有NRP-1对舌鳞状细胞癌细胞的生物学特性影响的相关基础研究。本研究旨在初步探讨NRP-1在舌鳞状细胞癌TCa8113细胞的表达及其对TCa8113细胞增殖迁移等生物学特性的影响。
1 材料与方法
1.1 主要试剂与仪器
DMEM培养液(Gibco);LB培养基(Solarbio);阿霉素(北京中硕科技有限公司);胎牛血清FBS(Gibco);Lipofectamine 2000(Thermo Fisher Scientific);全自动细胞计数仪(Countstar-全自动细胞计数仪);Transwell细胞培养小室(Corning);高速离心机(Thermo Fisher Scientific);生物显微镜(EVOS);NRP-1抗体(2 mg/ml,GeneTex)。
1.2 细胞系与细胞培养
TCa8113细胞野生型细胞(WT-TCa8113)和NRP-1敲低TCa8113细胞(NRP-1KD-TCa8113)购自上海丰晖生物科技有限公司。用含10% FBS和1%青链霉素的高糖DMEM培养液,于37 ℃,5% CO2的培养箱中培养。
1.3 NRP-1单克隆抗体与NRP-1结合能力的鉴定
首先,利用Western blot检测WT-TCa8113和NRP-1KD-TCa8113两株细胞中NRP-1的表达情况。接着使用共聚焦显微镜检测NRP-1抗体与T-TCa8113和NRP-1KD-TCa8113两株细胞的结合能力。取对数生长期的WT-TCa8113细胞和NRP-1KD-TCa8113细胞,蛋白酶消化后,PBS稀释成单细胞悬液并加入到含有细胞爬片的6孔板中,制备细胞爬片。待细胞爬片制备完成后,加入荧光素BRITC标记的NRP-1抗体与细胞共同孵育30 min。孵育后,除去培养液,PBS轻轻洗涤3次以除去游离和非特异性结合的抗体。共聚焦荧光显微镜下观察NRP-1单克隆抗体在WT-TCa8113和NRP-1KD-TCa8113两株细胞中的结合情况。
1.4 实验设计及分组
实验设计共设置2个时间点,每个时间点分三组。PBS组(阴性对照组)采用WT-TCa8113细胞系,加100 μl PBS处理;NRP-1 antibody组采用WT-TCa8113细胞系,加100 μl NRP-1单克隆抗体处理;NRP-1 knockdown组采用NRP-1KD-TCa8113细胞系,加100 μl PBS处理。即本研究通过构建NRP-1敲低TCa8113细胞系和使用NRP-1单克隆抗体两种方法抑制TCa8113细胞的NRP-1功能,再通过比较两种方法抑制NRP-1功能后,对WT-TCa8113和NRP-1KD-TCa8113细胞12 h和24 h两个时间点的增殖、迁移、凋亡及对化疗药物敏感性的影响。
1.5 细胞计数仪检测抑制NRP-1功能对细胞增殖的影响
取对数增长期的WT-TCa8113和NRP-1KD-TCa8113细胞分别稀释成2×105/ml。按1.4的分组将两株组细胞分成6组并接种到12孔板,每组设3个复孔。分别在培养后12 h和24 h两个时间点使用细胞计数仪测细胞数量,每次测量前均使用胰蛋白酶进行消化并用枪头吹打混匀。
1.6 Transwell检测抑制NRP-1功能对细胞迁移能力的影响
按1.4的分组将WT-TCa8113和NRP-1KD-TCa8113两株组细胞细胞稀释成2×105/ml,并分成6组,分别取100 μl加入transwell上腔,下腔放入600 μl含有0.5% BSA的DMEM培养液。于37 ℃,5% CO2条件下培养,分别在培养后12 h和24 h两个时间点收集下腔的细胞做细胞计数。
1.7 流式细胞仪检测抑制NRP-1功能对细胞凋亡的影响
取对数生长期的WT-TCa8113和NRP-1KD-TCa8113细胞稀释成10×104/ml,转移至6孔板中培养。按1.4的分组将上述两株组细胞分成6组并做相应处理,于37 ℃、5% CO2条件培养。分别在培养后12 h和24 h两个时间点收集细胞并用500 μl binding buffer重悬细胞后,加入5 μl Annexin Ⅴ-FITC和5 μl PI染色液,混匀后室温孵育15 min。孵育完毕收集细胞用预冷500 μl PBS重悬后流式细胞仪检测,计算总细胞量和凋亡细胞量。
1.8 细胞计数仪检测抑制NRP-1功能对细胞化疗药物敏感性的影响
取对数生长期的WT-TCa8113和NRP-1KD-TCa8113细胞按1.4的分组将两株组细胞分成6组并做相应处理。用含有不同浓度的表阿霉素(EPI)的培养基稀释成2×105/ml,每组细胞的EPI终浓度分别为0.001,0.01,0.1,0.2,0.5,1 μg/ml。于37 ℃、5% CO2条件下培养。分别在培养后12 h和24 h两个时间点使用细胞计数仪计算凋亡细胞和总细胞数。分别计算各组细胞在不同浓度EPI处理下的细胞凋亡率。
1.9 统计学分析
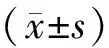
2 结果
2.1 NRP-1敲低细胞株及NRP-1抗体结合能力的鉴定
Western blot结果显示,野生型细胞WT-TCa8113组在130 kDa附近出现一明显特异性条带,与NRP-1理论分子量复合。而NRP-1敲低组NRP-1KD-TCa8113组的NRP-1蛋白表达量较野生型细胞明显降低。结果表明,成功构建NRP-1敲低的TCa8113细胞株,且敲低效率较明显(见图1)。
共聚焦显微镜观察结果显示,在WT-TCa8113组中,可见明显红色荧光在细胞表面集聚,而NRP-1KD-TCa8113组则没有(见图2)。结果表明,NRP-1抗体可在活体细胞中与TCa8113细胞膜上的NRP-1结合。

图1 Western blot检测WT-TCa8113和NRP-1KD-TCa8113细胞株NRP-1蛋白表达量Figure 1 Western blot analysis of NRP-1 expression in WT-TCa8113 and NRP-1KD-TCa8113 cell lines
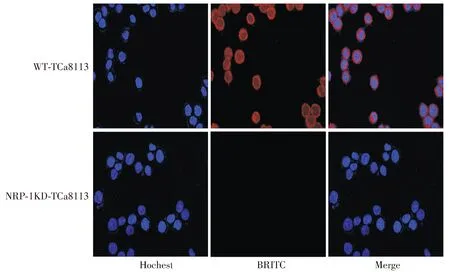
图2 共聚焦显微镜分析NRP-1抗体与TCa8113细胞膜表面的NRP-1的结合能力Figure 2 Confocal microscopy analysis of the binding ability of NRP-1 antibody to TCa8113 cells
2.2 细胞计数仪检测抑制NRP-1功能对细胞增殖的影响
以PBS组作为阴性对照,分别比较NRP-1 antibody组和NRP-1 knockdown组培养12 h和24 h后的细胞数,评估两者抑制NRP-1功能后对TCa8113细胞增殖的影响,结果见表1。在0 h时,三组细胞数无统计学差异(P=0.716),均约为2×105/ml。而培养12 h后,NRP-1 antibody组和NRP-1 knockdown组的细胞数开始较PBS组少,差异有统计学意义(P<0.05)。培养24 h后,NRP-1 antibody组和NRP-1 knockdown组的细胞数与PBS组比较,差异有统计学意义(P<0.01)。结果表明,NRP-1 antibody组和NRP-1 knockdown组抑制NRP-1功能后,能够抑制TCa8113细胞增殖,因此可推测,NRP-1具有促进TCa8113细胞增殖的作用。
此外,NRP-1 antibody组和NRP-1 knockdown组对比,在12 h和24 h两个时间点,NRP-1 knockdown组的细胞数均小于NRP-1 antibody组,差异有统计学意义(P<0.05)。提示通过shRNA方法构建NRP-1低表达细胞株对NRP-1功能抑制可能更彻底,故对细胞抑制作用更明显。
表1 抑制NRP-1功能对细胞增殖的影响(×105/ml)
Table 1 Effect of NRP-1 function inhibition on cell proliferation(×105/ml)

分组0 h12 h24 hPBS组2.03±0.183.79±0.355.93±0.44NRP-1 antibody组2.14±0.222.96±0.48∗3.71±0.57∗∗NRP-1 knockdown组2.18±0.272.41±0.22∗#2.66±0.29∗∗#
与PBS组比较,*P<0.05,**P<0.01;与NRP-1 antibody组比较,#P<0.05
2.3 Transwell检测抑制NRP-1功能对细胞迁移能力的影响
用Transwell检测NRP-1 antibody组和NRP-1 knockdown组细胞的迁移能力,结果见图3。NRP-1antibody组和NRP-1 knockdown组的细胞迁移能力在12 h和24 h两个时间点下室细胞量与相应时间段的PBS阴性对照组有显著差异。12 h时,PBS组,NRP-1 antibody组和NRP-1 knockdown组下室细胞量分别为428±56,235±43和197±27个。方差分析三组间均数具有统计学意义(P<0.001)。其中NRP-1 antibody组和NRP-1 knockdown组细胞数比PBS组少,差异具有统计学意义(P<0.01)。
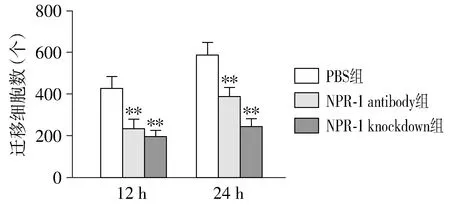
与PBS组比较,**P<0.01图3 NRP-1抗体和NRP-1敲低对细胞迁移的影响 (n=3)Figure 3 Effect of NRP-1 antibody and NRP-1 knockdown on cell migration (n=3)
在24 h时,PBS组、NRP-1 antibody组和NRP-1 knockdown组下室细胞量分别为587±61,398±42和244±37个。方差分析三组间差异具有统计学意义(P<0.001)。其中PBS组细胞数比NRP-1 antibody组和NRP-1 knockdown组多,差异具有统计学意义(P<0.01)。结果表明,用NRP-1 antibody和NRP-1 shRNA抑制NRP-1功能后,能够抑制TCa8113细胞迁移能力。
此外,NRP-1 antibody组和NRP-1 knockdown组对比,在12 h和24 h两个时间点的细胞数均无显著差异(P>0.05)。
2.4 流式细胞仪检测抑制NRP-1功能对细胞凋亡的影响
流式细胞仪检测NRP-1antibody组和NRP-1 knockdown组的细胞凋亡情况见图4。12 h时PBS组、NRP-1 antibody组和NRP-1 knockdown组细胞凋亡率分别为(8.2±1.5)%,(14.9±2.4)%和(24.2±5.8)%,方差分析三组间差异具有统计学意义(P<0.01)。其中NRP-1 antibody组和NRP-1 knockdown组比PBS组细胞凋亡率低,差异具有统计学意义(P<0.01)。
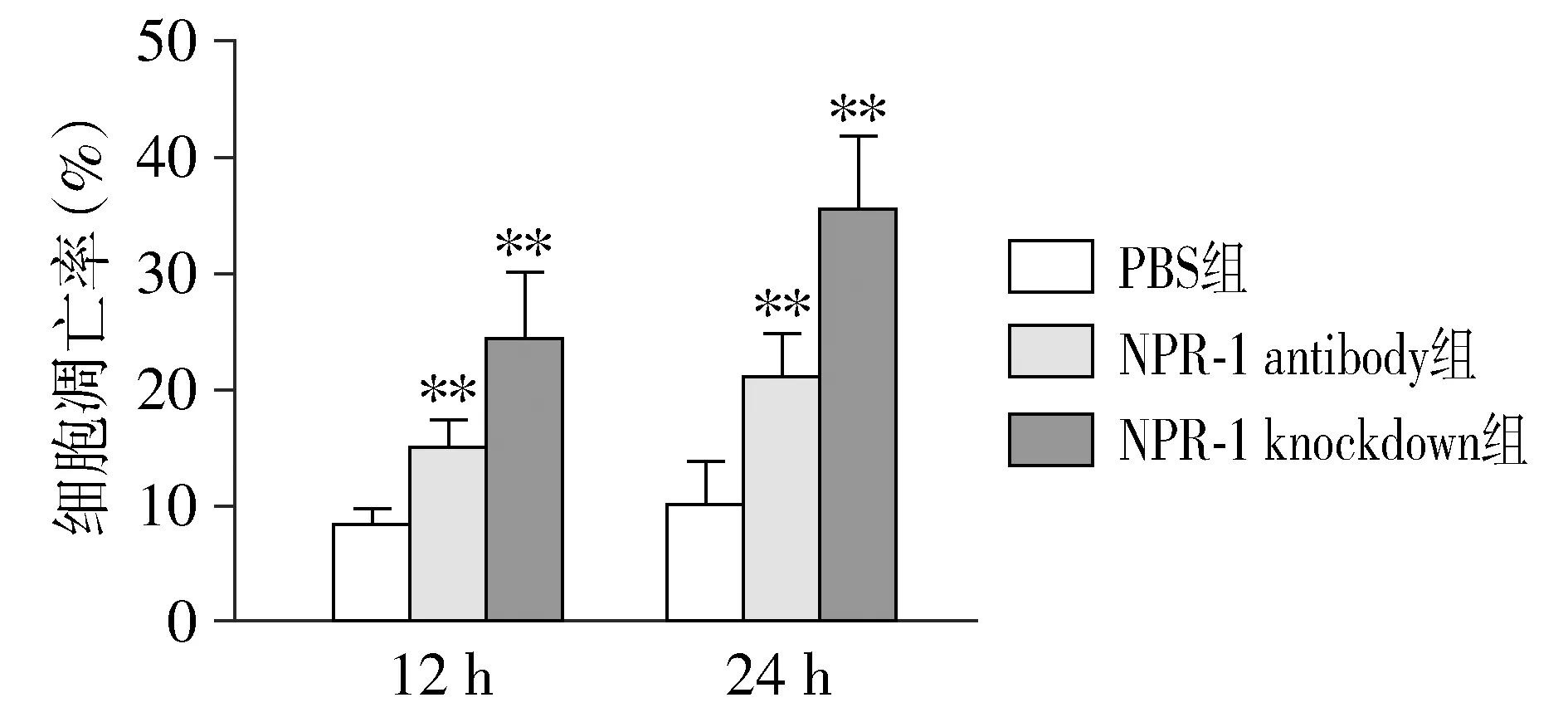
与PBS组比较,**P<0.01图4 NRP-1抗体和NRP-1敲低对细胞凋亡的影响 (n=3)Figure 4 Effect of NRP-1 antibody and NRP-1 knockdown on apoptosis (n=3)
24 h时PBS组、NRP-1 antibody组和NRP-1 knockdown组细胞凋亡率分别为(10.0±3.7)%,(20.9±3.8)%和(35.4±6.3)%,方差分析三组间差异具有统计学意义(P<0.01)。其中NRP-1 antibody组和NRP-1 knockdown组比PBS组细胞凋亡率低,差异具有统计学意义(P<0.01)。
此外,NRP-1antibody组和NRP-1 knockdown组12 h时凋亡率差异没有统计学意义(P=0.082);24 h时两组凋亡率差异没有统计学意义(P=0.086)。
2.5 抑制NRP-1功能对细胞耐药的影响
细胞对化疗药物的敏感性一定程度可以反映细胞的耐药程度,本实验通过各组细胞的半数凋亡率的化疗药物浓度来评估NRP-1对细胞耐药的影响,利用IC50Calculator计算软件计算各组的IC50,结果见图5。药物培养12 h,PBS组、NRP-1 antibody组和NRP-1 knockdown组的半数凋亡率的化疗药物浓度分别为(0.48±0.14)μg/ml,(0.19±0.06)μg/ml和(0.11±0.03)μg/ml,NRP-1抗体组和NRP-1 knockdown组与PBS组对比,P值分别为0.016和0.006,差异有统计学意义。NRP-1抗体组和NRP-1 knockdown组对比,两者半数凋亡浓度无统计学差异(P=0.107)。
药物培养24 h,PBS组、NRP-1抗体组和NRP-1 knockdown组的半数凋亡率的化疗药物浓度分别为(0.23±0.08)μg/ml,(0.12±0.04)μg/ml和(0.06±0.02)μg/ml,NRP-1抗体组和NRP-1 knockdown组与PBS组对比,P值分别为0.035和0.007。结果表明两种方法抑制NRP-1功能均能增加细胞对化疗药物的敏感性,使细胞凋亡率增加。NRP-1抗体组和NRP-1 knockdown组对比,两者半数凋亡浓度无统计学差异(P=0.081)。
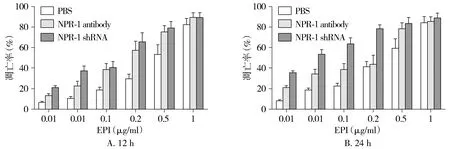
图5 不同处理组处理12 h和24 h后的细胞凋亡率 (n=3)Figure 5 Apoptosis rate after treatment for 12 h and 24 h in different treatment groups (n=3)
3 讨论
口腔颌面部恶性肿瘤的发病率居全身恶性肿瘤的第六位,而其中至少有80%是鳞状细胞癌[14]。口腔舌鳞状细胞癌恶性程度较高,且易发生淋巴结转移,预后较差,术后常继发畸形,对患者生活质量造成极大影响[15,16]。而传统放化疗对舌癌效果不佳,故研究新的治疗方式尤为重要。恶性肿瘤的快速生长,需要大量血管为其提供丰富的营养,通过抑制肿瘤内血管生成,从而抑制肿瘤生长,是治疗舌癌的重要思路之一[17]。而NRP-1具有独特的分子结构,其作为Sema3A和VEGF165等细胞因子的多功能受体,并受多种miRNA分子的负向调控,在神经发育、血管生成、肿瘤增殖和转移、调节免疫等方面发挥着重要作用,特别是其在肿瘤血管新生及肿瘤转移方面中的作用[18-20]。NRP-1有可能成为未来口腔癌靶向治疗的新靶点、新方向。
目前已有相关研究发现,NRP-1在人舌癌组织及细胞系TCa8113中呈高表达,提示可能和舌癌的发生发展有关[12,21]。但是目前仍没有NRP-1对人舌癌组织及细胞系TCa8113细胞生物学功能的相关基础研究,NRP-1对舌癌TCa8113细胞生物学特性的影响尚不清楚。本研究以舌癌TCa8113细胞为研究对象,采用敲低NRP-1或NRP-1抗体两种方法抑制TCa8113细胞NRP-1的功能,与野生型细胞比较,从而探讨NRP-1对TCa8113细胞的生物学特征的影响。本实验中,使用两种方法抑制NRP-1功能后,TCa8113细胞的增殖能力均显著降低,而凋亡率则显著增加,说明NRP-1对TCa8113的发生发展有促进作用。在抑制NRP-1功能后,流式细胞术结果显示,细胞发生凋亡,且多集中在早期凋亡。该结果与NRP-1在其他肿瘤中的作用相同。唐子春等[22]利用慢病毒介导的RNA干扰技术,特异性抑制NRP-1基因在人舌鳞状细胞株SCC25中的表达,结果提示NRP-1基因沉默可显著降低肿瘤细胞的体外迁徙能力。本研究在TCa8113细胞中也得到相同结果。
舌癌的原发或继发耐药是导致疗效差及复发率与死亡率高的重要原因[23]。近年来,探究舌癌的耐药机制、如何克服或逆转耐药成为口腔舌癌治疗的研究热点。目前有研究报道,NRP-1可能与各类肿瘤的耐药相关[24-26]。在本研究中,两种方法抑制NRP-1功能后,细胞对化疗药物的敏感性明显增加,NRP-1或可成为逆转舌癌耐药的一个重要靶点。或可通过NRP-1单克隆抗体抑制NRP-1功能,从而提高舌癌对化疗药物的敏感性。
本研究首次从细胞水平上探讨NRP-1对口腔舌癌TCa8113细胞生物学特性的影响研究,但相关的机制仍未探究,后期仍需要更深入探究NRP-1影响TCa8113细胞生物学特性的机制。
