miR-92b在子痫前期患者中的表达和意义
2019-08-06温云花
吴 颖,王 莉,葛 菲,温云花,史 春
(1海口市妇幼保健院妇产科,海口 570203;2海南省人民医院妇产科;*通讯作者,E-mail:fenghuo58@163.com)
子痫前期(preeclampsia,PE)是一种在怀孕期间发生的综合征,PE是孕产妇、新生儿和胎儿死亡的主要原因[1]。研究发现,胎盘血管形成障碍及母体内皮细胞损伤导致胎盘缺氧时产生的不同细胞因子可能是PE发生发展的始动因素[2]。目前,PE的致病分子机制尚未完全了解,因此难以监测疾病进展,微小RNA(microRNA,miRNA)可能是PE的潜在生物标志物或有效治疗靶点[3],可为严重子痫前期的早期发现和诊断提供信息,为PE的监控和临床管理提供了新的思路。miRNAs是一系列小的(18-24个核苷酸)内源性非编码单链RNAs,可通过非完全配对6-8个核苷酸,于转录后水平调控靶mRNAs的表达,目标mRNA随后通过形成RNA诱导的沉默复合物而降解,miRNA可以控制一系列不同的生物功能,包括细胞分化,增殖和凋亡[4-6]。在妊高征患者的胎盘中已经发现miRNA的高表达,表明它们可能在子痫前期中有其独特的功能。这些miRNA包括miR-92b,miR-342-3p,miR-197,miR-25等[7,8],本研究拟使用逆转录-定量聚合酶链式反应(RT-qPCR)在PE患者的血清中研究miR-92b的表达差异,并通过体外低氧模型的细胞增殖,探索细胞凋亡中miR-92b的表达及意义,为进一步研究PE生物标志物的病理生理机制提供理论基础。
1 资料与方法
1.1 临床资料及血清收集
选取2015-01~2017-12海南省人民医院产科招募的60名子痫前期孕妇为研究组,60名健康孕妇志愿者为对照组。纳入标准:年龄19-42岁,单胎妊娠,孕周35-40周。排除标准:在签署知情同意书前6个月内患有肾病或原发性高血压,有酒精或药物滥用史,吸毒史的患者。每位入组者在首次入院时收集5 ml静脉血。将血液吸入无抗凝血剂的无菌管中以收获无细胞血清。试管保持静置20 min后,在20 ℃和2 000 r/min下离心10 min,用移液管快速除去上清液,立即-80 ℃保存。本研究经本院伦理委员会批准,研究前签署知情同意书。
1.2 细胞培养
人绒毛膜癌(JAR)细胞系购买自上海然泰生物科技有限公司。JAR细胞在含有高葡萄糖-Dulbecco改良的Eagle培养基并补充有10%胎牛血清(Hyclone;GE Healthcare Life Sciences,Logan,UT,USA)和1%青霉素/链霉素(Mediatech,Inc)的培养基中培养,培养基则置于5%CO2的潮湿气氛的37 ℃培养箱内。缺氧处理方法将单细胞悬浮液中并接种到96孔板(1×104个细胞/孔)后,使用AnaeroPack系统(Mitsubushi Gas Chemical America,Inc.,New York,NY,USA)诱导JAR细胞低氧模型[8],设置6个重复,持续48 h,收集细胞记为缺氧组(n=6),同时收集未经缺氧处理的JAR细胞,记为对照组(n=6),进行后续实验。
1.3 real-time PCR
使用TRIzol试剂提取研究组(n=60)和对照组(n=60)孕妇血清、对照组(n=6)和缺氧组(n=6)细胞总RNA,随后用75%乙醇代替异丙醇进行RNA沉淀。使用NanoDrop 1000分光光度计测定RNA质量。以DBI Bestar qPCR RT试剂盒(DBI Bioscience,Ludwigshafen,德国)将总共1 μg RNA反转录成cDNA。使用7500 Fast Real-Time PCR仪进行RT-PCR,检测血清和细胞中miR-92b的表达。20 μl PCR反应包括1 μl逆转录产物(1 ∶5),上下游引物各0.5 μl和10 μl DBI-2043Bestar®实时PCR主混合物。引物序列见表1。将反应物在96孔光板中于94 ℃温育2 min,然后进行94 ℃ 20 s,8 ℃ 20 s和72 ℃ 20 s的40个循环。使用2-ΔΔCt公式对miRNA进行定量。
表1 PCR引物序列
Table 1 PCR primer sequences

基因引物序列miR-92b上游引物:5′-TATTGCACTCGTCCCGGCCTCC-3′下游引物:5′-TGGTGTCGTGGAGTCG-3′U6上游引物:5′-CTCGCTTCGGCAGCACA-3′下游引物:5′-AACGCTTCACGAATTTGCGT-3′
1.4 细胞增殖实验
使用Lipofectamine 2000将miR-92b mimics及其相应对照(上海吉玛基因化学科技有限公司)转染到缺氧预处理后的JAR细胞中,分别记为miR-92b mimics组(n=6)和control组(n=6),然后在37 ℃下在不含FBS的DMEM中孵育48,72,96 h。在各孔中加入100 μl Cell Counting Kit-8溶液(Dojindo Molecular Technologies,Inc.,Kumamoto,Japan),并在37 ℃下完成孵育1 h,使用酶标仪在450 nm处测量吸光度(OD450 nm)以描述细胞增殖情况。
1.5 Western blot检测cleaved caspase 3、Bcl2、Bax表达
在缺氧环境中对JAR细胞转染miR-92b mimics及其相应对照 48 h,分别记为miR-92b mimics组(n=6)和control组(n=6),提取两组细胞的总蛋白,用BCA试剂盒测定蛋白浓度。将各组蛋白与Loading buffer充分混合后100 ℃煮沸5 min变性,每孔50 μl加入到SDS-PAGE凝胶上样孔中进行电泳和转膜,5%脱脂奶粉37 ℃封闭1 h。加入按使用说明稀释后的待测一抗4 ℃过夜[待测一抗包括:cleaved caspase 3(1 ∶1 000)、Bcl2(1 ∶2 000)、Bax(1 ∶1 500)]。TBST清洗后加入辣根过氧化物酶标记的羊抗鼠IgG(1 ∶1 000稀释)。37 ℃孵育1 h,TBST清洗后以ECL发光液显影,以自动凝胶成像系统采集图像,以GAPDH为内参分析各蛋白表达水平。
1.6 统计学方法
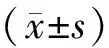
2 结果
2.1 一般临床资料比较
两组入选者在年龄、体质量、凝血酶原时间、活化部分凝血凝血活酶时间、凝血酶时间、尿素氮方面无明显统计学差异(P>0.05),而子痫前期孕妇的收缩压和舒张压显著高于对照组,生产时妊娠周数、肌酐、新生儿体质量、24 h尿蛋白也明显高于对照组,差异均有统计学意义(P<0.05,见表2)。
表2 研究组与对照组临床特征和实验室检查结果比较
Table 2 Clinical features and laboratory examination results of the study group and the control group

临床特征研究组(n=60) 对照组(n=60) P年龄(岁) 28.96±5.12 29.63±3.690.439体质量(kg) 68.55±8.29 68.14±7.630.910体质量指数(kg/m2) 29.20±1.90 26.95±1.200.038确诊PE时妊娠周数(周) 31.20±3.03 --生产时妊娠周数(周) 35.20±3.21 38.90±1.230.000收缩压(mmHg) 156.12±11.35 114.90±9.350.000舒张压(mmHg) 100.01±9.32 69.30±6.380.000凝血酶原时间(s) 11.35±0.61 11.52±0.900.493活化部分凝血活酶时间(s) 28.31±3.83 28.81±3.550.630凝血酶时间(s) 16.88±2.31 16.24±0.850.620血红蛋白(g/L) 111.63±12.36 114.96±11.310.393尿素氮(mmol/L) 4.29±1.50 3.59±1.010.099肌酐(μmol/L) 58.26±16.34 42.29±6.620.000新生儿体质量(g)2489.51±658.353270.00±392.230.00024 h尿蛋白(mg)2061.45±1960.13 109.31±39.20.000
2.2 研究组与对照组血清miR-92b水平比较
与对照组相比,研究组血清miR-92b表达明显降低,差异有统计学意义(P<0.05,见图1)。
2.3 缺氧处理后JAR细胞miR-92b表达水平变化
缺氧处理后JAR细胞与对照细胞相比,miR-92b表达明显降低,差异有统计学意义(P<0.05,见图2)。
2.4 miR-92b对细胞增殖的影响
以miR-92b mimics转染细胞后48,72,96 h,JAR细胞在缺氧环境中细胞增殖均较转染对照的control组明显增加(P<0.05,见图3)。

与对照组比较,*P<0.05图1 研究组与对照组血清miR-92b水平比较Figure 1 Comparison of serum mir-92b levels between study group and control group
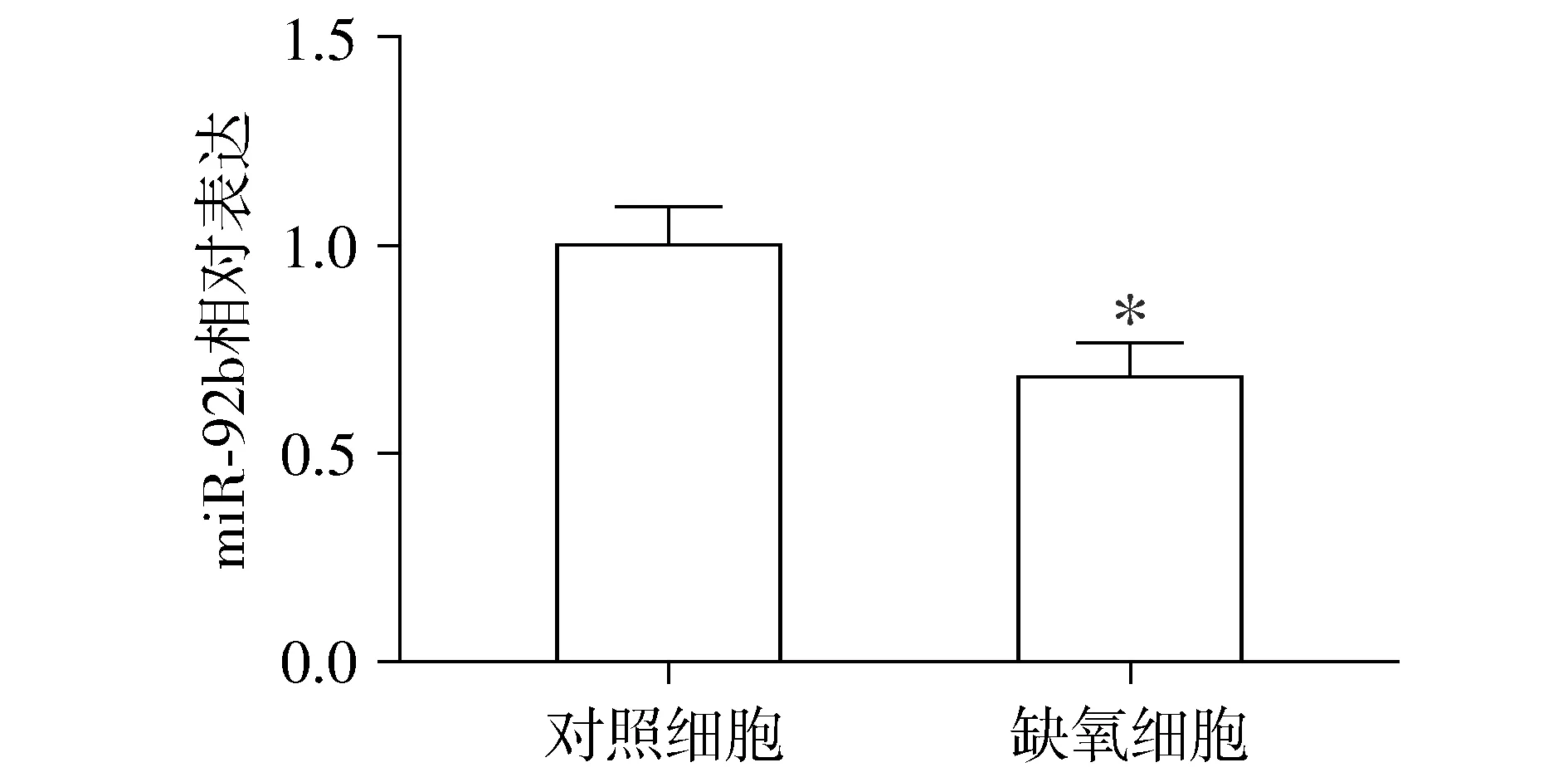
与对照细胞对比,*P<0.05图2 缺氧处理后JAR细胞与对照细胞miR-92b水平比较Figure 2 Comparison of mir-92b levels between hypoxic JAR cells and control JAR cells

与control组对比,*P<0.05图3 miR-92b表达对JAR细胞增殖的影响Figure 3 Effect of mir-92b expression on the proliferation ability of JAR cells
2.5 miR-92b对凋亡相关蛋白cleaved caspase 3、Bcl2/Bax表达的影响
缺氧环境中miR-92b mimics组JAR细胞较control组cleaved caspase 3、Bax表达降低、Bcl2表达增加(见图4)。

图4 miR-92b对凋亡蛋白cleaved-caspase 3、Bcl2/Bax的影响Figure 4 Effect of miR-92b on apoptotic protein cleaved-caspase 3, Bcl2/Bax
3 讨论
导致子痫前期的分子机制尚不清楚。研究者们认为,miRNA可能是潜在的子痫前期的生物标志物,本研究验证了妊娠期间子痫前期患者与健康对照组血清miR-92b表达差异,随后研究miR-92b对缺氧微环境下人绒毛膜癌细胞(JAR)增殖和凋亡的影响。PE患者中miR-92b的表达水平出现了明显降低,进一步的研究证明,miR-92b mimics组缺氧微环境中JAR细胞的增殖能力增加,凋亡相关蛋白cleaved caspase 3、Bax表达降低,抗凋亡蛋白Bcl2表达增加。本研究结果提示,高水平的miR-92b可以增加缺氧环境下细胞存活率,血清miR-92b表达缺失可能是PE发生发展的生物标志物。
miR-92b的功能十分复杂,在恶性肿瘤中,miR-92b表达升高所造成的抗凋亡、促进细胞存活的作用可能是肿瘤细胞恶性转化的原因之一,因此,在子宫内膜癌、胃癌、乳腺癌等实体瘤中常常出现miR-92b的异常表达[9,10]。但是在心血管疾病中,miR-92b的过表达对于心肌细胞具有明显的保护作用,减少缺氧诱导的心肌细胞死亡[11,12],在不同疾病中miR-92b表达的意义完全不同,本研究的结果支持miR-92b可能成为PE良好预后的潜在生物标志物的可能性,针对提高miR-92b的治疗方法可能成为改善PE患者临床结果的新方法。
miRNA通常靶向基因的3′非翻译区,并导致靶基因表达的降低或者丧失。在既往的研究中,有人提出fms样酪氨酸激酶-1(sFlt-1)和胎盘生长因子(placental growth factor,PIGF)的比例可能是子痫前期的另一种诊断或预测工具[13,14]。荟萃分析显示,母亲出现子痫前期的孕妇胎盘sFlt1浓度升高,PIGF浓度降低。而且,发生严重子痫前期的女性血管内皮生长因子水平明显降低,胎盘细胞出现明显的缺氧性改变[15],miR-92b作为影响细胞缺氧抗性的miRNA,可能对sFlt-1或PIGF的表达具有一定的调控作用。在PE期间miR-92b与上述mRNA的调控关系以及miR-92b可能的靶基因的寻找还需进一步研究。
综上所述,本研究表明在PE患者的临床血清样品中miR-92b的表达显著下调。通过其特异性模拟物上调miR-92b,发现JAR细胞增殖能力增加,凋亡蛋白表达降低。miR-92b表达缺失可能在PE过程中调控细胞增殖和凋亡影响PE的发展和演进,外源性上调miR-92b可能是阻碍PE发生发展的可能途径之一。
