尿石素A对1型糖尿病小鼠血糖的影响及其机制
2019-08-05巴合提别克托合塔尔拜克田亚丽古丽海夏哈勒马合拜张之
巴合提别克·托合塔尔拜克, 李 林, 田亚丽, 古丽海夏·哈勒马合拜, 张之
(新疆医科大学1基础医学院生物化学教研室; 2药学院药理学教研室, 乌鲁木齐 830011)
近年来糖尿病成为影响人类健康和生存的主要疾病之一[1]。糖尿病是由于胰岛素分泌缺陷及(或)其生物学功能障碍引起的以高血糖为特征的代谢性疾病。研究表明,高血糖可引起胰岛β细胞损伤[2],炎症细胞因子可以诱导胰岛β细胞凋亡[3],长期的高血糖进一步刺激炎症细胞因子产生,从而产生恶性循环,高血糖和炎症在1型糖尿病的发生和发展过程中扮演了重要角色。
鞣花酸是广泛存在于石榴、蓝莓等植物中的一种天然多酚类物质,尿石素A是鞣花酸经肠道菌群代谢产生的主要代谢产物。研究表明尿石素A(UA)在体内外具有抗氧化生物活性[4],Piwowarski等[5]发现尿石素A能够抑制LPS诱导的巨噬细胞炎症反应,Ryu等[6]研究发现尿石素A可改善线粒体质量和功能,提高衰老肌肉的力量和耐力,是目前为止唯一一个被证实能够重启线粒体自噬、逆转肌肉衰老的天然产物。本研究以链脲佐菌素(STZ)诱导的1型糖尿病模型小鼠为基础,研究尿石素A的抗糖尿病作用,并从自噬角度探讨其初步作用机制,现报道如下。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF级雄性昆明小鼠,8周龄,体质量23~25 g,购自新疆医科大学动物实验中心(医动字:SCXK2016-0002),链脲佐菌素(STZ,Sigma公司),尿石素A(纯度≥ 98%,上海甄准生物有限公司),氯喹(CQ,武汉鼎晖生物科技有限公司),普通饲料(新疆医科大学动物实验中心)。糖化血清蛋白(glycosylated serum protein,GSP),胰岛素(Insulin,INS),白细胞介素1β(interleukin-1β,IL-1β),肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒均购自思倍特生物科技有限公司。电子天平(厂家:上海菁海仪器有限公司,型号:YP202N),分析天平(XS205DU),离心机(MULTIFUGE X3R),酶标仪(Multiskan GO 1.01.12),制冰机(厂家:常熟市菱科电器有限公司,型号:LK20180069),组织包埋机(厂家:武汉汉谷医疗科技有限公司,型号:HB-P2),自动脱水机(LEICA.TP 1020型),切片机(LEICA.RM 2235型),血糖仪(Roche Diagnostic,mannheim,Germany)。
1.2 糖尿病模型制备昆明小鼠40只,适应性饲养3 d后,按体质量随机分出正常对照组(C)10只,其余小鼠禁食不禁水12 h后按50 mg/kg的剂量腹腔注射脲佐菌素(STZ)5 d,每天1次,正常对照组腹腔注射同体积柠檬酸-柠檬酸钠缓冲液。72 h后剪尾取血测空腹血糖,以空腹血糖>11.1 mmol/L,且出现多饮多尿症状为造模成功。所有小鼠均给予普通饲料喂养,自由饮食饮水,所有动物均按照《中华人民共和国动物保护公约》的规定处理。
1.3 动物分组及给药将STZ腹腔注射造模成功的小鼠根据空腹血糖随机分为模型组(M)、尿石素A干预组(UA)和尿石素A和自噬抑制剂氯喹干预组(UA+CQ),每组10只。实验期间,正常对照组和模型组根据体质量灌胃生理盐水,UA组和UA+CQ组每天按50 mg·kg-1·d-1剂量给予尿石素A灌胃,UA+CQ组另外每3天按50 mg/kg的剂量腹腔注射氯喹溶液,连续给药8周。药物剂量50 mg/kg是根据人类营养和药物活性成分的标准给药方案[7]和Savi等[8]的研究结果来确定。
1.4 空腹血糖和口服葡萄糖耐量的测定空腹血糖(fasting blood glucose,FBG)采用ACCU-CHEK血糖仪剪尾取血法测定。在口服葡萄糖耐量试验(OGTT)中,小鼠禁食不禁水6 h后称重,并测空腹血糖,然后按2 g/kg的量予葡萄糖灌胃,在灌胃后的15、30、60、90、120 min检测血糖水平,计算曲线下面积AUC,AUC=1/4×空腹血糖+1/2×0.5 h血糖值+3/4×1 h血糖值+2 h血糖值。
1.5 血清样本的收集和指标检测实验结束时,所有小鼠禁食不禁水4 h,称重并测量空腹血糖。用10%水合氯醛麻醉小鼠,确认小鼠对疼痛无反应后摘除眼球采集血样,3 000 r/min 4℃离心10 min后收集血清,分装后存储在-80℃冰箱中,用于检测GSP、INS、IL-1β、TNF-α水平。
1.6 胰脏样本的收集和病理学观察取下小块胰尾用2.5%戊二醛固定,4℃保存,锇酸固定,脱水,环氧树脂包埋后用JEOL1230(H)型透射电镜观察。胰头用4%多聚甲醛固定,乙醇分级脱水后石蜡包埋,5~6 μm石蜡切片后HE染色进行病理组织学观察。剩余胰脏投入液氮中,最后保存于-80℃冰箱备用。

2 结果
2.1 尿石素A对糖尿病小鼠体质量的影响正常对照组小鼠体质量逐渐升高,糖尿病模型组小鼠体质量逐渐下降,第2、4、6、8周明显低于正常组,差异均有统计学意义(P<0.05或P<0.01)。在给药第8周,UA组体质量大于模型组,差异具有统计学意义(P<0.05)。UA + CQ组小鼠体质量呈下降趋势,在给药第8周时明显低于UA组,差异具有统计学意义(P<0.05)。见表1。
2.2 尿石素A对糖尿病小鼠空腹血糖的影响糖尿病模型建立后第2、4、6、8周,模型组小鼠空腹血糖显著高于正常对照组,差异均有统计学意义(P<0.01)。给药2、4、6、8周,UA组空腹血糖均低于模型组,差异均有统计学意义(P<0.05或P<0.01)。在给药第6、8周,UA+CQ组血糖高于UA组,差异均有统计学意义(P<0.05)。见表2。
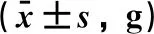
表1 尿石素A对糖尿病小鼠体质量的影响
注:与正常对照组比较,*P<0.05,**P<0.01; 与模型组比较,#P<0.05; 与UA组比较,△P<0.05。
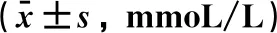
表2 尿石素A对糖尿病小鼠空腹血糖的影响
注: 与正常对照组比较,**P<0.01; 与模型组比较,#P<0.05,##P<0.01; 与UA组比较,△P<0.05。
2.3 尿石素A对糖尿病小鼠血清GSP和INS水平的影响与正常对照组比较,糖尿病模型组小鼠GSP和INS升高,差异有统计学意义(P<0.01)。与模型组比较,UA组GSP和INS显著降低(P<0.01)。与UA组比较,UA+CQ组GSP和INS水平高于UA组,但差异无统计学意义。见表3。
2.4 尿石素A对糖尿病小鼠口服糖耐量的影响糖负荷后30、60、120 min 3个时间点,模型组的血糖值均明显高于正常对照组(P<0.01),UA组血糖值均低于模型组,在60、120 min差异具有统计学意义(P<0.05或P<0.01)。在糖负荷后30、60、120 min时UA+CQ组血糖值高于UA组,在60 min时差异有统计学意义(P<0.05)。与正常对照组比较, 模型组口服糖耐量曲线下面积AUC明显增大(P<0.01),与模型组比较,UA组曲线下面积降低(P<0.05),与UA组比较,UA+CQ组口服糖耐量曲线下面积AUC较大,但差异无统计学意义。见表4。
2.5 尿石素A对糖尿病小鼠血清炎症因子IL-1β和TNF-α的影响与正常对照组比较,模型组小鼠血清IL-1β、TNF-α 水平均显著升高(P<0.01)。与模型组比较,UA组IL-1β、TNF-α 明显下降,具有统计学差异(P<0.01)。与UA组比较,UA+CQ组IL-1β、TNF-α均高于UA组,具有统计学差异(P<0.01)。见表5。
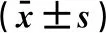
表3 尿石素A对糖尿病小鼠GSP和INS水平的影响
注:与正常对照组比较,**P<0.01; 与模型组比较,#P<0.05,##P<0.01。
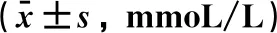
表4 尿石素A对糖尿病小鼠OGTT的影响
注: 与正常对照组比较,**P<0.01; 与模型组比较,#P<0.05,##P<0.01; 与UA组比较,△P<0.05。

表5 尿石素A对糖尿病小鼠IL-1β和TNF-α的影响
注: 与正常对照组比较,**P<0.01; 与模型组比较,##P<0.01; 与UA组比较,△△P<0.01。
2.6 尿石素A对1型糖尿病小鼠胰岛形态的影响正常对照组小鼠胰岛细胞形态正常,大小均匀,胰岛数量及岛内细胞数均较多,胞浆充实饱满;模型组小鼠胰岛明显萎缩,形状杂乱,边界模糊,细胞数相对减少,胞浆疏松;UA组小鼠胰岛尚小,但是形状已基本规则,胰岛与外分泌部界限比较清晰,胰岛细胞数目比模型组增多。UA+CQ组小鼠胰岛萎缩,边界模糊,胰岛数目较少,比模型组稍好。见图1。
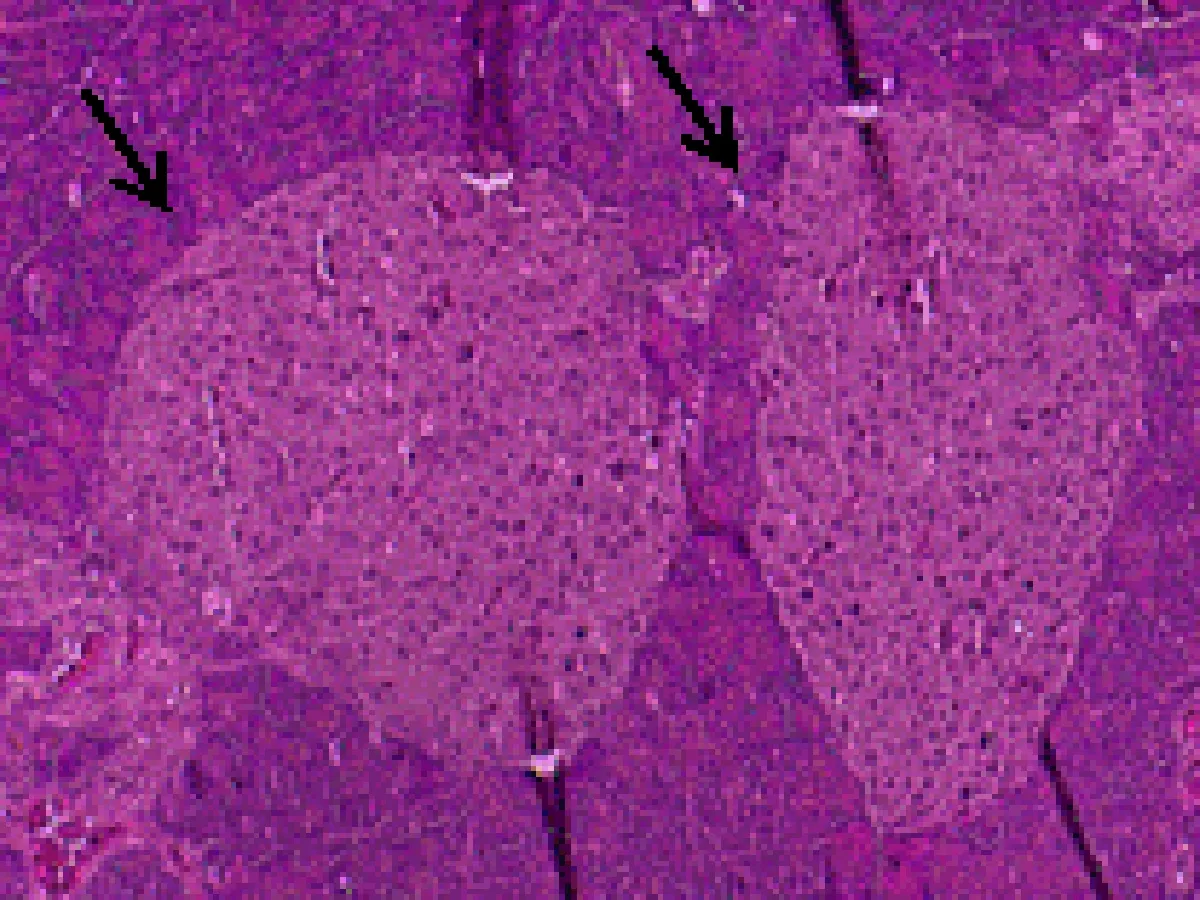
A:正常对照组
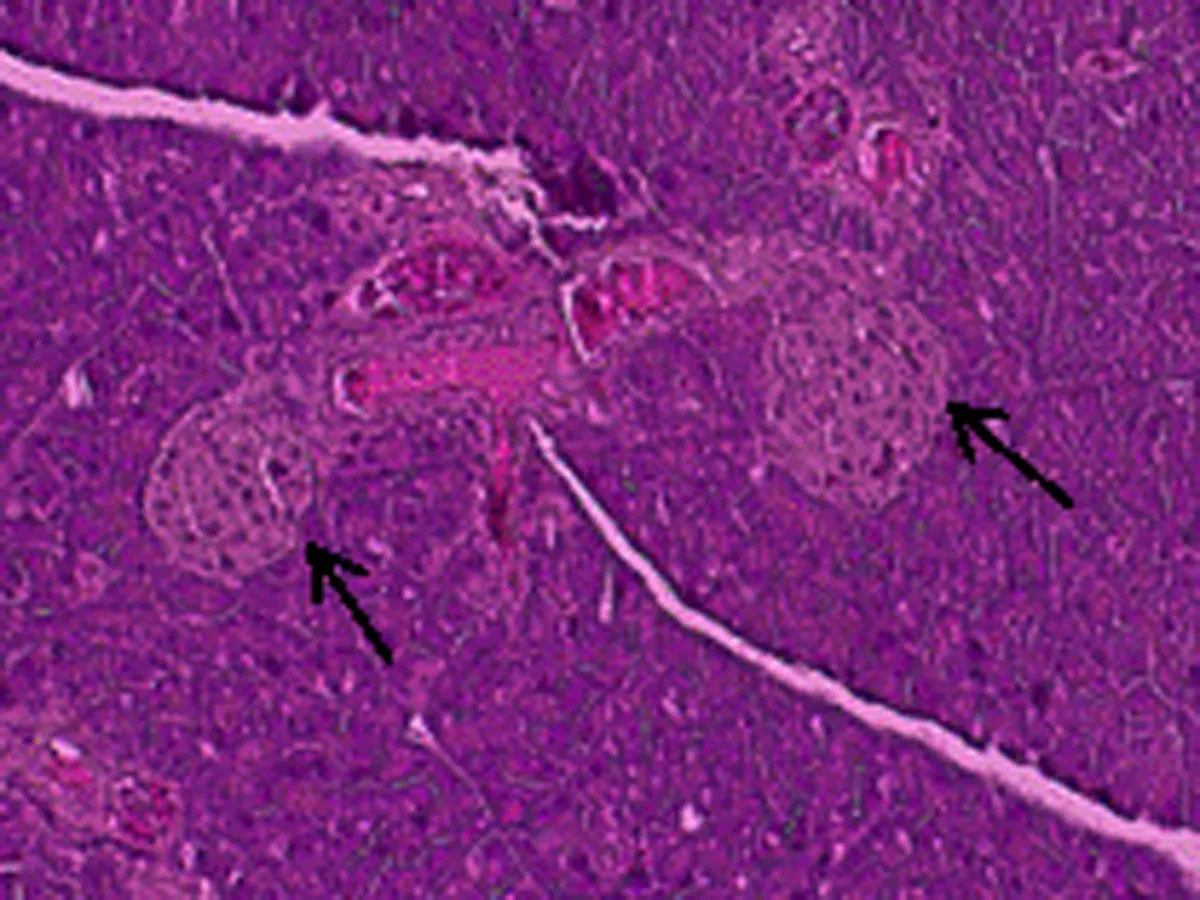
B:模型组
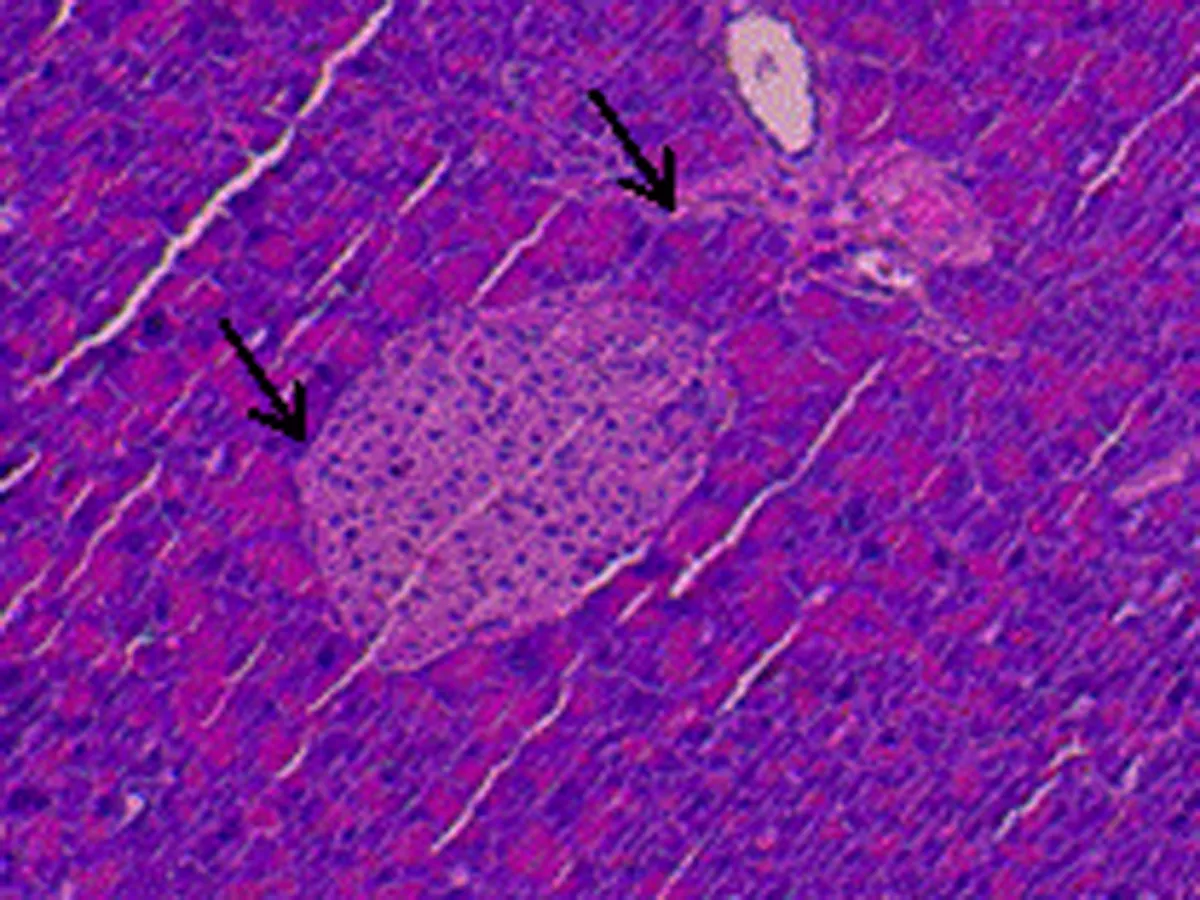
C:尿石素A干预组
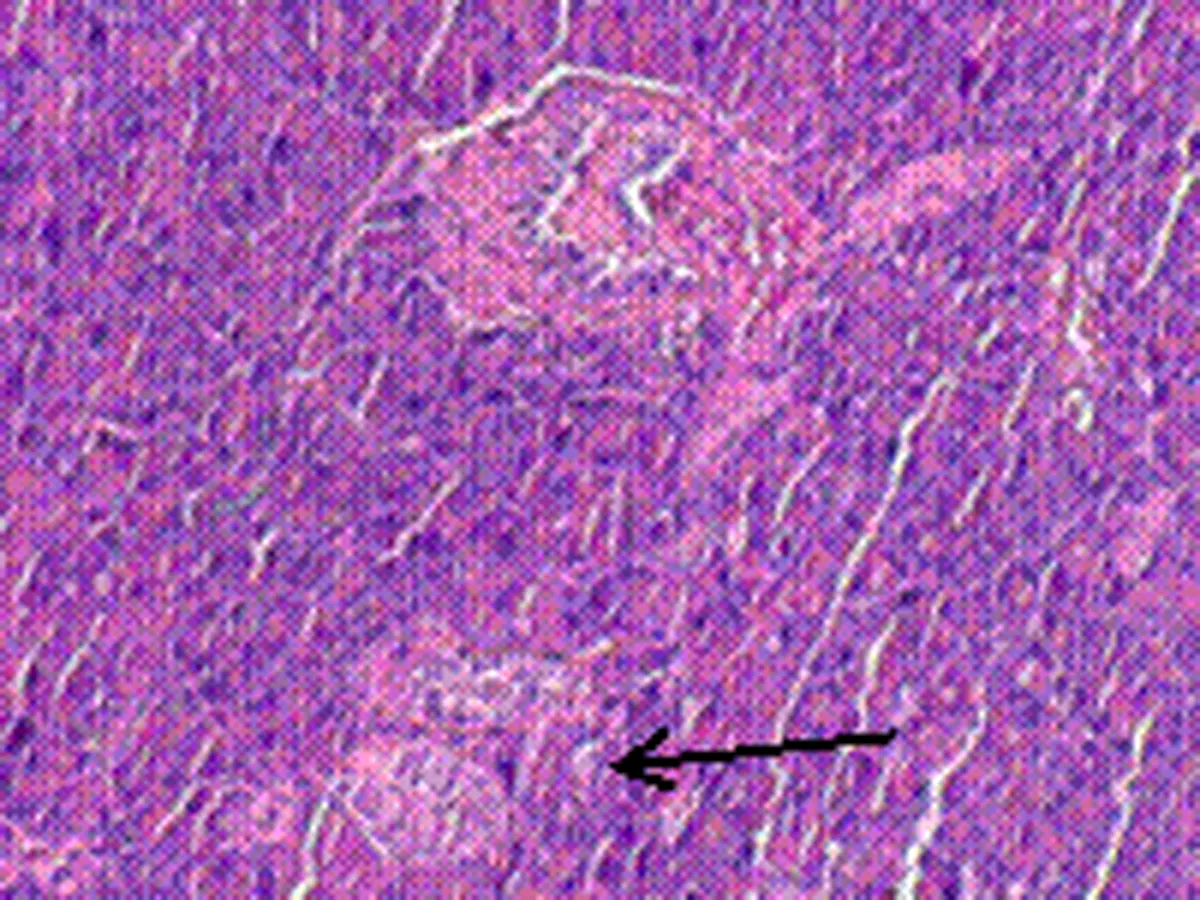
D:尿石素A和自噬抑制剂氯喹干预组
图1 尿石素A对1型糖尿病小鼠胰岛形态的影响(HE染色,×200,箭头示胰岛)
2.7 尿石素A对1型糖尿病小鼠胰腺组织超微结构和自噬小体的影响透射电镜下糖尿病模型组胰岛细胞数量少,分泌颗粒少,线粒体肿胀多,线粒体嵴断裂,内质网扩张,髓鞘样小体形成。与糖尿病模型组小鼠比较,UA组小鼠胰腺超微结构损伤较少。UA+CQ组胰腺细胞线粒体肿胀、双层膜结构不清,线粒体嵴断裂等变化与糖尿病模型组几乎相同。UA组小鼠的胰岛细胞中观察到大量的自噬空泡,而在糖尿病模型组和UA+CQ组小鼠的细胞中观察到更多包含未降解物的自噬泡。见图2。
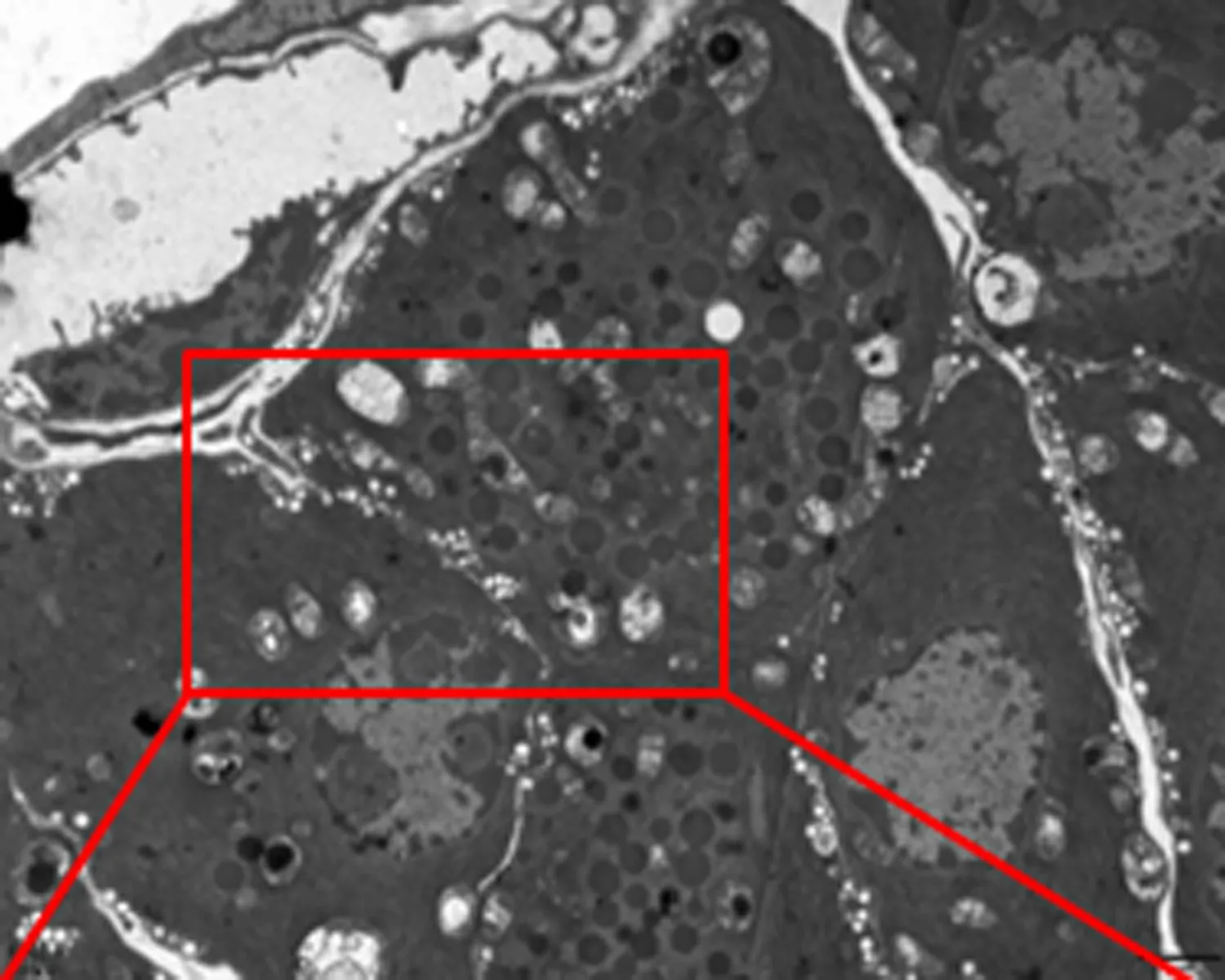

M组
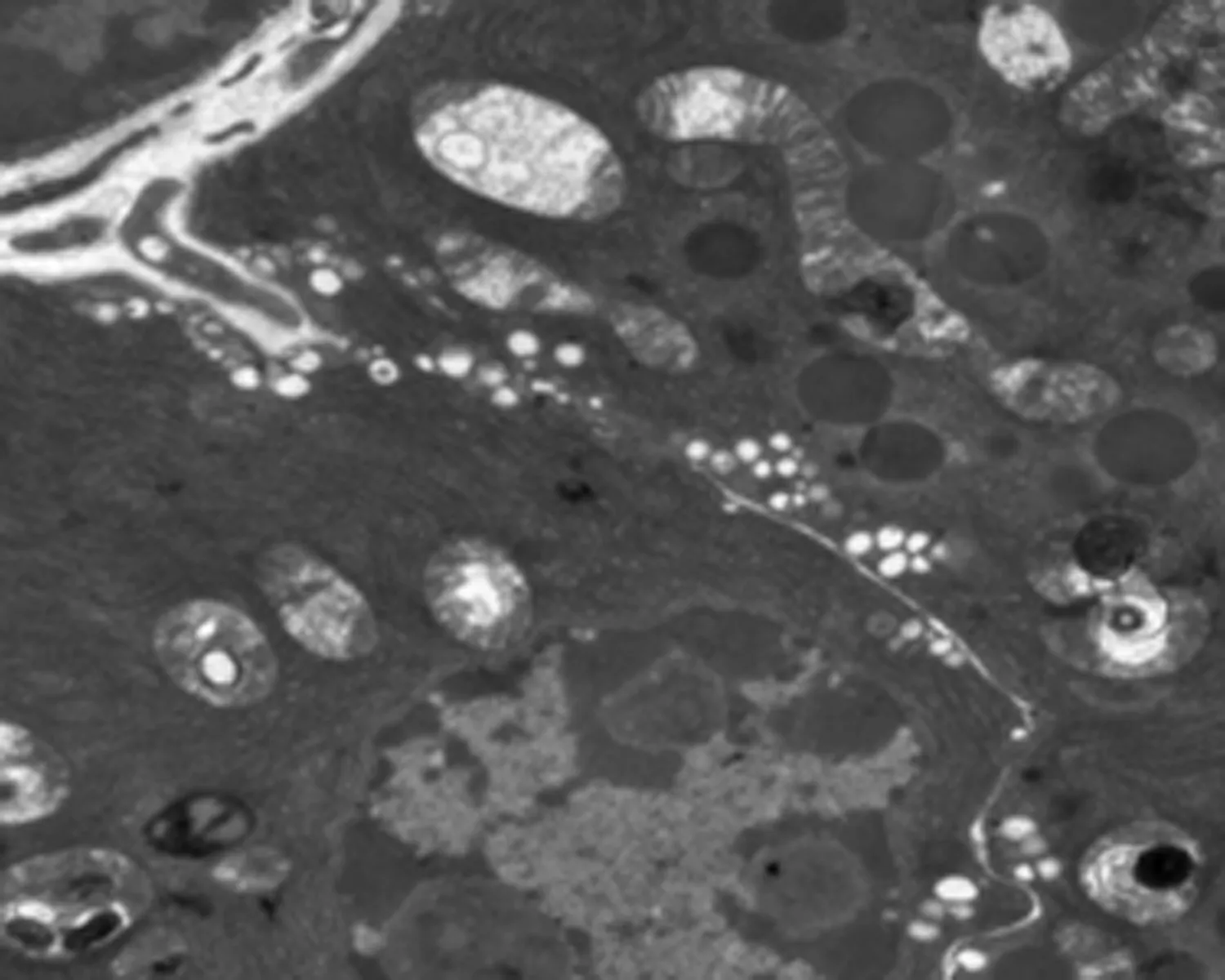
UA组
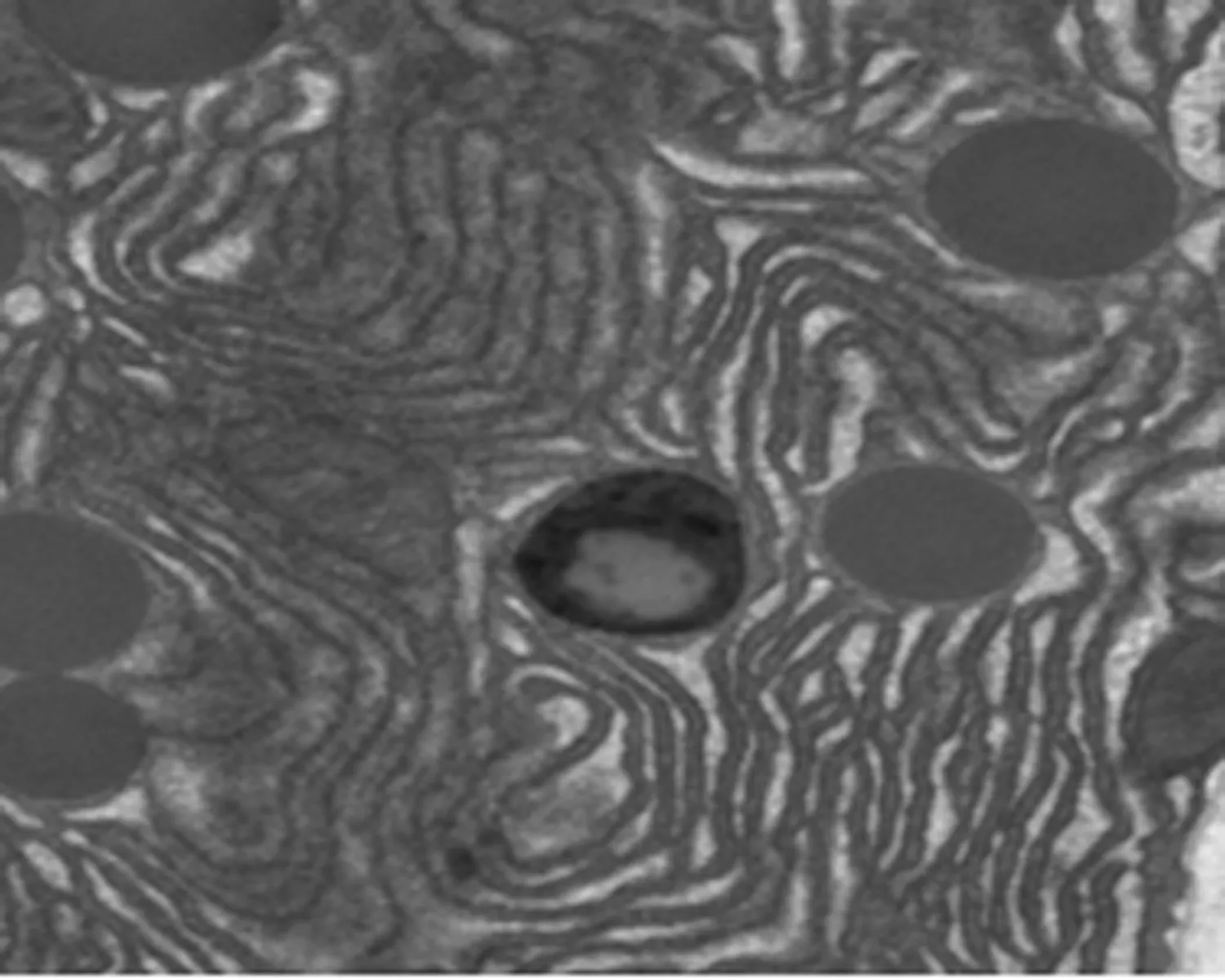
UA+CQ组
图2 尿石素A对1型糖尿病小鼠胰腺细胞超微结构和自噬小体的影响
(TEM, 6 000×80 KV, scale bar, 2 μm,红色方框表示含有细胞碎片的自噬液泡及其部分放大结果)
3 讨论
本研究以小剂量多次腹腔注射STZ建立1型糖尿病小鼠模型,随着病程的进展糖尿病小鼠出现精神萎靡,多饮多食多尿,体质量下降等类似人类糖尿病的症状,而尿石素A干预后糖尿病小鼠以上症状显著改善,小鼠状态明显活跃、毛发光亮,垫料潮湿度明显降低。
高血糖和炎症在糖尿病的发生、发展过程中扮演着非常重要的角色[9],高血糖和炎症都可以损伤胰岛β细胞,促进胰岛细胞凋亡,最终可导致胰腺胰岛素分泌耗竭。近年来,大量临床证据证实他汀类药物[10]、PPAR激动剂[11]和血管紧张素转换酶抑制剂[12]因具有一定的抗炎作用,可能有一定的预防或延缓糖尿病的作用,但这些西药的不良反应多。本研究发现天然产物尿石素A能够显著降低糖尿病小鼠炎症细胞因子TNF-α和 IL-1β水平,具有显著改善糖尿病炎症状态的作用。高血糖引起白蛋白和其他蛋白分子N未端发生非酶促糖化反应,形成糖化血清蛋白,白蛋白半寿期为17~20日,因此糖化血清蛋白是反映近期2~3周内血糖控制水平的一个灵敏指标。本研究结果显示糖尿病小鼠空腹血糖、糖化血清蛋白显著升高,并伴有高胰岛素血症,但是给予糖负荷后小鼠血糖不能有效降低,揭示该糖尿病模型小鼠胰岛β细胞在高血糖刺激时尚能代偿性分泌大量胰岛素,但胰岛素不能正常地发挥作用,不能有效地促进外周胰岛素靶器官摄取葡萄糖来降低血糖,说明该糖尿病模型小鼠分泌的胰岛素质量或敏感性下降,提示有胰岛素抵抗,Kaul等[13]也报道1型糖尿病模型有胰岛素抵抗现象。尿石素A干预之后糖尿病小鼠空腹血糖、糖化血清蛋白及糖负荷后血糖水平均显著降低,同时胰岛素水平也降低,因此尿石素A可能并不是通过提高胰岛素分泌量来降血糖的,尿石素A可能改善了胰脏分泌的胰岛素的质量或敏感性[14]。
细胞自噬是机体生成自噬小体包裹错误折叠的蛋白质、功能失调的细胞器等有害物质,通过溶酶体与自噬体融合,降解清除细胞自身病变物质使细胞恢复正常状态的过程,在保证细胞质量方面有重要作用。Hirotaka等[15]报道自噬活动的抑制会导致糖尿病胰腺β细胞凋亡或功能障碍,Zhao等[16]报道自噬激活可改善脓毒症患者的肺损伤和炎症,而抑制自噬会加重炎症,已有研究报道正常的自噬活动提高胰岛素分泌质量和胰岛素敏感性[17-18]。因此自噬过程与胰岛β细胞稳态、胰岛素分泌质量及炎症状态密切相关。尿石素A对糖尿病小鼠具有显著的降糖、改善炎症状态、改善胰岛和β细胞病理形态等作用,但与氯喹联合用药后,尿石素A的上述作用被严重削弱。氯喹是一种自噬抑制剂,可抑制自噬体与溶酶体的融合过程从而抑制自噬性清除,本研究中尿石素A干预小鼠的胰岛细胞中观察到大量的自噬空泡,而联合氯喹干预后观察到更多包含未降解物的自噬泡,因此尿石素A可能是通过激活自噬促进异常或功能障碍细胞器及时被降解清除,从而恢复胰腺β细胞稳态,改善了胰岛素分泌质量,从而纠正了糖尿病高糖、高炎症状态。
本课题组前期研究发现鞣花酸前体物鞣质具有抗糖尿病作用[19],但鞣质从肠道难吸收,因此推测富含鞣花鞣质的果蔬抗糖尿病的作用可能与其肠道菌代谢产物尿石素A的降糖、抗炎作用有关。本研究结果为富含鞣花酸的果蔬及一些中药如石榴等的抗糖尿病作用提供了一定的药理学依据,自噬信号途径在尿石素A保护胰腺β细胞作用中的详细分子机制值得进一步探索。
