中氮茚类化合物合成新方法的研究
2019-08-05周象勤王少印
洪 毅,周象勤,张 志,李 曦,王少印
(皖南医学院,安徽 芜湖 241000)
中氮茚类化合物是发现于自然界中的具有重要作用的有机物。从二十世纪八十年代开始就有大量的文献报道中氮茚及其衍生物的抗痉挛、消炎、抗菌、杀螨虫、抗高血压和抗癌活性[1-2]。
自从1890年Angeli发现中氮茚以来,中氮茚的合成引起了广泛的关注。中氮茚的合成方法很多[3-4],主要包括:(1)吡啶叶立德与缺电子的炔烃或者烯烃1,3-偶极环加成反应。1961年,Boekelheide等利用吡啶叶立德和丁炔二酸二甲酯发生l,3-偶极环加成反应,再脱氢芳构化合成了中氮茚衍生物。由于炔烃价格较烯烃昂贵,不容易得到,因此在氧化剂作用下,活泼烯烃作为亲偶极体合成中氮茚的方法研究得更为广泛。王炳祥等报道了吡啶类化合物与丙烯腈反应得到鎓盐,再在碱和氧化剂[Copy4(HCrO4)2](TpCD)作用下与缺电子烯烃进行1,3-偶极环加成反应,可以得到中氮茚-3-酞胺类化合物。接着活泼烯烃作为亲偶极体合成中氮茚的更多文献被报道。(2)分子间的缩合反应。1912年,Scholtz用α-甲基吡啶同乙酸酐反应,首次合成中氮茚的母核。Wassermann 小组报道了利用Tschitschibabin 缩合,合成1-乙基-2-(4'-苄氧基)苯基中氮茚。(3)过渡金属催化的分子内环化反应。Gevorgyan小组利用CuCl在130℃下,2-炔基吡啶经分子内环化、异构化反应得到3-丙基中氮茚。Yan小组报道了NaAuCl4·2H2O催化下,α-吡啶甲醛、胺、炔烃先经过3a反应生成炔丙基吡啶,再经过分子内环化合成中氮茚衍生物。(4)过渡金属催化的碳氢活化反应。碳氢活化以其原子经济性受到化学家的广泛关注,张玉红小组最近α-烷基吡啶与α,β-不饱和羧酸反应,合成中氮茚衍生物。(5)多组分串联反应。Zou小组用吲哚-2-甲醛,取代的甲基溴化物和活泼炔,“一锅法”串联合成取代中氮茚衍生物。尽管中氮茚衍生物的合成方法很多,但文献中报道的方法往往需要高温、无水无氧等苛刻的反应条件,昂贵的催化剂,或者产率低等,使合成中氮茚受到一定的限制。本文介绍了一种新的方法,使得中氮茚骨架可以在温和条件下以较高的产率合成,而且本方法无需催化剂帮助。所合成的产物经过1H NMR和13C NMR 表征。
1 实验部分
1.1 仪器与试剂
核磁共振仪采用Bruker AV-300 MHZ 超导核磁共振仪,以 TMS为内标,CDCl3为溶剂;IR仪采用 Shimadzu FT-8400s 红外光谱测定仪,使用 KBr压片处理;本文所用药品试剂均使用国产分析纯试剂。
1.2 合成(以 3a为例)
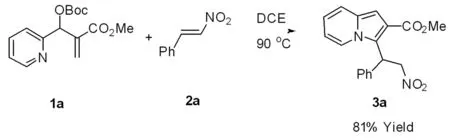
图1 中氮茚3a的合成
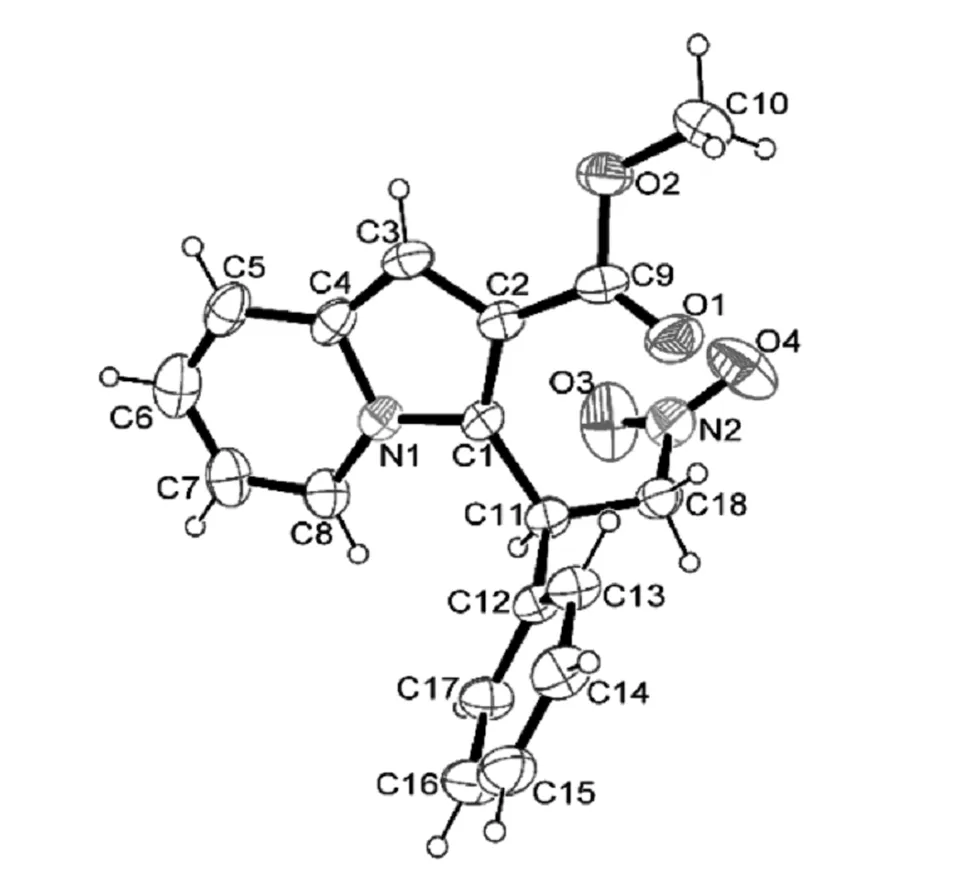
图2 中氮茚产物3a的X-ray单晶衍射图
在25 mL的Schlenk 反应试管中加入丙烯酸甲酯1a(1 mmol,293 mg)、硝基苯乙烯2a (1 mmol,150 mg)和5 mL 1,2-二氯乙烷(DCE)作为溶剂,在90℃条件下反应24 h后,停止反应,将溶剂1,2-二氯乙烷(DCE),负压旋干,石油醚-乙酸乙酯(5∶1)为洗脱剂,残留物经硅胶柱色谱分离得黄色固体(图1),产品262 mg,产物 3a进行了X-ray单晶衍射表征如图 2,收率为 81%。IR (KBr) v3412.1,2961.0,1705.1,1246.0,1234.4,767.7,707.9;1H NMR (300 MHz,CDCl3) δ 7.69 (d,J = 6.9 Hz,1H),7.43~7.05 (m,5H),6.86 (s,1H),6.64 (t,J = 7.4 Hz,1H),6.46 (t,J = 6.2 Hz,1H),5.97 (t,J = 7.2 Hz,1H),5.64~5.13 (m,2H),3.82 (s,3H)。13C NMR (75 MHz,CDCl3) δ 165.81,136.65,132.27,129.06,127.60,127.10,123.63,122.09,120.72,118.12,117.85,112.91,102.38,51.71,39.31。
用同样的方法合成(3b ~3k)(图3),实验结果及表征如下。
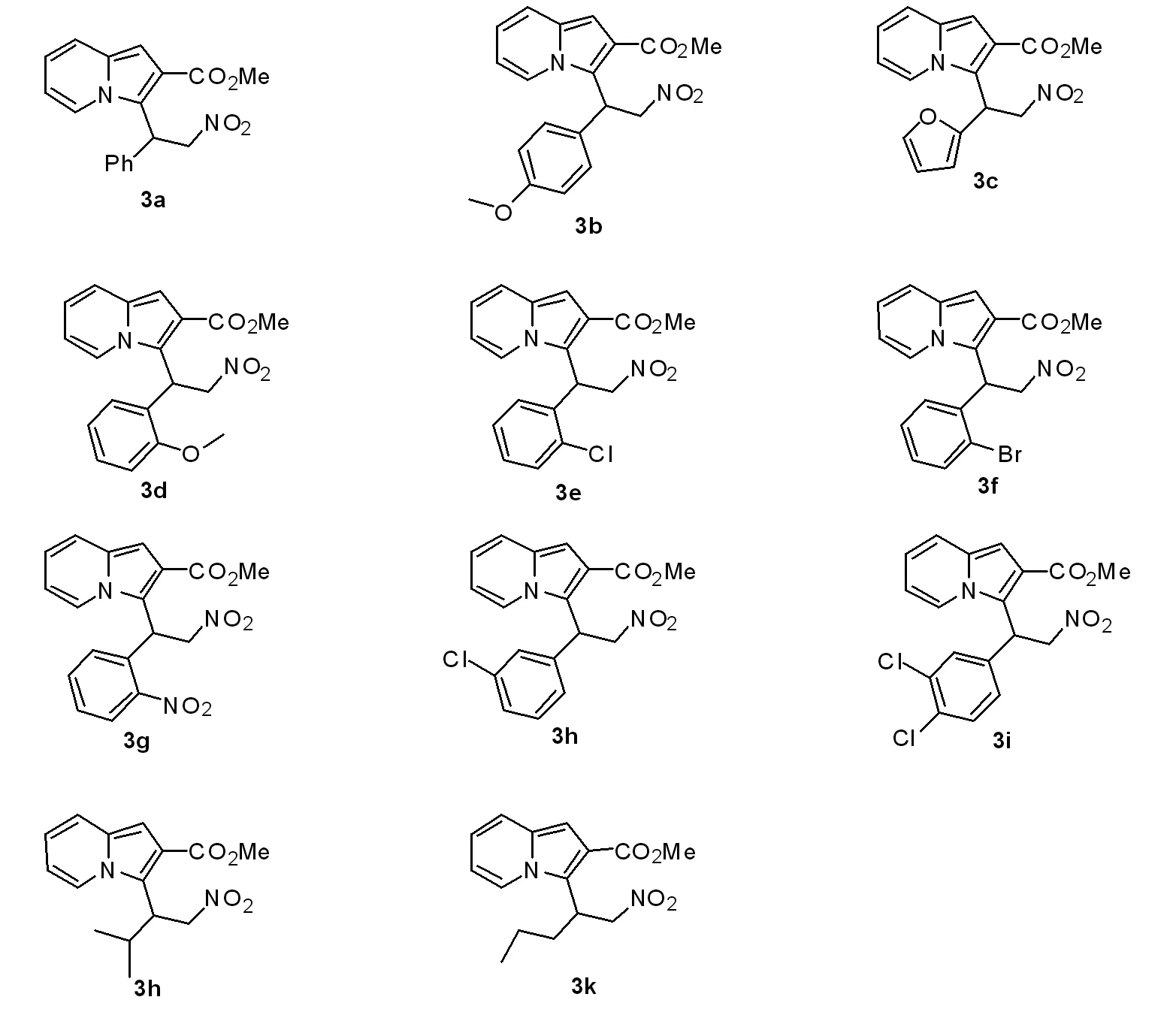
图3 不同取代基的中氮茚衍生物
3b:黄色粘稠状液体,产率:65%;1H NMR (300 MHz,CDCl3) δ 7.76 (d,J = 6.4 Hz,1H),7.38 (d,J = 8.5 Hz,1H),7.32~7.08 (m,2H),7.02~6.45 (m,4H),5.93 (s,1H),5.53~5.16 (m,2H),3.90 (s,2H),3.76 (s,2H)。
3c:黄色粘稠状液体,产率:79%;1H NMR (300 MHz,CDCl3) δ 7.79 (d,J = 7.0 Hz,1H),7.58~7.11 (m,2H),6.91 (s,1H),6.73 (t,J = 7.5 Hz,1H),6.56 (t,J = 6.5 Hz,1H),6.40~6.24 (m,1H),6.11 (s,1H),5.49~5.25 (m,1H),5.27~5.09 (m,1H),3.88 (s,3H),1.57 (s,1H),-0.00 (s,1H)。
3d:黄色粘稠状液体,产率:78%;1H NMR (300 MHz,CDCl3) δ 8.04 (d,J = 6.9 Hz,1H),7.36 (d,J = 8.8 Hz,1H),7.31~7.14 (m,2H),6.88 (d,J = 8.6 Hz,2H),6.74~6.65 (m,1H),6.60 (d,J = 6.5 Hz,1H),5.93 (d,J = 5.6 Hz,1H),5.83~5.60 (m,1H),5.34~4.96 (m,1H),3.85 (d,J = 14.7 Hz,5H)。
3e:黄色粘稠状液体,产率:48%;1H NMR (300 MHz,CDCl3) δ 7.92 (d,J = 6.7 Hz,1H),7.41 (t,J = 11.8 Hz,2H),7.33~7.09 (m,2H),6.94 (s,1H),6.74 (t,J = 7.3 Hz,1H),6.64 (d,J = 6.4 Hz,1H),5.93 (s,2H),5.28~4.93 (m,1H),3.90 (s,3H)。
3f:黄色粘稠状液体,产率:50%;1H NMR (300 MHz,CDCl3) δ 7.86 (s,1H),7.60 (d,J = 7.1 Hz,1H),7.53~7.32 (m,2H),7.29~7.04 (m,2H),6.94 (s,1H),6.74 (s,1H),6.62 (s,1H),6.14~5.57 (m,2H),5.25~4.80 (m,1H),3.91 (s,2H)。
3g:黄色粘稠状液体,产率:17%;1H NMR (300 MHz,CDCl3) δ 7.86 (s,1H),7.60 (d,J = 7.1 Hz,1H),7.50~7.32 (m,2H),7.33~7.01 (m,2H),6.94 (s,1H),6.74 (s,1H),6.62 (s,1H),6.12~5.61 (m,2H),5.19~4.79 (m,1H),3.91 (s,3H)。
3h:黄色粘稠状液体,产率:66%;1H NMR (300 MHz,CDCl3) δ 7.77 (d,J = 6.8 Hz,1H),7.40 (d,J = 8.8 Hz,1H),7.21 (d,J = 20.7 Hz,4H),6.94 (s,1H),6.74 (t,J = 7.4 Hz,1H),6.59 (d,J = 6.2 Hz,1H),5.98 (t,J = 6.8 Hz,1H),5.56~5.18 (m,2H),3.89 (s,3H)。
3i:黄色粘稠状液体,产率:64%;1H NMR (300 MHz,CDCl3) δ 7.79 (d,J = 6.7 Hz,1H),7.53~7.32 (m,2H),7.26 (s,1H),7.13 (d,J = 8.2 Hz,1H),6.94 (s,1H),6.76 (t,J = 7.1 Hz,1H),6.63 (d,J = 6.4 Hz,1H),5.88 (d,J = 6.5 Hz,1H),5.40 (d,J = 7.0 Hz,2H),3.89 (s,3H)。
3j:黄色粘稠状液体,产率:19%;1H NMR (300 MHz,CDCl3) δ 8.07 (d,J = 5.6 Hz,1H),7.30 (t,J = 10.9 Hz,1H),6.89 (s,1H),6.75~6.43 (m,2H),5.74~5.24 (m,1H),4.90 (d,J = 10.5 Hz,1H),3.84 (d,J = 19.1 Hz,4H),2.57 (s,1H)。
3k:黄色粘稠状液体,产率:36%;1H NMR (300 MHz,CDCl3) δ 8.03 (s,1H),7.34 (d,J = 8.6 Hz,1H),6.89 (s,1H),6.70~6.46 (m,2H),5.34 (s,1H),5.02~4.65 (m,1H),4.22 (s,1H),3.88 (s,3H),2.14 (d,J = 8.0 Hz,1H),1.81 (s,1H),1.21 (s,1H),1.08 (s,1H),0.84 (t,J = 6.9 Hz,3H)。
2 结果与讨论
通过改变2-((叔丁氧基羰基)氧基)(吡啶-2-基)甲基)丙烯酸甲酯1和硝基苯乙烯2上的基团,我们得到了一系列含有不同取代基的中氮茚结构。通过对比各个取代基对产率的影响,我们得出了以下结论。当硝基苯乙烯上的取代基R苯环上为给电子基时,反应产率较高,当取代基R苯环上为吸电子基时,反应产率会有所降低。随着取代基R苯环上取代基吸电子能力的增强,反应产率越来越低。当取代基R苯环上为同一种吸电子基团时,邻位取代对产率的影响更大。当取代基R为呋喃环的时候产率与R为苯环时相当。当取代基R为饱和烷烃基团时,反应产率较差。
