常用实验小鼠感染诺如病毒后外周血免疫指标分析
2019-08-05李晓波王淑菁王莎莎黄宗文贺争鸣岳秉飞赵德明
李晓波,付 瑞,王 吉,王淑菁,李 威,王莎莎,秦 骁,黄宗文,贺争鸣,岳秉飞*,赵德明
(1.中国农业大学动物医学院,北京 100094; 2.中国食品药品检定研究院实验动物资源研究所,北京 102629)
小鼠诺如病毒(murine norovirus, MNV)目前在我国的实验小鼠中有很高的感染率[1-2],小鼠感染MNV后大多无任何临床症状,但病毒可在体内长期存在并通过粪便排毒,污染饲养环境,继而感染其他个体[3],我国的实验动物国家标准目前还不要求对MNV进行检测,因此很多实验用的小鼠均为MNV阳性鼠。研究发现MNV感染129小鼠会致其脾中B细胞含量显著增加[4],129小鼠为免疫功能正常小鼠,表明MNV感染会使正常小鼠免疫功能发生改变。本研究选取国内常用的KM,BALB/c,BALB/c-nu,C57BL/6及NIH等五个品系小鼠,对其感染MNV后外周血中的免疫细胞和细胞因子含量进行检测分析,以评估对小鼠免疫功能的影响。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
五个品系的KM,BALB/c,NIH,C57BL/6及BALB/c-nu小鼠(体重分别为30~32 g,18~20 g,20~22 g,16~18 g及16~18 g),SPF级,雌性,6周龄,每个品系各20只,购自国家啮齿类实验动物种子中心[SCXK(京)2014-0013],动物实验于中国食品药品检定研究院屏障动物实验设施进行[SYXK(京)2017-0013],本实验所用水、鼠料及垫料均经过灭菌处理,并按实验动物的3R原则给予人道关怀,已通过福利伦理审查[IACUC号:中检动(福)第2018(B)020号]。
1.1.2 病毒
小鼠诺如病毒BJ10-2062株(GenBank: KM458057),TCID50为10-4.625/0.1 mL,本实验室分离并保存。
1.2 主要试剂与仪器
FITC anti-mouse CD3、PE anti-mouse CD8a、PerCP/Cy5.5 anti-mouse CD45、APC anti-mouse CD4、APC anti-mouse CD49b、细胞因子检测试剂盒(LEGENDplexTMMulti-Analyte Flow Assay Kit)等均为BioLegend产品;RBC Lysing Solution(10×)购自Bio-Rad。流式细胞仪(美国BD公司,型号LSRII);离心机(德国Hettich公司,型号MIKRO 22R)。
1.3 实验方法
1.3.1 动物分组及病毒的接种
每个品系小鼠分为感染组和对照组,每组各10只,感染组灌胃感染0.2 mL MNV病毒液,对照组灌胃0.2 mL的生理盐水。分别于感染前(第0天)和感染后的第7、14、21、28天从眼周静脉采集抗凝血,动物采血前于密封容器经CO2麻醉5~8 s,每次采集大约200 μL,200 r/min离心10 min,分离血细胞及血浆。
1.3.2 免疫细胞的检测
分离得到的血细胞,加入与血浆等体积的PBS重悬,每流式管中加入100 μL,按照检测组合加入最佳反应量的荧光标记抗体,混匀后室温避光反应20 min,每管加入用去离子水稀释10倍的红细胞裂解液工作液2 mL,混匀后室温避光孵育10 min;1500 r/min离心5 min弃上清,加入PBS洗液(含1% FBS的PBS)2 mL混匀后1500 r/min离心5 min,弃上清,加入500 μL PBS洗液,混匀后及时上机检测,测定总T细胞(CD3+)、CD4+T细胞、CD8+T细胞、总B细胞(CD3-CD19+)、NK细胞(CD3-CD49b+)及NK-T细胞(CD3+CD49b+)占总淋巴细胞(CD45+)的百分比。
1.3.3 细胞因子检测
反应板每孔加100 μL洗液,室温静置1 min,倒弃,拍干,将标准品和待检血浆样品用稀释液1∶2稀释,每孔加50 μL,偶联不同细胞因子捕获抗体的荧光微球,涡旋振荡30 s,每孔加25 μL,封板膜封好,铝箔纸包裹避光,于振荡器500 r/min室温孵育2 h,每孔加200 μL洗液,真空抽滤吸干,洗涤2次。每孔加生物素标记的检测抗体25 μL,封板膜封好,铝箔纸包裹避光,于振荡器500 r/min室温孵育1 h,每孔直接加入25 μL链霉亲和素-藻红素(SA-PE),封板膜封好,铝箔纸包裹避光,于振荡器500 r/min室温孵育30 min。洗板后,每孔加150 μL洗液,振荡器重悬微球1 min,在流式细胞仪读取数据,测定IFN-α、IFN-β、IFN-γ、TNF-α、IL-1β、IL-6、IL-10、IL-12、CCL2、CCL5、CXCL1、CXCL10及GM-CSF等13种细胞因子的含量。
1.3.4 结果分析
(1)感染组和对照组免疫细胞总体均值的比较:比较感染组和对照组感染MNV后第7、14、21、28天的总T细胞、CD4+T细胞、CD8+T细胞、总B细胞、NK细胞及NK-T细胞含量的总体均值。
(2)感染组和对照组细胞因子总体均值比较:比较感染组和对照组感染MNV后第7、14、21、28天的IFN-α、IFN-β、IFN-γ、TNF-α、IL-1β、IL-6、IL-10、IL-12、CCL2、CCL5、CXCL1、CXCL10及GM-CSF共13种细胞因子的总体均值,结果以柱状图来表示。
(3)不同时间点免疫细胞百分比含量变化分析:根据感染MNV后第0、7、14、21、28天各时间点各群细胞的均值和标准差绘制曲线图,分析各免疫细胞的变化趋势。
(4)不同时间点细胞因子含量变化分析:绘制感染MNV后第0、7、14、21、28天五个时间点各细胞因子的含量均值和标准差的曲线图,分析细胞因子含量的变化趋势。
1.4 统计学方法
2 结果
2.1 感染组和对照组免疫细胞含量总体均值比较
KM小鼠感染组总T细胞及CD4+T细胞相比对照组均显著升高(P<0.01),总B细胞相比对照组显著降低(P<0.01),CD4/CD8比值相比对照组显著升高(P<0.05)。CD8+T细胞、NK及NK-T细胞与对照组比差异均无统计学意义。BALB/c小鼠感染组CD8+T细胞相比对照组显著降低(P<0.05),其余指标两组之间差异均无统计学意义。C57小鼠感染组相比对照组CD4+、CD8+T细胞均显著降低(P<0.01,P<0.05),总B细胞显著升高(P<0.05),其余指标差异均无统计学意义。NIH小鼠感染组总T细胞和CD8+T细胞相比对照组均显著升高(P<0.01),总B细胞显著降低(P<0.01),CD4/CD8比值显著降低(P<0.05),其余指标差异均无统计学意义。BALB/c-nu小鼠各群细胞差异均无统计学意义(表1)。
2.2 感染组和对照组细胞因子含量均值比较
KM小鼠感染组CXCL10的含量显著低于对照组(P<0.01),其余细胞因子含量比较无显著统计学差异(图1A);BALB/c小鼠IFN-γ含量感染组显著高于对照组(P<0.01),其余细胞因子含量无显著统计学差异(图1B);BALB/c-nu小鼠CCL2含量感染组显著高于对照组(P<0.05),TNF-α、CXCL1及CXCL10感染组含量均显著高于对照组(P<0.01),而IFN-β含量感染组显著低于对照组(P<0.05),其余细胞因子含量无显著统计学差异(图1C);C57小鼠IL-10含量感染组显著高于对照组(P<0.05),CCL5及GM-CSF含量感染组显著低于对照组(P<0.05),其余细胞因子含量无显著统计学差异(图1D);NIH小鼠各细胞因子含量均无显著统计学差异(图1E)。
注:与对照组相比,*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.
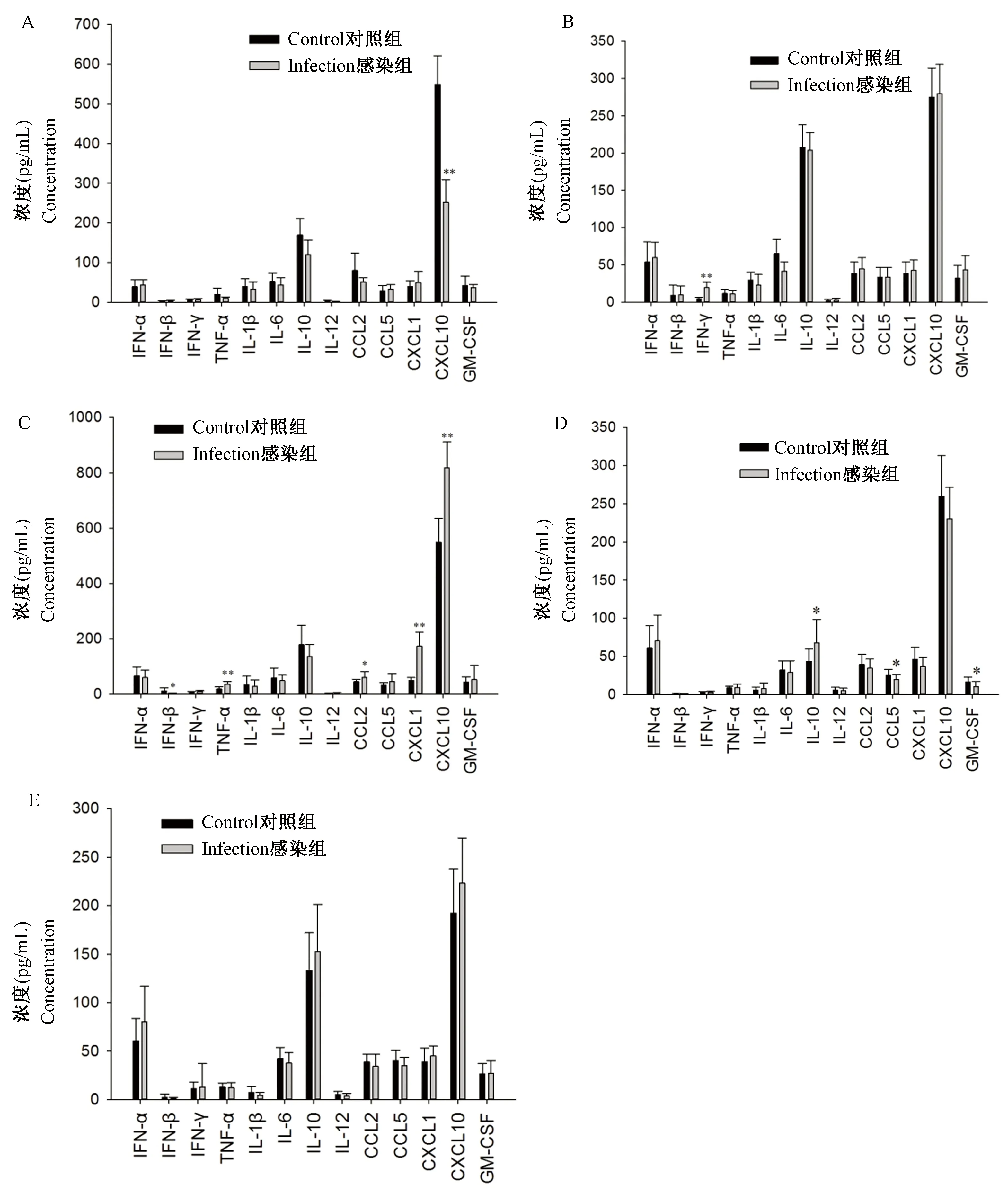
注:A:KM小鼠;B:BALB/c小鼠;C:BALB/c-nu小鼠;D:C57小鼠;E:NIH小鼠。与对照组相比,*P<0.05,**P<0.01。图1 不同品系小鼠感染组和对照组细胞因子含量比较Note. A, KM mice. B, BALB/c mice. C, BALB/c-nu mice. D, C57 mice. E, NIH mice. Compared with the control group, *P<0.05, **P<0.01.Figure 1 Comparison of cytokine levels between the infection and control groups of different mouse strains
2.3 不同时间点免疫细胞百分比含量变化分析
KM小鼠感染组和对照组总T细胞、CD4+T细胞及总B细胞均在感染第7天即已产生差异(P<0.05),感染组相较对照组总T细胞和CD4+T细胞含量升高,总B细胞含量降低,后面的三个时间点差异均比较明显(图2A);BALB/c小鼠CD8+T细胞在第感染第7天感染组和对照组均值一致,在第14、21天感染组均值均明显低于对照组(P<0.05),第28天两组均值无统计学差异(图2B);C57小鼠CD4+T细胞含量感染组均值在第7天即低于对照组(P<0.05),直到第28天差异仍明显。总B细胞虽然第7天和第14天感染组均值均高于对照组,但差值无统计学意义,第21天和第28天两组差异显著(P<0.05)。CD8+T细胞含量在第7,14天均无显著差异,到第21天感染组均值明显低于对照组,第28天差异极显著(P<0.01)(图2C);NIH小鼠总T细胞和CD8+T细胞在第7天两组比较无统计学意义,第14天开始感染组高于对照组(P<0.05),第21天和第28天维持稳定。总B细胞均值第7天两组比较无统计学差异,第14天及第21天感染组低于对照组(P<0.05),第28天两组差异极显著(P<0.01)(图2D)。

注:A:KM小鼠;B:BALB/c小鼠;C:C57小鼠;D:NIH小鼠。图2 不同时间点两组小鼠免疫细胞均值变化曲线比较Note. A, KM mice. B, BALB/c mice. C, C57 mice. D, NIH mice.Figure 2 Comparison of the changes of mean values of immune cell levels in the two groups of mice at different time points
2.4 不同时间点细胞因子含量变化分析
KM小鼠CXCL10含量在感染第7天两组无明显差异,到第14天感染组低于对照组(P<0.05),后面两个时间点维持稳定(图3A);BALB小鼠IFN-γ含量在第7天虽然感染组均值高于对照组,但差异不明显(P>0.05),至第14天差异明显(P<0.05),第21天感染组均值降低,差异仍明显(P<0.05),至第28天两组差异不显著(P>0.05)(图3B);C57小鼠GM-CSF含量第7天两组无明显差异,第14天感染组均值低于对照组,但差异不明显(P>0.05),第21天产生明显差异(P<0.05),第28天感染组均值进一步降低,差异极显著(P<0.01)。CCL5含量第7天两组无明显差异,第14天开始感染组低于对照组(P<0.05),第21、28天差异仍明显。IL-10含量第7天开始感染组高于对照组(P<0.05),一直到第28天两组差异仍明显(图3C);BALB/c-nu小鼠TNF-α含量在第7天感染组即高于对照组(P<0.05),第14、21天差异显著(P<0.01),第28天感染组含量降低,两组差异不明显(P>0.05)。CCL2含量在第7和14天感染组低于对照组(P<0.05),至第21天和28天虽然感染组均值低于对照组,但两者差异不明显(P>0.05)。IFN-β两组含量在第7天开始出现差异(P<0.05),一直持续到第28天差异仍显著(图3D);CXCL10含量在感染第7天两组之间无差异,至第14及21天感染组高于对照组(P<0.05),第28天虽然感染组均值高于对照组,但差异不显著(P>0.05)。感染组CXCL1含量在第7天即高于对照组(P<0.05),后续3个时间点含量维持平稳(图3E)。
3 讨论
目前分离的MNV毒株少数为急性感染株(如MNV-1株),可在感染动物后几天被清除,大多为持续感染株(如MNV-2, MNV-3, MNV-4, CR1,等),可在动物体内长期存在[4-8]。免疫功能健全的小鼠感染MNV无明显临床症状,但病毒可在动物体内长期存在并通过粪便向外排毒,研究发现MNV感染129小鼠会致其脾中B细胞含量显著增加,但所用毒株为急性株,同时仅检测了一个品系的小鼠(129小鼠)[4],而我国普遍感染的是MNV慢性株,本研究所用毒株分离自国内一实验动物使用场所,属慢性株[9-10],所研究品系包括国内常用的KM、BALB/c、BALB/c-nu、C57及NIH小鼠,研究MNV感染对不同品系小鼠免疫功能的影响。之所以选择外周血进行检测,一是由于脾中的所有淋巴细胞均直接来源于血液,一直与血液进行交换,维持着动态平衡[11],外周血中免疫细胞及因子含量变化能较直观的反应动物的免疫状态;二是考虑到外周血可多次采集,对动物损伤较轻,可实现对同一批动物的多次检测,避免不同批动物间的差异;另外采集外周血操作简便,影响结果的因素较少。我们参考相关文献[12-13]分别于MNV感染前(第0天)及感染后的第7、14、21、28天采集外周血,同时设立同样数量的对照组,对这5个时间点两组动物的免疫细胞及细胞因子含量进行检测,一是比较两组各指标在即感染MNV后4个时间点总体均值的差异,二是绘制每个时间点(包括第0天)的均值变化曲线,分析各指标含量的变化趋势。
免疫系统通过固有免疫以及特异性免疫发挥作用,特异性免疫又包括T细胞介导的细胞免疫和B细胞介导的体液免疫。CD3+作为成熟T淋巴细胞表面标志,其数量可间接反映机体的免疫功能水平[14],T淋巴细胞进一步分为CD4+和CD8+细胞, CD4+T淋巴细胞可辅助T淋巴细胞转变为效应细胞,并促进B淋巴细胞转化为浆细胞及活化巨噬细胞,CD8+T淋巴细胞具有杀伤靶细胞的功能,CD4+和CD8+T淋巴细胞含量及CD4+/ CD8+比值平衡是维持机体免疫功能的关键[15]。B淋巴细胞在脾中分化成浆细胞,产生抗体,发挥体液免疫作用,CD19是B细胞表面的主要标志。NK和NK-T细胞均属于固有免疫细胞,NK细胞杀伤活性无MHC 限制,不依赖抗体,主要分布于外周血中,NK-T细胞既有T细胞受体,又有NK细胞受体,可通过分泌大量细胞因子发挥免疫调节作用,活化后具有NK细胞的细胞杀伤活性。本研究选择检测外周血中CD3+T细胞、CD4+T细胞、CD8+T细胞、总B细胞(CD3-CD19+)、NK细胞(CD3-CD49b+)及NK-T细胞(CD3+CD49b+)百分比含量来评价MNV感染对小鼠固有免疫和特异性免疫的影响。细胞因子根据功能不同可分为干扰素(IFN)、白细胞介素(IL)、肿瘤坏死因子(TNF)、集落刺激因子(CSF)及趋化因子等。干扰素根据其来源和结构不同可分为INF-α、INF-β和IFN-γ,分别由白细胞、成纤维细胞和活化T细胞产生,IFN-γ主要由I型辅助性T细胞(Th1)产生,具有抗病毒、免疫调节及抗肿瘤等特性,多个研究表明,IFN是体内外抑制MNV复制所必须的[4,12,16-18];白细胞介素由淋巴细胞、单核细胞或其他非单个核细胞产生,其中IL-1β在免疫应答和组织修复中起作用,主要由单核细胞和巨噬细胞产生,能刺激集落刺激因子、血小板生长因子等的生成和促使T细胞产生IL-2。II型辅助T细胞(Th2)主要产生IL-6、IL-10,起辅助体液免疫作用[19],IL-12由抗原提呈细胞和B细胞产生,能诱导IFN-γ产生;肿瘤坏死因子根据其来源和结构不同,可分为TNF-α和TNF-β两类,前者由活化的巨噬细胞和T淋巴细胞产生,参与免疫应答和炎症反应[20-21],可促进巨噬细胞和淋巴细胞活化,并对中性粒细胞有较强的活化和趋化作用[22];根据集落刺激因子的作用范围,可将其分为粒细胞CSF(G-CSF),巨噬细胞CSF(M-CSF),粒细胞、巨噬细胞CSF(GM-CSF)和多能集落刺激因子。它们可促进不同发育阶段的造血干细胞增殖和分化;趋化因子在炎症反应中具有重要作用,可分为C、CC、CXC和CX3C等4个亚族,大多属CC和CXC两族[23],前者趋化单核细胞,包括CCL2(MCP-1)、CCL5(RANTES)、MCP-2及MCP-3等,后者趋化中性粒细胞,包括CXCL1(KC)、CXCL10(IP-10)等。本研究选择INF-α、INF-β、IFN-γ、TNF-α、IL-1β、IL-6、IL-10、 IL-12、CCL2、CCL5、CXCL1、 CXCL10和GM-CSF等13种细胞因子进行检测,以期较全面评估MNV感染小鼠后各免疫细胞发挥作用的情况。
正常小鼠外周血淋巴细胞及细胞因子含量受各种因素的影响,目前还没有统一的权威数据,本研究对照组小鼠各免疫指标所测得数据均与已有报道一致[11,15,19,21]。结果显示KM小鼠感染组CD3+T细胞及CD4+T细胞含量均显著高于对照组(P值均小于0.01),CD4+/ CD8+比值感染组显著高于对照组(P=0.048);B细胞含量则显著低于对照组(P值小于0.01),趋化因子CXCL10含量感染组低于对照组(P<0.01),其他两组之间没有统计学差异,说明MNV感染会引起KM小鼠细胞免疫应答活跃来发挥抗病毒作用,B细胞比例降低可能是由于T淋巴细胞含量增加所致。BALB/c小鼠CD8+T细胞感染组低于对照组(P值小于0.05),CD4+/ CD8+比值及其他细胞差异不明显,结合其IFN-γ含量感染组高于对照组(P<0.05),推测BALB/c小鼠主要通过活化的辅助T细胞来抗MNV感染。与KM小鼠相反,C57小鼠感染组相比对照组CD4+T细胞(P<0.05)和CD8+T细胞(P<0.01)含量均明显降低,B细胞含量则显著升高(P<0.05),同时IL-10含量增加(P<0.05),IL-10可抑制单核巨噬细胞产生促炎性活性分子,并抑制T细胞参与细胞免疫应答,其高表达与免疫细胞的抑制高度有关[24],另外感染组CCL5及GM-CSF含量均显著低于对照组(P<0.05),推测MNV的感染可能会增强C57小鼠的体液免疫应答,同时会抑制单核细胞的活性,抑制细胞免疫应答。NIH小鼠感染组总T细胞及CD8+T细胞含量显著高于对照组(P值均小于0.01),CD4+T细胞两组之间差异无统计学意义,CD4+/ CD8+比值显著低于对照组(P<0.05),B细胞含量显著降低(P<0.01),而各细胞因子两组间均无统计学差异,表明NIH小鼠可能主要通过细胞毒性T细胞(Tc)杀伤活性来抗MNV感染。BALB/c-nu小鼠为T细胞免疫缺陷小鼠,其感染组和对照组各免疫细胞含量均无显著差异,而感染组相比对照组TNF-α、CCL2、 CXCL1、CXCL10含量均显著升高(P<0.01),推测BALB/c-nu小鼠主要通过活化巨噬细胞,分泌细胞因子趋化并激活单核细胞及中性粒细胞来发挥抗MNV效应,INF-β含量降低(P<0.05),可能是MNV持续感染株抑制IFN-β的释放所致[25]。各品系小鼠NK及NK-T细胞的含量均无统计学差异,表明NK或NK-T细胞在抗MNV感染中未发挥明显作用。上述结果表明MNV感染对不同品系小鼠免疫指标的影响各不相同,有的指标变化甚至相反,如KM小鼠CD4细胞升高而C57小鼠降低,有的则没有变化,如BALB/c-nu小鼠各免疫细胞含量两组间均无显著差异,有报道MNV感染会加剧Mdr1a-/-小鼠炎症性肠病模型的疾病进程,而对Smad3缺陷小鼠炎症性肠病模型则无影响[26],这可能与MNV对不同小鼠免疫系统影响不同有较大关系。尽管MNV感染对小鼠免疫指标有明显影响,所有小鼠从实验开始到结束均未观察到临床症状,体重变化也无差异(数据未显示),但多个研究发现MNV感染会导致小鼠肝、脾、肺及肠道等组织病理学病变,肝会出现炎性细胞病灶,脾会发生红髓增生,白髓活化,严重的坏死或纤维化[26],这可能与其引起的免疫应答有关。
对总体均值有差异的各指标绘制各时间点的变化曲线,分析发现不同品系小鼠在感染MNV后各免疫指标随时间变化的规律有所不同,KM小鼠在感染第7天两组均值即产生显著差异,一直持续到第28天差异仍显著,说明KM小鼠免疫系统对MNV感染应答较快且更持久。BALB/c及BALB/c-nu小鼠各指标大多在第7天无显著差异,第14,21天均有显著差异,至第28天感染组均值恢复正常,两组差异不显著,此时动物体内仍存在病毒(数据未显示),表明这两个品系小鼠对MNV感染的免疫应答持续时间较短,推测MNV更易在这两个品系形成潜伏感染。C57和NIH小鼠各免疫指标大多在感染MNV第14天才出现显著差异,直到第28天差异仍显著,我们没有进行更长时间的比较,推测两组均值的差异仍可维持一段时间。总体来说,MNV感染对BALB/c及BALB/c-nu小鼠免疫功能影响时间较短,对KM、C57及NIH小鼠影响时间相对较久。
机体的免疫系统非常复杂,要更全面的了解MNV感染对动物免疫功能的影响,还需进一步的研究。由于实验条件的限制,本研究未进行MNV急性株的比较分析,需要进行后续实验研究补充。总之,本研究的结果表明MNV的感染会对常用小鼠的免疫功能造成一定的影响,而且不同品系的动物影响也不同,建议在进行免疫相关的动物实验如药效评价、疫苗评价时选择MNV阴性小鼠,以避免实验结果出现偏差。
