老年和青年C57BL/6J小鼠外周血及免疫细胞分型测定分析
2019-08-05管博文卢延华苏路路王玉全李德冠孟爱民
管博文,卢延华,苏路路,王玉全,李德冠,孟爱民*
(1.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021; 2.中国医学科学院/北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室,天津 300192)
据联合国经济和社会事务部人口司调查统计,随着医疗水平的提高,预计2050年全球总人口达到98亿,其中老龄人口约占31亿。中国人口老龄化进程与全球人口老龄化趋势一致,老龄化已经成为社会发展中不可忽视的影响因素。1969年,病理学家Wolford在文章中提出免疫衰老,免疫系统参与正常脊柱动物的老化,并调节老化过程[1-3]。因此免疫衰老是机体衰老的重要组成部分,免疫系统的衰老会导致老年个体更易感染、罹患肿瘤以及对疫苗的应答下降[4]。本文就从免疫器官和外周血免疫分型等方面比较老年小鼠与年轻小鼠存在的差异,旨在为免疫衰老相关研究提供基础数据。
1 材料和方法
1.1 实验动物
老年小鼠:8只19月龄的SPF级C57BL/6J雄性小鼠,体重28~38 g,购于北京华阜康生物科技股份有限公司[SCXK(京)2014-0004],年轻小鼠:8只8周龄的SPF级C57BL/6J雄性小鼠,体重19~22 g,购于北京华阜康生物科技股份有限公司[SCXK(京)2014-0004]。老年与年轻小鼠均饲养于中国医学科学院医学实验动物研究所动物房屏障环境[SYXK(京)2015-0035],温度为20℃~26℃,相对湿度为40%~70%,压差大于10 Pa,照明强度为15~20 lx,每12 h昼夜交替一次。本实验经过中国医学科学院医学实验动物研究所IACUC的批准,批准号为MAM17002。并根据3R原则对实验动物的使用和饲养给予人道关怀。
1.2 主要试剂与仪器
荧光标记抗体NK1.1-FITC购于Biolegend;CD11b-APC购于Invitrogen;B220-percp、F4/80-PE、CD4-PE-cy7、CD8a-APC-cy7等购于BD公司;EDTA-K3购于Sigma公司;红细胞裂解液购于Invitrogen公司。外周血计数及分类由全自动血液分析仪PentraDX120(ABX)分析;血细胞免疫分型应用BD流式分析仪(BD FACSAria II cell sorter)。
1.3 实验方法
1.3.1 外周血细胞计数及分类
将小鼠称重,0.5%戊巴比妥钠腹腔注射麻醉(50 mg/kg)。进行内眦静脉取血,EDTA-K3 抗凝,血细胞计数仪测定白细胞数、红细胞数、血小板、血红蛋白含量、中性粒细胞和淋巴细胞百分比[5]。取血后脱颈安乐死。
1.3.2 免疫脏器指数
小鼠安乐死后,取胸腺和脾分别称重,计算胸腺系数和脾系数。胸腺指数=胸腺重量(mg)/小鼠体重(g),脾指数=脾重量(mg)/小鼠体重(g)[6-7]。
1.3.3 外周血免疫分型检测
每个血样取50 μL,加入1 mL 1×红细胞裂解液,室温条件下裂解8 min(期间混匀两次),1500 r/min离心5 min,4℃。弃上清,保持每个样本100 μL体系,加入外周血混合抗体4.5 μL,冰上避光孵育30 min。2 mL PBS洗一遍,离心条件不变。加入300 μL PBS过滤到流式管中,上机检测[8]。
1.4 统计学方法
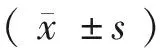
2 结果
2.1 外周血计数及分类
外周血分析结果如表1所示,老年小鼠RBC和PLT相对于年轻小鼠有明显增高,具有显著性差异(P<0.05,P<0.01),其中血小板升高接近30%。相对于年轻小鼠,老年小鼠的NE%升高了14.5%,LY%下降了15.63%,均具有极显著差异(P<0.001)。WBC和HGB没有显著性变化。提示老年小鼠出现血小板升高,白细胞分化偏移。
2.2 免疫脏器指数
与年轻小鼠相比,老年小鼠胸腺重量降低,脾重量增加。胸腺指数降低,与年轻小鼠差异有显著性(P<0.001),脾指数差异无显著性(见图1)。
2.3 外周血免疫分型
流式分析外周血免疫细胞分型测定如图2所示。主要检测辅助T细胞(CD4)、细胞毒T细胞(CD8a)、B淋巴细胞(B220)、自然杀伤细胞(NK1.1),单核细胞采用F4/80和CD11b共标。其中辅助T细胞、细胞毒T细胞和浆细胞是从单个核细胞亚群去分析,NK细胞和单核细胞是从白细胞群去分析(图2)。结果显示相对于年轻小鼠,老年组CD4细胞百分比明显降低[分别为(20.14 ± 3.89)%,(10.80 ± 3.04)%],差异具有极显著性(P<0.001),见图3A。其他类型的免疫细胞未见明显差异,见图3B~3E。
3 讨论
本文检测老年和年轻小鼠外周血计数及免疫细胞分型,结果显示老年小鼠外周血血小板有明显的升高,中性粒细胞和淋巴细胞的比例出现了偏移。老年小鼠胸腺指数下降。外周血免疫细胞分型中CD4细胞比例明显降低。
实验结果显示,从脏器总体来看相对于年轻小鼠,老年小鼠有很多器官衰老,在免疫方面产生缺陷,出现胸腺萎缩,CD4/CD8比值下降等现象。与人进入老年以后状态相似,免疫力下降,易患各种疾病。从器官水平看,老年小鼠的胸腺指数比年轻小鼠的胸腺指数有明显下降,呈现显著性差异。理论上随着年龄的增大,记忆T细胞池在增加,但是体内的T细胞总量会被维持在一定量,并且胸腺的衰老萎缩也导致幼稚T细胞数量的减少。老年人和老龄化小鼠的免疫系统减弱的变化趋势是一致的[9]。
临床上老年人的造血系统出现髓系细胞比例升高、淋系细胞比例降低的分化偏移的现象,与老年人免疫力降低、髓系肿瘤高发有关[10]。本次检测发现老年小鼠外周血的NE%升高,LY%下降,与人类老龄化改变类似。林帅等研究也显示类似的结果,相比于成年小鼠,12月龄的老年小鼠NE%升高,LY%下降[8]。出现髓系分化偏移的现象,本质上是造血干细胞的衰老导致细胞周期失调,并且不受控制的向髓系细胞分化。造血干细胞衰老则是细胞从静止稳态进入不受调控的分裂分化状态,使NE%升高,LY%下降,破坏血液中免疫细胞比例的平衡,降低免疫力[11]。
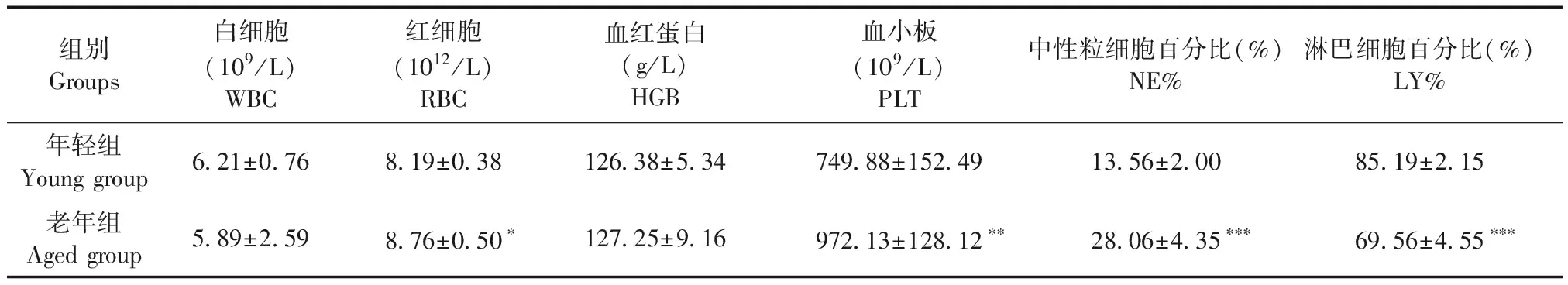
表1 老年小鼠与年轻小鼠外周血计数比较(n=8)
注:与年轻小鼠相比,*P<0.05,**P<0.01,***P<0.001。
Note. Compared with the young mice,*P<0.05,**P<0.01,***P<0.001.
注:A:胸腺指数;B:脾指数。与年轻小鼠相比,***P<0.001。图1 老年小鼠与年轻小鼠脏器指数比较Note. A, Thymus index. B, Spleen index. Compared with young mice,***P<0.001.Figure 1 Comparison of organ indexes between the aged and young mice

图2 流式细胞仪分析时门的设置及典型图Figure 2 Representative gating strategy for peripheral blood immune cell phenotypes analyzed by flow cytometry

注:A:CD4+;B:CD8+;C:B220+;D:NK1.1+;E:CD11b+F4/80+。与年轻小鼠相比,***P<0.001。图3 老年小鼠与年轻小鼠外周血免疫细胞分型比较Note. A, CD4+. B, CD8+. C, B220+. D, NK1.1+. E, CD11b+F4/80+. Compared with the young mice,***P<0.001.Figure 3 Comparison of peripheral blood immune cell typing between the aged and young mice
相较于年轻人,健康男性老年人红细胞、血红蛋白和血小板倾向于降低,出现老年人贫血现象[10, 12-13]。C57小鼠外周血血小板计数比人类的要高,本次检测老年鼠血小板有升高趋势,与健康老年人的变化趋势有一定的差异。提示老年小鼠在血小板数量和功能的代偿方面可能与老年人有一定的差异。Simon等人的研究也显示,血小板会在炎症感染和大量出血等应激情况下,直接从造血干细胞分化成血小板,提示老年小鼠可能处于慢性炎症状态,炎症状态促使造血干细胞不断的向巨核细胞分化,最终导致血小板的升高[14]。外周血细胞检测中出现血小板有明显上升,三系血细胞同时增多,暗示老年小鼠可能患有老年真性红细胞增多症(polycythemia vera,PV)[15-16],有潜在成为PV动物模型的可能。但是这点与人外周血计数规律并不一致,相较于年轻人,健康男性老年人红细胞、血红蛋白和血小板倾向于降低[10, 12-13]。
外周血免疫细胞分型检测显示CD4淋巴细胞的比例下降,CD8不变,导致CD4/CD8比例下降。林帅等文献中除CD4有显著下降外,NK1.1和CD11b有明显的上升并有显著性差异[8]。CD4/CD8比例下降暗示老年小鼠免疫系统功能下降,与临床上老年人CD4细胞的减少,免疫力低下相似。小鼠月龄的增加导致胸腺的萎缩,是免疫衰老的直接原因[18],CD4细胞的减少CD4+/CD8+比值的下降与老年人细胞亚群失调的情况一致[2]。
随着年龄增长,免疫系统出现衰老性改变。这些改变过程非常复杂,主要包括以下几个方面:(1)免疫细胞;(2)淋巴器官和非淋巴组织中的微环境(免疫细胞驻留的组织);(3)与免疫细胞及其微环境相互作用的循环因子,包括趋化因子、细胞因子和其他可溶性分子[19-20]。从1969年免疫衰老概念的提出,免疫衰老研究取得了很大的进展,不仅观察到不同免疫细胞数量和比例的改变,还注意探讨不同亚型免疫细胞功能变化以及免疫细胞与微环境及系统环境相互作用方式的变化[21]。这些改变作为免疫衰老,甚至作为全身衰老生物学标记方面也取得了进展[22]。这些深入研究对阐明衰老机制、探讨干预老年人免疫功能衰老的靶点和策略、改善老年人生活质量具有重要意义[23]。
本文对老年小鼠外周血和免疫器官指数进行了测定并与人类老龄化改变进行了初步比较分析。作为研究衰老及老龄化疾病的重要模型小鼠,研究结果将为免疫衰老相关研究提供基础数据。
