急性运动对大鼠心肌miRNA-30a表达的影响
2019-08-05王智强王蕴红
杨 赟,王智强,王蕴红
(1.首都体育学院 研究生部,北京 100191; 2.首都体育学院 运动科学与健康学院,北京 100191)
miRNAs是内源性非编码单链RNA,它通过降解目的mRNA 或抑制其翻译,调节目的基因表达,进而影响细胞的功能[1]。研究显示,miRNAs参与了心脏发育、血管生成、心肌肥大、心力衰竭、再灌注损伤等生理病理过程的调节,且可能是关键性的调控因子之一[2-3]。 miRNA-30是miRNAs中的一种,包含miRNA-30a、b、c、d、e。在心肌组织中miRNA-30a有较高表达[4],它对自噬相关基因的表达起重要的调控作用。有研究表明,IncRNA AK088388是长链非编码RNA的一种,它作为内源性RNA能够通过竞争性结合miRNA-30a提高Beclin-1和LC3的表达,进而调控心肌细胞自噬水平[5]。也有研究表明当miRNA-30a表达升高时,Beclin-1 mRNA表达受到抑制。进一步研究发现,在AngⅡ诱导的心肌肥大模型中,miRNA-30a的表达受到抑制,而Beclin-1 mRNA表达提高,自噬加强[6]。提示在心肌存在着AngⅡ对miRNA-30a表达的调控,进而对心肌自噬产生调控的机制。而在运动模型的研究中发现,运动应激也可诱发心肌AngⅡ表达升高[7]和心肌自噬水平的变化。因此我们推测,在急性运动中,伴随运动心肌的适应性变化,运动心肌miRNA-30a的表达也可能发生变化,且可能通过AngII对miRNA-30a的作用,影响心肌的自噬过程。所以我们通过建立大鼠一次急性运动模型,测定急性运动后不同时间心肌miRNA-30a以及自噬相关指标的表达变化,探讨在急性运动应激状态下运动心肌miRNA-30a的表达规律及其对自噬的调控机制,为进一步研究运动应激对该信号通路的调控作用进行初步探究。
1 材料和方法
1.1 实验动物
8周龄雄性SPF级SD大鼠24只,体重240~270 g,由维通利华实验动物技术有限公司提供[SCXK(京)2016-0011]。所有大鼠在北京体育大学动物房内饲养和训练[SYXK(京)2016-0033],所有大鼠自由饮食,室温为(22±20℃,空气湿度为45%~55%,昼夜明暗交替时间12 h,分笼饲养,每笼5只。本研究所有操作均符合实验动物伦理学要求(伦理审批号:IACUC2016033),并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
miRNA-30a-3p和miRNA-30a-5p引物试剂盒由Thermo Fisher提供,试剂和引物货号如下:MirVanaTMRNA抽提试剂盒,REF:AM1556、TaqManTMMicroRNA 反转录试剂盒,REF:4366596(has-miR-30a-3p,Assay ID:000416、has-miR-30a-5p,Assay ID:000417、U6 snRNA,Assay ID;001973)、TaqManTMUniversal Master Mix II预混液,REF: 4440038、SuperScriptTMIII第一链合成系统,REF:18080051、SYBRTMSelect Master Mix预混液,REF:4472908。
六跑道动物实验跑台(ZS-PT-Ⅲ型,中国);梯度PCR仪(Mastercycler Nexus,德国Eppendorf);实时荧光定量PCR系统(7500Fast,美国ABI)。
1.3 实验方法
1.3.1 模型制备
所有大鼠适应性饲养7 d后随机分为安静对照组(Con),运动后0 h组(E0),运动后3 h组(E3)和运动后12 h组(E12),每组6只。急性运动方案:跑台坡度为16°,速度16 m/min,运动时间为1 h。运动组运动后按时间点取材,安静组同时取材。左心室肌组织用预冷的DEPC水处理后投入液氮速冻,-80℃保存。
1.3.2 实时荧光定量聚合酶链反应
Ambion试剂盒抽提心肌细胞总RNA,通过Bulge-LoopTM RT Primer反转录,采用TaqMan荧光探针法进行qRT-PCR检测miRNA-30a-3p、miRNA-30a-5p,U6 为内参照。20 μL反应体系包括:2× PCR mix10 μL、20×引物1 μL、cDNA 1.5 μL和7.5 μL DEPC水。实时定量反应:预变性50℃ 2min,95℃ 10 min。95℃ 15 s,60℃ 60 s,45个循环。常规Trizol方法抽提心肌细胞总RNA,通Bulge-LoopTM RT Primer反转录,采用 SYBR Green 进行常规qRT-PCR,检测心肌血管转化酶(ACE)、Beclin-1和LC3,GAPDH为内参照,各引物序列见表1。反应体系包括2× SYBR 6 μL、Rox 0.2 μL、cDNA 1.5 μL、10μmol/L P1+P2 1 μL、DEPC水6 μL。反应参数:95℃ 30 s,95℃ 3 s、60℃ 30 s,45个循环,95℃ 15 s,60℃ 60 s,95℃ 15 s。实验重复三次,3p、5p、U6、Beclin-1、LC3和GAPDH产物倍数按2-ΔΔCt计算。

表1 引物和内参序列
1.4 统计学方法
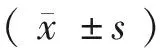
2 结果
2.1 运动后不同时间大鼠心肌miR-30a表达
与安静对照组相比,运动后0 h组心肌miRNA-30a-3p和miRNA-30a-5p表达都显著性增高(P<0.05),运动后3 h组和12 h组与安静组相比没有显著性差异(见图1)。

注:与对照组相比,*P<0.05。图1 运动后大鼠心肌miRNA-30a表达Note. Compared with the control group, *P<0.05.Figure 1 Post-exercise myocardial miRNA-30a-3p and miRNA-30a-5p expression in the rats
2.2 运动后不同时间大鼠心肌ACE mRNA表达
与安静对照组相比,运动后0 h组心肌ACE mRNA表达显著性增高(P<0.05),运动后3 h组和12 h组与安静组相比没有显著性差异(见图2)。

注:与对照组相比,*P<0.05。图2 运动后大鼠心肌ACE mRNA表达Note. Compared with the control group, *P<0.05.Figure 2 Post-exercise myocardial ACE mRNA expression in the rats
2.3 运动后不同时间大鼠心肌Beclin-1 mRNA的表达
与安静对照组相比,运动后0 h组心肌Beclin-1 mRNA的表达显著性提高(P<0.05),在运动后3 h逐渐恢复到安静状态(见图3)。

注:与对照组相比,*P<0.05。图3 运动后不同时间大鼠心肌Beclin-1 mRNA表达Note. Compared with the control group, *P<0.05.Figure 3 Post-exercise myocardial Beclin-1 mRNA expression in the rats
2.4 运动后不同时间大鼠心肌LC3 mRNA的表达
与安静对照组相比,运动后0 h组心肌LC3 mRNA的表达均显著性提高(P<0.05),在运动后3 h逐渐恢复到安静状态(见图4)。

注:与对照组相比,*P<0.05。图4 运动后大鼠心肌LC3 mRNA的表达Note. Compared with the control group, *P<0.05.Figure 4 Post-exercise myocardial LC3 mRNA expression in the rats
3 讨论
成熟的心肌细胞是终末分化的细胞,因此,其细胞器和蛋白质质量的维持,对实现心肌细胞的正常功能起重要的作用。自噬是细胞溶酶体降解受损、衰老细胞器和蛋白质等内源性底物的重要过程。在心肌重塑过程中,适宜的自噬是对刺激因素适应和自我保护的反应,但过度自噬则可能导致心肌细胞凋亡[8]。
研究显示,血管紧张素Ⅱ(AngⅡ)参与了心肌重塑过程,而用黄芪多糖可有效抑制血管紧张素II诱导的心肌细胞肥大[9]。在血管紧张素Ⅱ诱导的心肌肥厚模型中,Beclin-1和LC3在基因和蛋白水平表达均明显提高,并且当Beclin-1 mRNA过度表达时,与心肌肥厚有关基因表达也增强;而缄默Beclin-1基因,则引起与心肌肥厚有关基因表达下调,提示血管紧张素Ⅱ参与了Beclin-1 mRNA 表达的调控过程[6]。在大鼠急性力竭运动模型中发现运动后心肌局部AngII的含量降低了43%,血浆AngII的含量增加了83%[10]。也有研究发现,长期游泳训练造成的心肌肥大大鼠,心肌局部AngII含量显著升高[7]。提示运动诱发心肌AngII释放可能与心肌Beclin-1 mRNA 表达升高有密切关系。本研究进一步显示,急性运动后心肌ACE mRNA显著性升高,由于ACE是血管紧张素转化酶,编码的蛋白可以将血管紧张素I转化为具有调节血管张力和血管平滑肌增生的血管紧张素II[11]。推测运动后心肌ACE mRNA表达升高与运动心肌AngII的更新变化有关。
已有研究表明,急性运动也可提高心肌自噬水平,使Beclin-1和LC3蛋白表达升高[12]。本研究发现,一次力竭运动后即刻心肌Beclin-1 mRNA和LC3 mRNA的表达显著升高,进一步表明急性运动可以促进心肌自噬相关基因表达提高,导致了Beclin-1和LC3 II蛋白表达的提高。
miRNA-30a由Drosha和Dicer两种RNA酶加工形成。Drosha酶将原始长链转录本加工成含有60-70个碱基的颈环结构前体(包括相反的两个臂“-3p”和“-5p”)然后由Dicer酶将其剪切为成熟的miRNAs[13-14]。由于Beclin-1是miRNA-30a的靶基因,miRNA-30a可以与Beclin-1的3’UTR结合来调控该基因[13]。miRNA-30a拟似剂处理心肌细胞后, Beclin-1 mRNA的表达下调,而用miRNA-30a抑制剂处理时,Beclin-1 mRNA表达上调。进一步研究发现,心肌细胞转入miRNA-30a抑制剂损害miRNA-30a的功能时,能够引起心肌肥厚相关的基因表达上调[7],这些结果提示, miRNA-30a介导了Ang II诱导的心肌肥厚和自噬的过程。为此,我们测定了运动心肌miR-30a “-3p”和“-5p”表达的变化。结果进一步显示,运动应激也能够诱发miRNA-30a、Beclin-1 mRNA和LC3 mRNA表达,同时诱发ACE mRNA 表达的同步升高,提示在运动心肌中,Ang II 对Beclin-1 mRNA和LC3 mRNA表达发挥调控作用。在急性运动中能够同时诱发正、负调控自噬相关基因的表达提高,而且这种暂时转录水平的升高只发生在运动后即刻,而我们和其他研究者研究显示,急性运动可引起Beclin-1蛋白表达的升高,提示这种运动应激引起miRNA-30a表达的升高,对于翻译水平的调控不起决定性的作用。
综上所述,本实验结果表明急性运动应激可以一过性的提高心肌ACE mRNA、miRNA-30a、Beclin-1 mRNA和LC3 mRNA表达,推测运动应激诱发miRNA-30a 对心肌Beclin-1 mRNA表达的调控作用可能是一过性的,具体调控情况还需要通过药物干预或基因阻断模型进一步证实。
