动物源性食品中地西泮残留量的检测方法研究
2019-08-05丁宇琦朱价梁晶晶罗金文
丁宇琦,朱价,梁晶晶,罗金文
(浙江省食品药品检验研究院,浙江杭州310052)
地西泮(Diazepam)是一种镇静剂类药物,其分子式为C16H13ClN2O,分子量为284.07,结构如图1所示。
地西泮对中枢神经系统有一定的抑制作用,有助于缓解抑郁和焦虑[1-2]。在临床上,地西泮主要用于治疗焦虑、失眠、癫痫、惊厥、偏头痛等症状[3-4]。对改善病人的睡眠,对抗焦虑,解除烦躁,起重要作用[5]。 但在发挥治疗作用的同时,也表现出种种不良反应,例如嗜睡、头痛、乏力等,特别是连续使用容易成瘾[6-7]。随着包括地西泮在内的镇静剂类药物在临床上的广泛应用,其间接的毒副作用越来越引起重视[8]。 农业部235号公告的附件《动物性食品中兽药最高残留量》中明确规定地西泮等镇静剂类药物只能用于治疗,不得在动物性食品中检出。2011年的“瘦肉精事件”后,卫生部于当年4月发布了食品中可能违法添加的非食用物质名单,其中就包括安定(即地西泮)药物。因此,建立快速高效检测食品中地西泮残留量的方法具有重要意义。

图1 地西泮的结构Fig.1 Structure of Diazepam
目前,检测地西泮的方法主要有酶联免疫吸附法(ELISA)[9]、气相色谱质谱法(GC-MS)[10]、高效液相色谱法(HPLC)[11-12]以及液相色谱串联质谱法(LC-MS/MS)[13-15]等。ELISA法灵敏度低,已不适合目前对食品中地西泮残留量的分析要求,逐渐被HPLC、GC-MS和LC-MS/MS法取代。我国现行标准对3种方法都有涉及,但不同标准的前处理方法并不相同,不利于实验室的仪器比对。因此,本研究开发了一种新型前处理方法,将处理液同时供3种仪器进行检测,对比3种方法的灵敏度、准确性、重复性等,有效避免了不同前处理方法对结果的影响,可用于食品中地西泮残留量的快速、有效检测。
1 实验部分
1.1 仪器设备和试剂
Agilent1260高效液相色谱仪(配二极管阵列检测器);Agilent6460液相色谱串联质谱仪;Agilent7000C气相色谱质谱仪;乙腈、甲醇、异丙醇(色谱纯,Merk公司);正己烷(色谱纯,Tedia公司);无水硫酸钠、乙酸铵(国药集团化学试剂有限公司);试验用水为Milli-Q超纯水。标准物质:地西泮(纯度99.8%,中国药品生物制品检定所)。
地西泮标准溶液的配制:准确称取10.0 mg地西泮标准品于10.0 mL容量瓶中,用甲醇溶解定容后,混合均匀,—18℃冷冻储存,溶液可以完好保存6个月。准确吸取100.0 μL地西泮标准储备液于100.0 mL容量瓶中,用甲醇定容,得到地西泮标准中 间 溶 液 。 分 别 吸 取 50.0,100.0,200.0,400.0,800.0 μL地西泮标准中间溶液于10.0 mL容量瓶中,用甲醇定容,得到LC-MS/MS和GC-MS的标准系列溶液;分别吸取 1.0,2.0,4.0,8.0 mL 的地西泮标准中间溶液于10.0 mL容量瓶中,用甲醇定容,得到HPLC的标准系列溶液。
1.2 色谱条件
HPLC法:色谱柱为SunFire C18柱(250 mm×4.6 mm,5 μm,Waters公司);柱温 30℃;进样量30 μL;流动相为 0.02 mol·L-1乙酸铵水溶液:乙腈(40:60,体积比);流速 1.0 mL·min-1;检测波长为230 nm。
LC-MS/MS法:色谱柱为Accucore C18柱(150 mm×2.1 mm,2.6 μm,Thermo公司);柱温35 ℃;进样量 20 μL;流动相为 0.01 mol·L-1甲酸铵水溶液(A)和甲醇(B),梯度洗脱步骤为0.0~2.0 min,70%A+30%B;2.0~9.0 min,40%A+60%B;9.0~15.0min,35%A+65%B;15.0 ~ 20.0 min,70%A+30%B;流速0.2 mL·min-1;电喷雾离子源(ESI);正离子多反应监测(MRM)模式;源电压4 000 V;毛细管温度400℃;鞘气流速11 L·min-1。
GC-MS法:色谱柱为DB-5MS柱(30 mm×0.25 mm,0.25 μm,Agilent公司);载气为氦气;载气流速0.9 mL·min-1;进样口温度290℃;程序升温步骤为初始温度150℃,保持1 min后以10℃·min-1程序升温至290℃,保持4 min;进样量1 μL,恒流模式,不分流;电子轰击离子源(EI);电子轰击能70 eV;离子源温度230℃;四级杆温度150℃;溶剂延迟9 min。
LC-MS/MS法的监测离子及碰撞能量、GCMS法的监测离子见表1。
1.3 样品前处理
准确称取2.00 g均质粉碎后的试样(精确到0.01 g),加无水硫酸钠5 g和20.0 mL乙腈,摇匀后超声提取 15 min,4 000 r·min-1离心 5 min,取上清液于鸡心瓶中,再在残渣中加入20 mL乙腈重复超声提取1次,离心后合并2次的上清液,加10 mL异丙醇,50℃减压旋转蒸至近干,用5 mL甲醇-水(体积比2:8)溶解。C18固相萃取柱依次用5 mL甲醇,5 mL水,5 mL甲醇-水(体积比2:8)平衡,将上述溶液上样,用 5 mL甲醇-水(体积比 2:8)洗涤鸡心瓶,用鸡心瓶洗涤液淋洗小柱,抽干后用6 mL甲醇-乙酸溶液(体积比70:30)洗脱,收集洗脱液。将收集的洗脱液等分为3份,在50℃水浴,氮气吹至干,分别用甲醇溶解并定容至2.0 mL,经0.22 μm微孔滤膜过滤,滤液分别供高效液相色谱、气相色谱质谱法、液相色谱/串联质谱测定。

表1 地西泮的监测离子对和碰撞能量Table 1 Multiple reaction monitoring parameters and collision energy of diazepam
2 结果与讨论
2.1 样品前处理方法优化
目前,对动物源性食品中镇静剂类兽药残留分析的前处理方法主要有2种:一种是经过有机试剂提取后,通过液液分配去除脂肪进行分析;另一种是通过有机试剂反复提取后,经固相萃取净化后进行分析。其中,固相萃取净化法因具有净化效果好、操作简便、对仪器要求低等优点,已成为主要的分析方式。朱馨乐等[16]建立了一种猪尿中镇静剂的前处理方法,该方法简单易行,但需要易制毒-2类的三氯甲烷作为洗脱液,存在一定的危险性。而动物样品成分复杂,若前处理操作不当,极易产生基质效应。本研究发现,固相萃取的洗脱液中甲醇量对净化效果影响显著,甲醇量越高,洗脱的杂质越多,造成的基质效应越强;但甲醇量过低会导致洗脱效率低下,甚至无法洗脱分析物。本研究在保证回收率的前提下,利用LCMS/MS法深入探讨了洗脱液中不同甲醇量对回收率的影响,结果见表2(为便于理解和计算,所有加标量均用整数表示)。由表2知,洗脱液中甲醇体积比为70%时,地西泮回收率达到最佳。同时,利用HPLC法以及GC-MS法验证不同体积比甲醇-乙酸溶液的洗脱效果,结果与LC-MS/MS法一致,详见表3。因此,本研究采用体积比为7:3的甲醇-乙酸溶液作为洗脱液进行下一步探索。
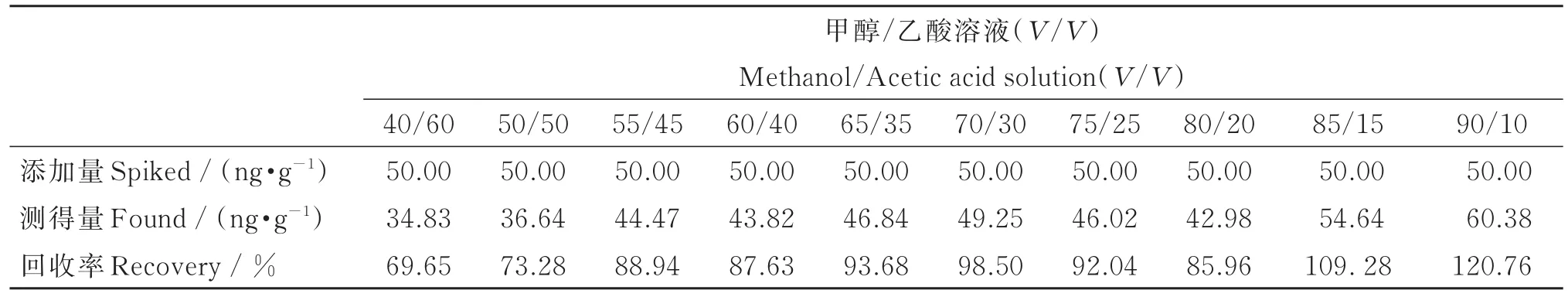
表2 不同配比洗脱液对地西泮回收率的影响(n=3,LC-MS/MS法)Table 2 Influence of eluent compositions on the recovery of diazepam by LC-MS/MS(n=3)
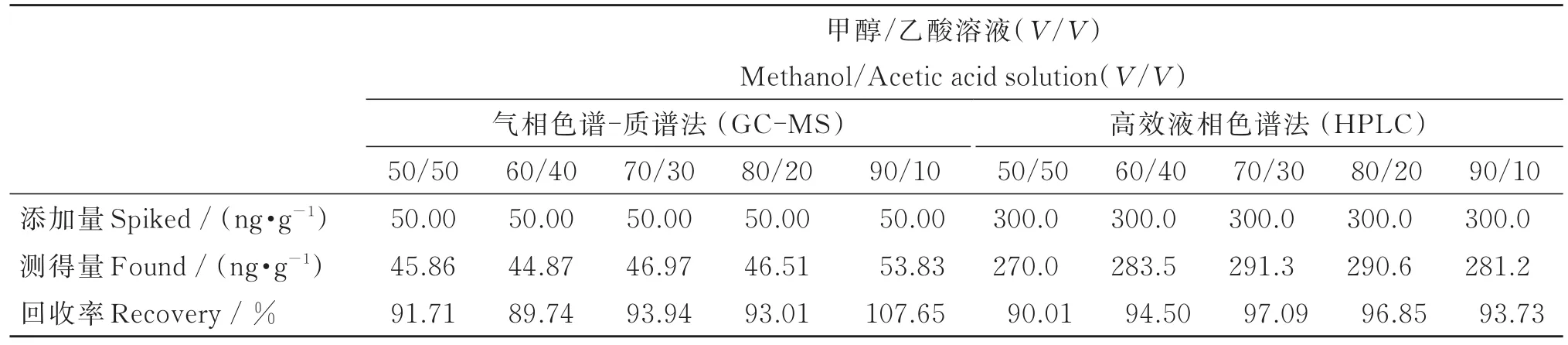
表3 不同配比洗脱液对地西泮回收率的影响(n=3,HPLC法及GC-MS法)Table 3 Influence of eluent compositions on the recovery of diazepam by HPLC and GC-MS(n=3)
2.2 线性范围、检出限和定量限
配制地西泮的标准工作溶液并对其进行测定,以仪器响应的峰面积A为纵坐标,以地西泮的浓度C为横坐标进行线性拟合,并在空白样品中添加地西泮标准溶液,以3倍信噪比(S/N=3)确定方法的检出限(LOD),以3倍检出限确定方法的定量限(LOQ)。 最终 确 定 质 谱 仪 器 的 LOD 为 0.5 μg·kg-1,HPLC 的LOD为10.0 μg·kg-1。由于质谱类仪器的灵敏度远高于色谱仪器,两者的LOD相差约20倍,故选择了不同范围的标准工作曲线进行线性拟合。结果表明,在不同仪器条件下,地西泮在各自浓度范围内的线性关系良好,相关系数(r2)均大于0.999,具体数值见表4。
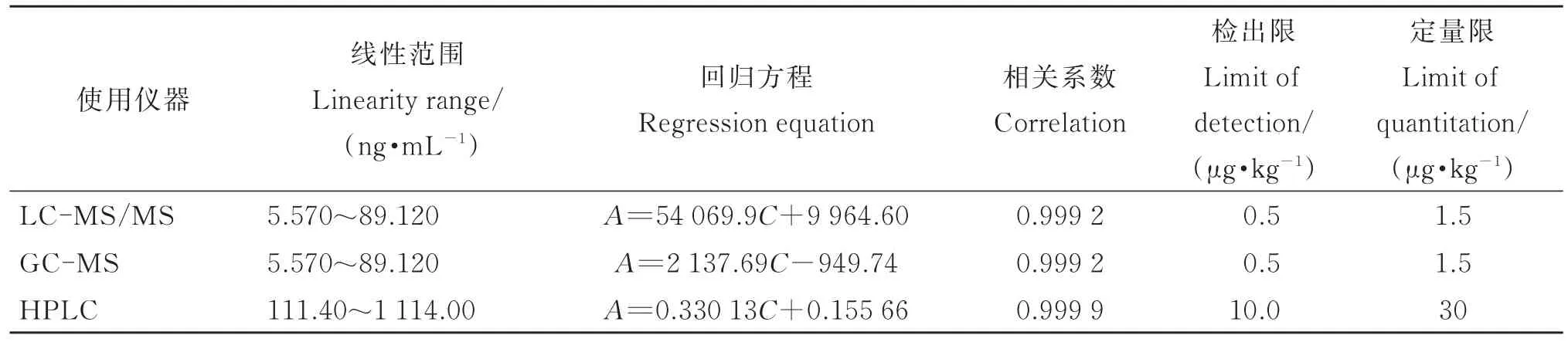
表4 不同仪器方法下地西泮的线性范围、回归方程、相关系数、检出限和定量限Table 4 Linearity range,regression equation,correlation,LOD and LOQ of diazepam with different instruments
2.3 回收率和精密度
对猪肉、猪肝、鸡肉样品进行地西泮回收率实验,质谱类仪器的添加水平分别为15.0,30.0和60.0 ng·g-1,液相色谱仪器的添加水平分别为100.0,300.0,500.0 ng·g-1,使用优化的前处理方法处理样品,每一添加水平各重复3次(猪肉样品添加水平重复6次以考察实验方法的精密度),平均回收率和RSD均良好,详见表5。
2.4 3种检测方法比较
我国现行食品标准规定的动物源性食品中地西泮的检测方法主要有:GB 29697—2013《食品安全国家标准动物性食品中地西泮和安眠酮多残留的测定气相色谱-质谱法》、SB/T 10501—2008《畜禽肉中地西泮的测定高效液相色谱法》、SN/T 2113—2008《进出口动物源性食品中镇静剂类药物残留量的检测方法液相色谱-质谱/质谱法》等,涉及的主要检测方法有气相色谱-质谱法、液相色谱-串联质谱法和高效液相色谱法。不同的标准规定的前处理方法不尽相同,虽然均采取有机试剂提取后通过固相萃取柱净化的方法,但在部分步骤上差异较大,例如气相色谱-质谱法需要加正己烷脱脂,而液相色谱-串联质谱法则省略了旋蒸的步骤并使用HLB固相萃取柱进行净化。各种前处理方法各有优劣,均不利于实验室仪器比对。因此,对每种方法进行总结归纳,并创建一种统一的方法进行样品前处理就显得格外重要。为此,本文首先尝试对不同的固相萃取柱进行比较,结果表明:在最优化前处理条件下,使用C18固相萃取柱的平均回收率为98.5%,而使用HLB固相萃取柱的平均回收率为89.7%,因此,本研究选择采用C18固相萃取柱作为净化柱;其次,探讨了不同的洗脱液对加标样品回收率的影响,最终确定用甲醇-乙酸溶液(体积比70:30)作为洗脱液,同时也证明优化后的方法并不需要正己烷脱脂这一步骤;最后比较了3种仪器方法对基质效应、回收率、灵敏度等参数的影响,从表4中可以看出,用质谱法检测时,回收率的相对标准偏差波动较大(0.78%~9.44%),说明即使采用优化后的前处理方法,在不同基质条件下,回收率仍易受基质效应的影响,因为质谱法的灵敏度较高,检出限和定量限较低,在加标浓度较低的情况下,微小的波动也会使结果有较大的变化;而用高效液相色谱法检测时,回收率的相对标准偏差比较稳定(均小于3.5%),主要原因是色谱法的检出限较高,当加标浓度较高时,基质效应对结果的影响可以忽略。同时也可以看出,色谱法的灵敏度较低,无法满足痕量检测的要求。
3 结 论
采用高效液相色谱法、液相色谱-串联质谱法及气相色谱质谱法对动物源性食品中的地西泮进行检测。方法简单快捷,准确率和精密度高,适用于动物源性食品中地西泮的定量检测。同时探讨了不同配比固相萃取洗脱液对地西泮回收率的影响,实验表明,当甲醇与乙酸溶液的体积比为70:30时,地西泮的回收率最高。在不同仪器条件下,地西泮在各自浓度范围内的线性关系良好,回收率和RSD值均能达到日常检测要求,故3种方法均可分析动物源性食品中的地西泮残留量。对比可知,质谱法的灵敏度和准确率高,但有一定的基质效应,适用于浓度较低的样品分析;液相色谱法操作简单,几乎不受基质效应的影响,但灵敏度和准确率不及质谱法,适用于浓度较高并对稳定性要求较高的样品的分析。研究可为检测机构合理高效地规划仪器方法提供一定的参考。

表5 不同检测方法测定的动物源性食品中地西泮的加标回收率Table 5 Recoveries of diazepam in animal original foods by different methods
