东北刺人参falcarindiol制备及其抗结肠癌作用机制研究
2019-08-02黄卫华
杨 璞,邵 莉,王 锦,黄卫华
1中南大学湘雅医院普通外科,长沙 410008;2湖南中医药大学药学院生药学教研室,长沙 410208;3中南大学湘雅医院临床药理研究所,长沙 410008
结肠癌是严重威胁人类生命健康的重大疾病,目前结肠癌临床主要依靠手术治疗并且通过药物化疗控制肿瘤的发展和转移,至今尚无专属特效治疗药物[1,2]。由于富含结构新颖,药理活性独特和类药性的特征,天然产物是活性先导化合物和新药研发的重要来源,在抗肿瘤化疗药物方面,许多药物直接来源于天然产物、天然产物转化物或受天然产物启发而设计合成的衍生物[3,4]。其中代表性的天然化合物有紫杉醇、长春花碱、喜树碱、鬼臼毒素衍生物等。因此,从传统的植物药中寻找高效低毒的先导化合物来筛选抗结肠癌药物是目前较为热门的研究领域。
东北刺人参(OplopanaxelatusNakai)为刺人参属植物,其药用功效可用于糖尿病、风湿病、高血压、调节免疫和肿瘤防治等,具有抗氧化、抗菌、解热镇痛、调节血压、抗肿瘤细胞增殖等生理活性[5,6]。刺人参根主要含挥发油、苯丙素、木脂素、炔醇类等化合物[7,8]。Falcarindiol (FAD)是东北刺人参中一种高含量炔醇化合物[9],对人结肠癌细胞HCT-116具有很强细胞毒活性[10],同时还具有抗氧化、抗菌、清除自由基等活性[6,11]。经常规色谱方法分离处理,FAD与其同系物oplopandiol (OPD)无法被分离开,制备液相色谱单次进样制备运行时间为40分钟,耗时长,有机溶剂消耗多[12]。
Wnt/β-catenin信号通路是调控结直肠癌的发生、发展、侵袭、转移等方面较为重要的一条信号通路[13]。当Wnt信号被激活后,β-catenin的磷酸化降解被抑制,使得β-catenin在细胞内过度聚积后入核与TCF/LEF(T细胞因子/淋巴增强因子)结合后启动下游基因的转录,而c-myc及cyclinD1是β-catenin下游主要调控细胞增殖以及周期的两个重要基因[14]。此前虽有报道称东北刺人参中炔醇富集部位对Wnt信号通路中的β-catenin蛋白具有一定的抑制作用,但对于FAD单独是否可以通过调控Wnt/β-catenin信号通路来调节结直肠癌的发展目前尚无研究报道。
本研究对以往的FAD分离制备方法进行优化,采用重叠进样的方法,可以更加快速高效的方制备FAD单体。此外,本文检测了FAD对HCT-116细胞增殖的影响并评价其对周期相关基因β-catenin、cyclin D1、c-myc的调控作用,以期为FAD作为一种新的结直肠癌治疗药物开发提供相关研究依据。
1 材料
1.1 试剂与仪器
ABI/Sciex三重四极杆质谱系统API 4000质谱仪;Bruker ACF-500型核磁共振仪。美国Agilent 1200系列分析液相色谱仪、日本岛津LC-20A制备液相色谱系统。美国Phenomenex Luna C18(4.6 × 250 mm,5 μmoL/L)分析色谱柱。美国Phenomenex Luna C18(21.2 × 250 mm,5 μmoL/L)制备色谱柱。薄层色谱GF254硅胶、正相柱色谱硅胶(200~300 目,青岛海洋化工厂)、40~60 μmoL/L反相硅胶(美国Grace Alltech公司);色谱纯甲醇和乙腈(德国Merck公司);分析纯试剂(国药控股有限公司,中国)。CO2培养箱(美国Thermo Fisher Scientific公司);AR1140 电子分析天平(瑞士Mettler Toledo公司);FC 500流式细胞仪(美国Beckman Coulter公司);美国Biotek Epoch酶标仪;RT-qPCR仪(Roche 480,美国罗氏公司);化学发光凝胶成像系统 (美国Bio-Rad 公司)。Falcon Labware 细胞培养瓶(美国Franklin Lakes)。0.25%胰酶细胞消化液(含0.02% EDTA),McCoy’s 5A培养基以及磷酸盐缓冲液(美国Mediatech公司)。β-actin,β-catenin,cyclin D1和c-myc引物(生工生物工程(上海)股份有限公司合成);β-catenin,cyclin D1和c-myc单克隆抗体及二抗抗体(北京博奥森生物技术有限公司);美国Sigma-Aldrich公司青霉素和链霉素。美国Promega的CellTiter 96细胞增殖MTS测定试剂盒。
1.2 药材与试药
药材于2015年8月采自辽宁省本溪市桓仁满族自治县,经辽宁中医药大学窦德强教授鉴定为东北刺人参O.elatus的干燥根。凭证标本(OER-20150826-1)存放于中南大学湘雅医院临床药理研究所。5-FU采购自大连美仑生物技术有限公司(批号:M0601A)。
1.3 细胞
人结肠癌细胞系HCT-116购自中南大学细胞中心,细胞保存于中南大学湘雅医院临床药理研究所。细胞在5% CO2、37 ℃及饱和湿度条件下进行常规培养,培养基为含10%胎牛血清和 50 IU双抗的McCoy’s 5A,所有实验均在细胞对数生长期进行。
2 方法
2.1 FAD分离制备
2.1.1 提取与粗分离
东北刺人参干燥根2.0 kg,粉碎过40目筛,95%甲醇冷浸提取,旋转蒸发仪减压浓缩得浸膏210 g,取190 g提取物分散于1 L蒸馏水中,分别用水饱和石油醚(1×3 L)萃取得浸膏19 g,水饱和乙酸乙酯(1×3 L)萃取得浸膏65 g,水饱和正丁醇(1×3 L)萃取得浸膏73 g及水部位。乙酸乙酯部位50 g上硅胶柱层析分离,经二氯甲烷-甲醇(100∶0~0∶100)梯度洗脱,二氯甲烷-甲醇(10∶1)洗脱物经反复硅胶柱层析和Sephadex LH-20 (氯仿-甲醇,1∶1)柱层析,所得组分含有FAD和其同系物OPD。
2.1.2 HPLC制备
将含FAD组分溶于甲醇(5 mg/mL),采用美国Phenomenex Luna C18(21.2×250 mm,5 μmoL/L)制备色谱柱,以甲醇-水(78∶22)为流动相,流速为10 mL/min,每次进样200 μL,检测波长为203 nm,采用重叠进样,充分利用空白保留时间,缩短样品制备时间,最终制备得高纯度FAD (6.8 g)和OPD (5.1 g)(纯度均 ≥ 98%)。
2.2 MTS法检测细胞增殖
HCT-116细胞生长至覆盖培养瓶底部面积90%以上,用0.25%胰酶消化液消化,传代。对数生长期细胞转移至96孔培养板进行培养,每个培养孔中含5 × 104个细胞,相同条件下培养。培养24小时,给药组中加入不同浓度的FAD稀释液(培养体系终浓度为100、50、30、10、5、2、1 μmoL/L),每个试药浓度设3个平行复孔;对照组加入与给药组等体积的培养基。置相同条件下培养。48小时后弃培养液,每孔加入用培养基配置的MTS溶液100 μL(333 μg/mL),置培养箱中孵育4 h,每孔吸取60 μL至另一96孔板用于酶标仪检测,检测波长为490 nm条件下测定吸光度(A)值,以培养基中加入相同浓度DMSO处理的细胞为对照组,重复检测3次,取平均值为最终结果计算FAD对细胞的增殖抑制率,利用SPSS 20.0软件统计半数抑制浓度IC50;增殖抑制率=(A对照-A药物)/(A对照-A空白)。
2.3 流式细胞术检测细胞周期
取对数生长期HCT-116细胞,弃去培养液,分别用2 mL PBS溶液清洗2次,加入0.5 mL 0.25%胰酶细胞消化液后置于培养箱中消化2 min,而后加入2 mL细胞完全培养基终止消化。用吸管轻轻吹打使细胞充分消化均匀分散,将细胞悬液转入5 mL离心管中,1 300 rpm离心5 min,弃上清液。重新加入2 mL培养液重悬沉淀细胞,细胞单层接种在12孔板中(细胞数为1 × 105个/孔)培养12 h,以不同浓度(2、5、10 μmoL/L)的FAD作用于HCT-116细胞,设3个平行复孔,并加入纯培养基设为对照组。细胞培养48 h 后,加0.25%胰酶消化液消化,收集细胞,1 300 rpm离心5 min后以PBS清洗1次,用预冷的75%乙醇4 ℃固定2 h,加入0.25% Triton X-100冰浴5 min。然后1 300 rpm离心5 min,用冷PBS洗涤细胞1次;用300 μL PI (40 μg/mL,含0.1 mg/mL RNase)染色,轻轻混匀后常温避光孵育25 min,使用流式细胞仪检测荧光信号,每次至少检测2×104个细胞。
2.4 RT-qPCR检测周期阻滞相关基因
不同浓度(0、2、5、10 μmoL/L) FAD作用于HCT-116细胞48 h后,收获HCT-116细胞,利用Trizol试剂盒常规提取细胞总RNA,用Nano drop 2000检测RNA纯度和完整性。依据逆转录试剂盒说明书,合成cDNA。Q-PCR的反应程序:所有条带(β-actin、β-catenin、cyclin D1和c-Myc)的条件选择为95 ℃、10 min;95 ℃、15 sec,60 ℃、30 sec共40个循环;95 ℃、15 sec,60 ℃、1 min,95 ℃、15 sec。β-actin的mRNA扩增为内参照。各基因的扩增引物如下:人源β-catenin(前引:5′-CATCTACACAGTTTGATGCTGCT-3′,后引:5′-GCAGTTTTGTCAGTTCAGGGA-3′);人源cyclin D1(前引:5′-GCTGCGAAGTGGAAAC CATC-3′,后引:5′-CCTCCTTCTGCACACATTTGAA-3′);人源c-myc(前引:5′-GTCAAGA GGCGAACACACAAC-3′,后引:5′-TTGGACGGACAGGATGTATGC-3′);人源β-actin(5′-TGACTGACTACCTCATGAAGAT-3′,5′-CATGATGGAGTTGAAGGTAGTT-3′)。
2.5 Western blotting检测β-catenin、cyclin D1和c-myc蛋白表达
加入不同浓度(0、2、5、10 μmoL/L)的FAD作用于HCT-116细胞,24 h后收集细胞及培养液,离心弃去上清,细胞沉淀用预冷PBS清洗2次,加入细胞裂解液,冰上裂解30 min (每8分钟重悬混匀1次),13 000 rpm 离心20 min,取上清,BCA法测定总蛋白含量,等量蛋白样品经SDS-PAGE电泳后,转膜,蛋白封闭后,封一抗过夜,加入二抗2 h后曝光显影。最后,使用Image J对蛋白条带的灰度值进行相对定量分析。
2.6 统计分析
3 结果
3.1 FAD快速制备
经常规色谱分离,薄层色谱紫外观察及显色显示FAD和其同系物OPD无法被分离,OPD结构鉴定为二氢FAD;因此,采用高效液相色谱对其分离制备,如图1(A)所示,FAD (tR= 36.7 min)与OPD (tR= 38.5 min)单次完成制备分离需运行40 min,其中保留时间tR= 2.1 min的色谱峰为溶解样品的甲醇溶剂峰,单次样品制备的tblank= 36.1 min。
如果按图1(A)所示方法制备FAD,则耗时长,有机溶剂消耗多。图1(B)所示,充分利用样品运行的空白保留时间,采用重叠多次进样操作程序,把FAD和oplopandiol (OPD)保留时间差加上他们的半峰宽设为tf→o= 3.5 min,两次进样制备的时间差Δt=tblank/n (1

图1 FAD制备色谱图Fig.1 The preparative chromatogram of FAD注:单次进样完整运行制备色谱图(A);重叠进样制备色谱图(B)。Note:The preparative chromatogram of FAD with single injection (A);The preparative chromatogram of FAD with multiple injections (B).
3.2 结构鉴定
Falcarindiol 淡黄色油状物;1H NMR(500 MHz,CDCl3):δH5.94(1H,ddd,J= 17.5,10.0,5.9 Hz,H-2),5.64(1H,dd,J= 17.5,1.5 Hz,H-1b),5.51(1H,ddt,J= 11.5,5.0,1.5 Hz,H-9),5.47(1H,ddt,J= 11.5,7.5,1.0 Hz,H-10),5.28(1H,d,J= 10.0 Hz,H-1a),5.21(1H,d,J= 8.5 Hz,H-8),4.95(1H,brd,J= 5.0 Hz,H-3),2.11(2H,q,J= 7.0,H-11),1.39(2H,m,H-12),1.29(8H,m,H-13,H-14,H-15,H-16),0.88(3H,t,J= 7.0,H-17);13C NMR(125 MHz,CDCl3):δc 117.4(C-1),135.9(C-2),63.4(C-3),78.4(C-4),70.3(C-5),68.6(C-6),79.8(C-7),58.5(C-8),134.5(C-9),127.7(C10),27.7(C-11),29.1(C-12),29.3(C-13),29.2(C-14),22.6(C-15),31.7(C-16),14.1(C-17);ESI-MS:m/z261 [M+H]+(C17H24O2)。以上数据与文献[12]报道基本一致,鉴定化合物为falcarindiol。
Oplopandiol 黄色油状物;1H NMR(500 MHz,CDCl3):δH5.59(1H,ddt,J= 11.0,7.5,1.0 Hz,H-9),5.52(1H,t,J= 8.5 Hz,H-10),5.20(1H,d,J= 8.5 Hz,H-8),4.39(1H,t,J= 6.5 Hz,H-3),2.09(2H,q,J= 7.0 Hz,H-11),1.74(2H,m,H-2),1.39(2H,m,H-12),1.29(8H,m,H-13,H-14,H-15,H-16),1.01(3H,t,J= 7.5 Hz,H-1),0.89(3H,t,J= 7.0 Hz,H-17);13C NMR(125 MHz,CDCl3):δc 9.4(C-1),30.6(C-2),63.9(C-3),79.2(C-4),68.9(C-5),68.8(C-6),80.8(C-7),58.5(C-8),134.5(C-9),127.9(C-10),27.8(C-11),29.1(C-12),29.4(C-13),29.2(C-14),22.6(C-15),31.8(C-16),14.1(C-17);ESI-MS:m/z285 [M+Na]+(C17H26O2)。以上数据与文献[12]对照基本一致,确定化合物2为oplopandiol。
3.3 细胞毒活性
FAD对p53基因野生型结肠癌细胞HCT-116具有较强的细胞毒活性且呈现一定的时效量效关系,其与HCT-116细胞作用24、48、72 h的IC50值分别为8.1±1.4,4.6±0.5和3.2±0.4 μmoL/L,且抑制作用强于阳性对照药5-氟尿嘧啶。FAD对肿瘤细胞与正常细胞毒性作用未显良好的选择性,对人正常肝细胞(LO2)和血管内皮细胞(HVEC)均显示一定的细胞毒活性,与HCT-116细胞作用24 h的IC50值分别为20.5±2.6 和18.7±1.5 μmoL/L。与正常细胞相比,FAD对癌细胞表现出更强的细胞增殖抑制作用。
3.4 细胞周期影响
FAD作用于HCT-116细胞48 h后,对其细胞周期阻滞现象比较明显(见图2)。经2 μmoL/L 的FAD作用48 h后,HCT-116细胞周期被阻滞在G2/M期比率为23.5%±1.2%。随着给药浓度的增加,HCT-116细胞周期被阻滞在G2/M期比率由23.5%±1.2%上升至38.6%±1.8%,呈现一定的浓度依赖性。

图2 流式细胞术分析FAD对HCT-116细胞周期影响Fig.2 Effects of FAD on cell cycle analysis of HCT-116 using flow cytometery
3.5 周期相关基因mRNA水平的影响
不同浓度的FAD (2、5、10 μmoL/L)作用于结肠癌细胞HCT-116 48 h后,细胞中c-myc、β-catenin、cyclin D1基因的表达下调,且随着试药浓度的增加,下调作用增强,具体结果见图3。
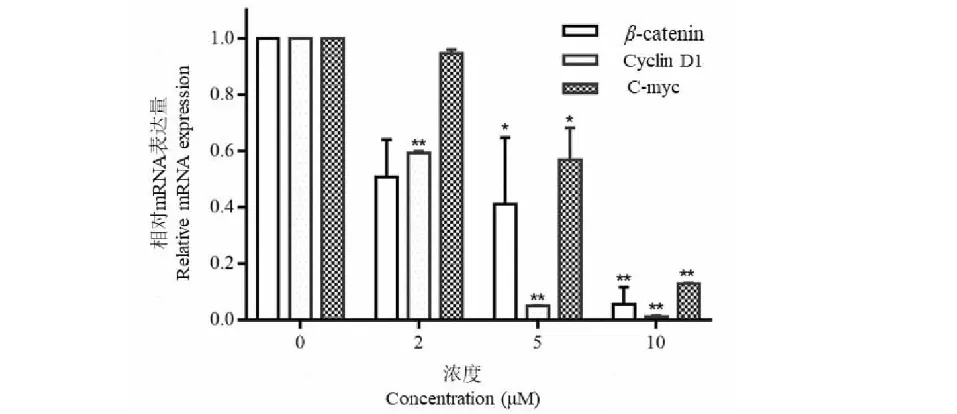
图3 FAD对HCT-116细胞中β-catenin、cyclin D1和c-myc mRNA表达的影响Fig.3 Effects of FAD on mRNA level of β-catenin、 cyclin D1 and c-myc in HCT-116 cell line
3.6 周期相关蛋白表达的影响
与未处理组细胞相比,不同浓度的FAD (2、5、10 μmoL/L)作用于结肠癌细胞HCT-116 48 h后,细胞中β-catenin蛋白明显被抑制。同时,β-catenin下游的蛋白cyclin D1和c-myc的表达也呈现下调趋势,且随着试药浓度的增加,下调作用增强,具体结果见图4。
4 讨论
天然药物在中医理论指导下用药称之为中药或中草药,源于天然药物的天然产物是药用植物自然进化选择形成的次生代谢产物,其结构具有化学多样性、活性多样性和类药性。临床上应用的许多药物都直接或间接来源于天然产物[15],从天然产物中发现具有抗肿瘤作用的药物是其有效途径之一。高纯度天然化合物的获取是天然药物开发研究的基础,多数天然产物具有结构类似的异构体或者同系物,对于结构差异较小的异构体或者同系物,常规色谱分离技术很难将其完全分离,制备高效液相色谱是将他们完全分离纯化有效手段之一,优化制备方法,将有助于天然产物快速高效制备,节省有机溶剂使用,降低环境污染。本课题以FAD为研究为例,采用重叠进样,所建立的方法高效、稳定、快速,极大的缩短了样品制备时间。

图4 FAD对HCT-116细胞中β-catenin、cyclin D1和c-myc蛋白表达的影响Fig.4 Effects of FAD on protein expression of β-catenin、cyclin D1 and c-myc in HCT-116 cell line
细胞内外信号配合调控细胞周期,如果胞内外信号不能很好配合,细胞将不能从一个分裂期进入下一个分裂期,这种现象称为细胞周期阻滞。细胞周期阻滞有助于细胞维持自身基因的稳定性,其调控的基因突变可明显影响肿瘤的发生发展。细胞周期阻滞为细胞提供额外的时间用于修复损伤,从而减少突变的进一步发生,避免肿瘤恶化与发展。课题组前期研究发现可以抑制结肠癌细胞HCT-116的增殖及阻滞其细胞周期[16,17],但其周期阻滞的相关基因的表达并未被阐明,本研究发现其可能通过影响Wnt/β-catenin信号通路中β-catenin蛋白的表达,进而下调cyclin D1和c-myc蛋白表达。研究结果表明,不同浓度的FAD (2、5、10 μmoL/L) 作用于结肠癌细胞HCT-116 48 h后,可明显下调β-catenin蛋白及其下游蛋白cyclinD1和c-myc的表达,从而使肿瘤细胞周期被阻滞和增殖被抑制。
东北刺人参叶中主要含有皂苷类成分,而其根和茎中主要含有苯丙素、木脂素及炔醇类成分[18,19],其中炔醇是其抗结肠癌活性的药效成分。FAD是首次从刺人参属中发现具有(3S,8S)-立体结构的炔醇,而从伞形科植物中发现的主要是(3R,8S)-FAD,而后者抗肿瘤活性未见相关报道。本研究建立东北刺人参FAD快速高效的制备HPLC纯化方法。并探讨其结肠癌细胞HCT-116具有细胞毒活性作用机制,FAD对结肠癌细胞HCT-116具有较强的细胞毒活性,且能对其细胞周期产生阻滞作用,其机制可能与调控Wnt/β-catenin信号通路有关。
