海洋真菌Arthrinium sp.UJNMF0008代谢产物的研究
2019-08-02王荫荫翟慧娟
曾 红,王荫荫,翟慧娟,贺 菲,鲍 洁,*
1塔里木大学新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,阿拉尔 843300;2济南大学生物科学与技术学院,济南 250022
海洋真菌资源丰富,能够产生结构新颖、丰富多样的活性代谢产物,已经成为药用先导化合物的重要资源。深海作为海洋环境中的极端区域,约占海洋总体积的75%,虽然其环境恶劣,具有高压、高盐、低温、低氧、低光照、营养贫瘠等特点,但是其微生物资源仍然非常丰富,在深海生态系统中扮演着重要的角色[1]。深海真菌多样性及其代谢产物的研究起步相对较晚,Roth等在1964年首次从大西洋4 450米沉积物中分离出深海真菌,直到2004年,Gautschi等才首次报道了从海洋沉积物来源的真菌中发现了5个具有生物活性的聚酮类化合物[2,3]。随着现代技术的发展,对深海真菌多样性及其代谢产物的研究越来越多,从中发现了大量骨架新颖、生物活性显著的代谢产物[4,5],特别是在抗菌、抗肿瘤方面,显示出了很好的活性[6-8]。
Arthriniumsp.是一类广泛分布的真菌,禾本科和莎草科植物是其最主要的寄主[9],海洋环境中也有分布。目前,对该属真菌代谢产物的研究还较少,但是也已经从中发现了一些结构新颖的代谢产物,并且表现出了良好的生理活性,例如,具有乙酰胆碱酯酶抑制活性和细胞毒活性的吡啶酮生物碱类[10]、具有细胞毒活性的聚酮类和松弛素类化合物[11,12]以及具有抗菌活性的灰黄霉素类化合物[13]。为了进一步挖掘海洋来源Arthrinium属真菌的代谢产物,我们对深海沉积物来源的Arthriniumsp.UJNMF0008的大米发酵产物进行了提取分离,从中得到5个化合物(图1)。通过核磁共振(NMR)、质谱(MS)、文献对照等方法对这些化合物的结构进行了结构鉴定,并对其进行了活性测试,其中化合物1和2为新化合物,但是这些化合物在50 μmoL/L的测定浓度下,没有表现出明显的抑制氧自由基、抗菌或者抑制NO释放的活性。

图1 化合物1~5的化学结构Fig.1 Chemical structures of compounds 1-5
1 材料和方法
1.1 材料与仪器
Avance DRX 600核磁共振波谱仪(Brucker);1260-6460三重四级杆液质联用仪(Agilent);6545 Q-TOF高分辨质谱(Agilent);UV-2600紫外分光光度计(Shimadzu);Rudolph VI 旋光仪(Rudolph);FT-IR VERTEX70红外光谱仪(Brucker);1260高效液相色谱(Agilent);R-100型旋转蒸发仪(BUCHI);Sephadex LH-20凝胶(GE Healthcare);检测用GF254薄层色谱硅胶及分离用柱色谱硅胶(烟台江友硅胶开发有限公司);分离提取用试剂均为分析纯试剂(天津富宇精细化工有限公司),高效液相使用色谱纯试剂(Oceanpak)。
1.2 实验方法
1.2.1 菌种与发酵
菌株UJNMF0008分离自南海海洋沉积物(17°55′00″N,115°55′31″E;3 858 m),菌种保存于中国普通微生物菌种保藏管理中心。
用无菌竹签将真菌Arthriniumsp.JUNMF0008菌种接种于PDA琼脂培养基上,28 °C培养5天,得到培养有菌种的平板,然后用无菌竹签挑取适量真菌Arthriniumsp.UJNMF0008菌种接种入含150 mL种子培养基(葡萄糖1.0%,可溶性淀粉1.0%,MgSO40.1%,KH2PO40.1%,蛋白胨0.1%,海盐3.0%)的500 mL三角瓶中,28 °C摇床(180 rpm)培养3天得到种子液,然后用移液器接种10 mL种子液到装有大米培养基(80 g大米、0.4 g酵母浸膏、0.4 g葡萄糖、3.6 g海盐、120 mL水)的1 L三角烧瓶中,共4.8 kg大米,于28 °C静置培养30天,得到发酵产物。
1.2.2 发酵产物的提取与分离
将所得固体发酵物用95%乙醇浸泡,浸取液回收乙醇后剩余水相再用乙酸乙酯萃取,减压浓缩得到粗提物(80 g)。所得浸膏经硅胶柱层析,以氯仿/甲醇(1∶0~0∶1)梯度洗脱,结合TLC检测,合并得到10个流分(Fr.1-Fr.10)。Fr.6经D-101大孔树脂,以乙醇/水(30%,50%,80%,100%)洗脱,结合TLC检测,合并得到4个亚流分(Fr.6-1~Fr.6-4)。Fr.6-3进一步经硅胶柱层析,以氯仿/丙酮(1∶0~0∶1)梯度洗脱,结合TLC检测,合并得到9个亚流分(Fr.6-3-1-Fr.6-3-9);Fr.6-3-2经中压柱层析(MPLC)纯化、HPLC制备(甲醇/水,v/v 42:58,3.0 mL/min)得到化合物4(tR=12.4 min,4.6 mg);Fr.6-3-6经中压柱层析(MPLC)纯化、半制备型TLC板制备得到化合物3(4.2 mg);Fr.6-3-7经中压柱层析(MPLC)纯化、HPLC制备(甲醇/水,v/v 42∶58,3.0 mL/min)得到化合物2(tR=11.8 min,3.3 mg)。Fr.7经硅胶柱层析,以氯仿/丙酮(1∶0~0∶1)梯度洗脱,结合TLC检测,合并得到3个亚流分(Fr.7-1-Fr.7-3)。Fr.7-2经凝胶Sephadex LH-20(氯仿/甲醇 1∶1)纯化,进一步通过HPLC制备(甲醇/水,v/v 35∶65,3.0 mL/min)得到化合物5(tR=20.9 min,3.2 mg)。Fr.8经硅胶柱层析,以氯仿/丙酮(1∶0~0∶1)梯度洗脱,结合TLC检测,合并得到4个亚流分(Fr.8-1-Fr.8-4)。Fr.8-2经中压柱层析(MPLC)纯化,进一步通过HPLC制备(甲醇/水/CH3COOH,v/v/v 34∶66∶10-4,3.0 mL/min)得到化合物1(tR=42.8 min,2.2 mg)。
1.2.3 化合物活性测试
采用DPPH法测定化合物的抗氧自由基活性[14]:在96孔板中加入100 μL,200 μmoL/L的DPPH乙醇溶液和100 μL待测样品的乙醇溶液(样品终浓度为50 μmoL/L),25 °C孵育30 min,于517 nm 处测定反应溶液的吸光度AS,以100 μL,200 μmoL/L的DPPH乙醇溶液和100 μL乙醇溶液的混合液作为阴性对照AC,DPPH 自由基清除率(%)= [(AC-AS)/AC]×100%。
采用96孔板法测定化合物的抗菌活性[15],测试菌株包括革兰氏阳性菌MycobacteriumsmegmatisATCC 607和StaphylococcusaureusATCC 25923,革兰氏阴性菌EscherichiacoliATCC 8739和PseudomonasaeruginosaATCC 9027以及真菌CandidaalbicansATCC10231:分别将4株待测细菌接种到LB培养基中37 °C摇床(180 rpm)培养24小时(真菌接种到YPD培养基中28 °C培养48小时),用LB培养基(真菌用YPD培养基)将培养液的菌种浓度稀释到104~105cfu/mL,接种于96孔板中,每孔包含200 μL(包含待测样品50 μmoL/L)培养液,200 μL含菌种的培养液作为对照,200 μL 不含菌种的培养液作为空白,37 °C培养12小时(真菌28 °C培养48小时),用酶标仪检测各孔在600 nm处的吸光度A值,计算抑菌率(%),抑菌率(%)= [1-(A实验组-A空白组)/(A对照组-A空白组)]×100%。
NO释放抑制活性测定[14]:取对数生长期的RAW 264.7细胞接种于96孔板中, 5% CO2、37 °C培养24 h,换成无血清培养基,同时加入LPS(终质量浓度为1 μg/mL)和待测样品 (终浓度为50 μmoL/L),再培养24 h,然后吸取细胞上清液,用Griess法测定上清液中NO含量,NO释放抑制率(%)= [1-(A实验组-A空白组)/(A对照组-A空白组)]×100%。
2 结果与分析
2.1 化合物结构鉴定


表1 化合物1~2的1H NMR(600 MHz)和13C NMR(150 MHz)数据(DMSO-d6)Table 1 1H NMR (600 MHz) and 13C NMR (150 MHz) data for 1-2 (DMSO-d6)
续表2(Continued Tab.2)

Pos.12δC,typeδH (J in Hz )δC,typeδH (J in Hz )845.7,CH3.46,dd (8.0,1.5)41.8,CH3.95,dd (2.3,1.1)8a113.4,C112.1,C9181.1,C181.0,C9a107.9,C108.8,C1062.2,CH24.58,s62.4,CH24.59,brs11172.3,C170.3,C11-OCH351.8,CH33.62,s52.5,CH33.54,s1-OH12.15,s

图2 化合物1主要的1H-1H COSY、HMBC和NOESY相关Fig.2 The key 1H-1H COSY,HMBC and NOESY correlations for compound 1

化合物3淡黄色粉末(CH3OH);1H NMR (600 MHz,DMSO-d6)δ:6.38 (1H,d,J=1.1 Hz,H-2),7.08 (1H,d,J=1.1 Hz,H-4),8.06 (1H,d,J=8.9 Hz,H-5),8.41 (1H,d,J=8.9 Hz,H-6),4.62 (2H,d,J=2.6 Hz,H-10),3.95 (3H,s,11-OCH3),2.80 (3H,s,S-CH3),5.59 (1H,t,J=5.6 Hz,12-OH),11.86 (1H,s,1-OH);13C NMR (150 MHz,DMSO-d6)δ:160.4 (C-1),108.1 (C-2),155.4 (C-3),104.3 (C-4),155.0 (C-4a),121.7 (C-5),157.2 (C-5a),130.4 (C-6),139.0 (C-7),129.8 (C-8),116.6 (C-8a),179.8 (C-9),107.2 (C-9a),62.3 (C-10),166.0 (C-11),53.2 (11-OCH3),43.3 (S-CH3)。以上数据与文献[19]报道一致,因此鉴定化合物3为sydoxanthone C。
化合物4白色粉末(CH3OH);1H NMR (600 MHz,DMSO-d6)δ:4.75 (1H,dq,J=6.6,2.1 Hz,H-3),4.50 (1H,dd,J=6.3,2.1 Hz,H-4),5.71 (1H,d,J=6.3 Hz,4-OH),7.00 (1H,dd,J=8.3,0.9 Hz,H-5),7.58 (1H,dd,J=8.3,8.3 Hz,H-6),6.96 (1H,brd,J=8.3 Hz,H-7),10.96 (1H,s,8-OH),1.40 (3H,d,J=6.6 Hz,H-10);13C NMR (150 MHz,DMSO-d6)δ:169.0 (C-1),78.4 (C-3),65.2 (C-4),142.5 (C-4a),116.8 (C-5),136.4 (C-6),118.8 (C-7),160.5 (C-8),107.4 (C-8a),15.8 (C-10)。以上数据与文献[20]报道一致,因此鉴定化合物4为(3R,4R)-cis-4-hydroxymellein。
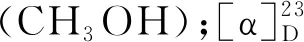
化合物1、2的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
2.2 活性测试结果
在50 μmoL/L的测定浓度下,化合物1~5对氧自由基、5株测试菌株(Mycobacteriumsmegmatis、Staphylococcusaureus、Escherichiacoli、Pseudomonasaeruginosa、Candidaalbicans)以及NO释放的抑制率均小于40%,没有表现出明显活性(表 2)。
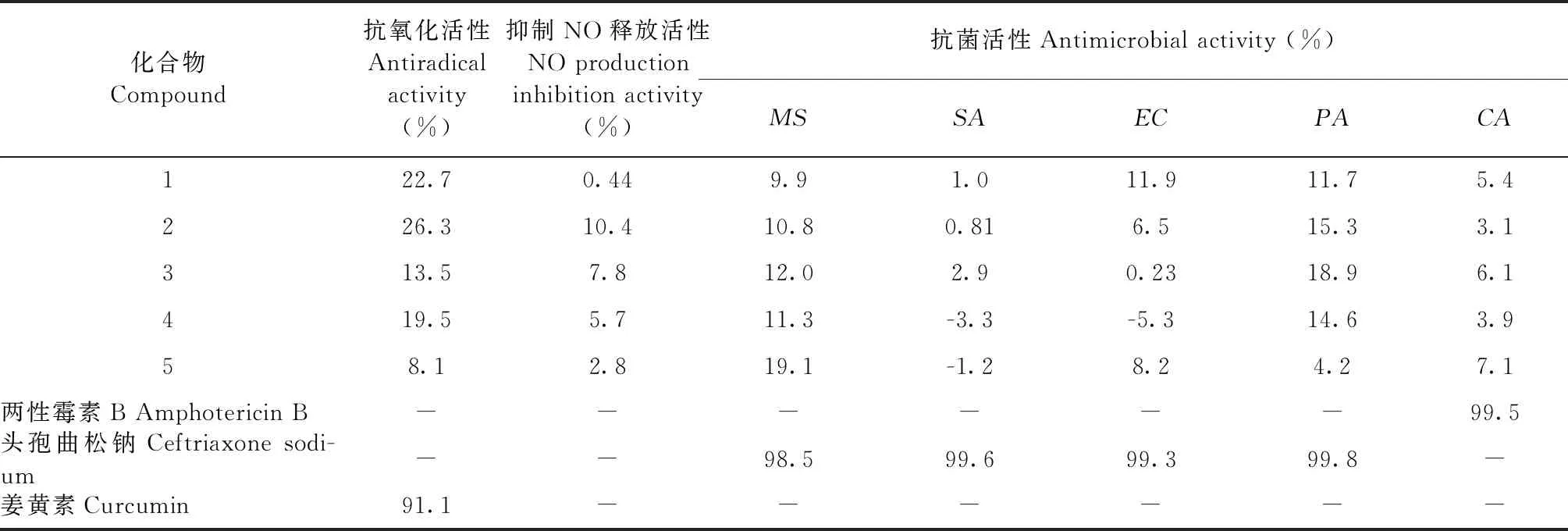
表2 化合物1~5的生物活性测试结果(50 μmoL/L浓度下的抑制率)Table 2 Biological activity of compounds 1-5 (Inhibition ratio in 50 μmoL/L)
注:MS:MycobacteriumsmegmatisATCC607;SA:StaphylococcusaureusATCC25923;EC:EscherichiacoliATCC 8739;PA:PseudomonasaeruginosaATCC 9027;CA:CandidaalbicansATCC10231。
Note:MS:MycobacteriumsmegmatisATCC607;SA:StaphylococcusaureusATCC25923;EC:EscherichiacoliATCC 8739;PA:PseudomonasaeruginosaATCC 9027;CA:CandidaalbicansATCC10231.
3 讨论
海洋真菌能够产生活性良好、结构丰富的代谢产物,已经成为药物先导化合物的研究热点,在抗肿瘤、抗感染、抗病毒、抗疟疾药物开发方面显示出了巨大的潜力。但是,虽然目前从不同海洋样品来源的真菌中发现的代谢产物已经几千个,进入临床的化合物却寥寥无几,使得大量潜在的先导化合物无法成为真正的药物[7]。因此,如何充分挖掘海洋真菌代谢产物的生物活性、优化先导化合物的化学结构、系统评估先导化合物的成药性成为海洋药物研究的难点。本文对海洋沉积物来源的真菌Arthriniumsp.UJNMF0008的代谢产物进行了研究,从中发现了5个聚酮类化合物,并对其进行了活性测试,在50 μmoL/L的测定浓度下,化合物1~5对氧自由基、5株测试菌株以及NO释放的抑制率均小于40%。我们将进一步优化培养条件,挖掘该菌株的代谢产物多样性及其生物活性,为海洋药物先导化合物的发现提供基础。
