何首乌苷通过激活BDNF/TrkB信号通路拮抗H2O2诱导的大鼠海马神经元氧化损伤
2019-08-02李茜茜郎修远覃筱燕
李茜茜,李 飞,郎修远,覃筱燕*
1中央民族大学生命与环境科学学院转化神经科学中心,北京100081;2南宁市公安局强制隔离戒毒所,南宁 530001
何首乌Fallopiamultiflora(Thunb.) Harald.是蓼科何首乌属植物,俗称首乌。何首乌的活性成分主要包括二苯乙烯苷类、蒽醌类、酚类、黄酮类等。其中,2,3,5,4-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(2,3,5,4′-Tetrahydroxystilbene-2-O-β-D-glucoside,THSG),俗称二苯乙烯苷,为该药用植物最主要的药理活性成分,在该植物中的含量极高,同时药理活性十分清晰,亦称为何首乌苷(Polygonummultiflorumglycosides,PMG)[1-3]。近年来,对PMG(THSG或二苯乙烯苷)在神经损伤保护方面的研究日渐增多,但其作用机理复杂多靶向,尚未阐明[1,2,4,5]。已发现的机制如通过维持神经元内的β-tubulin III 微管蛋白的形态构成、调节caspase蛋白的表达量、抗氧化、提高脑内乙酰胆碱酯酶(AchE)的活性等,从而提升脑损伤大鼠的学习记忆能力[1,2,5]。
脑源性神经营养因子(brain derived neurotrophic factor,BDNF)/酪氨酸激酶受体B(tyrosine kinase B,TrkB)是神经细胞内一条重要的信号转导通路,它参与突触可塑性的调节,并在学习记忆中扮演着重要的角色。BDNF是在脑内合成的一种蛋白质,在中枢神经系统中广泛表达,主要分布于杏仁核、海马、皮质等部位[6],是哺乳动物脑中分布最广、含量最高的神经营养因子,它通过不同的途径调节神经元存活、分化和凋亡,对神经系统发育和功能的维持具有重要作用[7]。TrkB是BDNF的受体,二者结合后可触发一系列细胞内信号传递从而发挥生物学效应[8]。在BDNF/TrkB信号传导通路中,BDNF与TrkB结合后激活胞内区域,引起TrkB自身磷酸化作用增强,进而激活Ras-MAPK通路,最后在CAMP反应元件结合蛋白(CREB)的丝氨酸位点激活CREB。CREB通过增加BDNF基因及抗凋亡蛋白基因Bcl-2的表达,促进神经细胞生存,增加突触可塑性及神经发生[9]。因此BDNF/TrkB信号转导通路是脑细胞内一条关键性的通路,尤其是维持细胞生存、抑制细胞凋亡的相关过程中起着十分重要的作用。本研究拟在前期工作基础上[1,2],通过神经元原代培养并建立H2O2损伤模型,从细胞、分子水平观察何首乌苷对神经元氧化损伤及BDNF/TrkB信号通路的影响,探讨何首乌苷对神经元氧化应激损伤的拮抗作用,为临床开发何首乌苷的药用价值提供实验参考。
1 材料与方法
1.1 试验药物
何首乌苷(PMG):2,3,5,4-四羟基二苯乙烯-2-O-β-D-葡萄糖苷,购自上海源叶生物技术有限公司,批号:B21757,规格:20 mg/支,HPLC法检测其浓度≥98%。将何首乌苷用二甲基亚砜 (DMSO)溶解配置成浓度为1 μmol/L的溶液,于-20 ℃避光保存。使用时用蒸馏水配至所需浓度。
1.2 动物
实验动物为新生24 h内SD大鼠乳鼠,采购于北京大学医学部实验动物中心,合格证号:SCXK(京)2016-0010;SYXK(京)2016-0041。
1.3 试剂
噻唑蓝(methyl thiazolyl tetrazolium,MTT货号:M2128)、K252a(货号:K1639)、POLY-L-Lysine 0.01%(货号:RNBC5367)均购自Sigma公司; P-TrkB(货号:4619S)、β-tubulin III(货号:5568S)、DAPI(货号:4083S)均购自Cell signaling 公司;BDNF(货号:ab108319)购自Abcam公司;TUNEL(货号:11684809910)购自Roche公司;DMEM/F-12(货号:NYK0993)、胎牛血清(货号:KSJ30472)均购自Thermo公司;Neuralbasal medium(货号:1297830)、B27(货号:1268476)均购自Invitrogen公司;胰蛋白酶(货号:20130506)、青霉素链霉素混合液(货号:20130410)均购自北京索莱宝科技有限公司;Tween-20(货号:922C042)购自上海碧云天生物技术有限公司。
1.4 仪器
二氧化碳培养箱(新加坡ESCO公司)、荧光/吸收光酶标仪(美国Thermo公司)、高速冷冻离心机5417R(德国Eppendodf 公司)、Odyssey CLx红外荧光扫描成像系统(美国LI-COR公司)。
1.5 实验方法[1,11]
1.5.1 神经元原代培养及实验分组
无菌环境下取SD大鼠乳鼠的海马体剪碎,用0.25%胰蛋白酶在37 ℃下消化25 min,用含10%胎牛血清的DMEM液终止消化并吹打均匀,用100目过滤筛除去未消化组织块,1 100 rpm离心5 min,弃上清,用含10%胎牛血清的DMEM液重悬成单细胞悬液,调整细胞密度至1×106个/mL,接种到细胞板上,置于37 ℃、5% CO2培养箱中培养。24 h后培养基更换为含B27的Neurobasal®培养基,每隔2 d半量换液一次,细胞培养5~7天,生长状态良好[1,11]。实验时将细胞随机分为7组:control组、H2O2模型组、K252a组、K252a+H2O2组、PMG+ H2O2预处理组、PMG+K252a+H2O2组和PMG组。Control组不加任何药物处理;H2O2模型组加入终浓度为200 μmol/L的H2O2;K252a组加入终浓度为200 nM的K252a;K252a+H2O2组加入终浓度为200 nM的K252a和200 μmol/L的H2O2;PMG+ H2O2组预先加入终浓度分别为100、200、400 μmol/L的PMG预处理2 h后再加入终浓度为200 μmol/L的H2O2;PMG+K252a+ H2O2组预先加入终浓度分别为200 μmol/L的PMG和200 nM的K252a预处理2 h后再加入终浓度为200 μmol/L的H2O2;PMG组分别加入终浓度为100、200、400 μmol/L的PMG。各实验组处理后置于37 ℃、5%CO2培养箱中继续培养,20~24 h后用于实验[1,10]。
1.5.2 MTT法测定细胞存活率
培养在96孔板里的细胞经药物处理20~24 h后,吸出培养基,PBS轻洗1~3次,每孔加入100 μL终浓度为0.5 mg/mL的MTT,培养箱孵育2~4 h,吸去培养基,加入150 μL DMSO,摇床上震荡10 min,待颗粒溶解后,在波长为560 nm处测定吸光度A值。细胞存活率(100%)=待测组A值/control组A值×100%,设定control组细胞存活率为100%,细胞的存活率与A值成正比。
1.5.3β-Tubulin III染色、DAPI染色以及TUNEL染色
造模、给药与细胞培养均与前面实验相同。对各实验组分别进行β-tubulin Ⅲ、DAPI及TUNEL免疫荧光染色,取出生长在24孔板盖玻片上的SD大鼠乳鼠海马神经元细胞,PBS洗涤,4%多聚甲醛固定PBS洗涤;用一抗β-tubulin Ⅲ(1∶1 000)、二抗以及DAPI荧光染色,PBS 洗涤,封片,通过荧光显微镜分别观察各实验组细胞毒性损伤时的细胞骨架、核形态及凋亡分布变化。
1.5.4 Western blot 检测目的蛋白表达量
培养在6孔板里的细胞药物处理20~24 h后,用0.01 mol/L的PBS洗涤3~5次,每孔加入100 μL的细胞裂解液,冰上静置30 min,12 000 rpm的高速冷冻离心15 min,取上清液。用BCA法测定蛋白浓度,10%的SDS-PAGE分离蛋白质并转膜(PVDF膜),5%的脱脂奶粉封闭30 min,一抗(1∶1 000)4 ℃ 孵育过夜,用TBST洗3~5次,在室温下二抗(1∶1 000)孵育1 h,TBST洗3~5次,加化学发光液(A液与B液等体积混合)在化学发光成像仪Tanon4200下观察蛋白质的表达量并拍照。
1.6 统计学分析方法
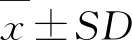
2 结果
2.1 MTT检测PMG对H2O2诱导神经元氧化应激损伤的保护作用
培养至7天,向神经元培养基内加入不同浓度的H2O2(50、100、150、200、250、300、400 μmol/L),细胞继续培养1天。MTT检测的实验数据表明,各浓度H2O2损伤组细胞存在不同程度的损伤,且随着H2O2浓度的提高,细胞存活率呈浓度依赖性的下降,分别为74.62%、58.37%、50.63%、46.81%、31.93%、17.48%、9.36%,表明神经元损伤模型的建立。选择H2O2浓度为200 μmol/L时,细胞存活率为46.81%,作为后续实验最佳H2O2损伤浓度。
为进一步明确PMG的最佳保护作用及毒性浓度,实验设置8个小组,分别为对照组、H2O2损伤组(终浓度200 μmol/L)、PMG不同浓度组(终浓度分别为100、200、400 μmol/L)和PMG不同浓度预处理组,进行MTT检测。实验结果如表1所示,与H2O2损伤组相比,终浓度分别为100、200 μmol/L的PMG预处理,神经元存活率大幅度上升(69.80%,93.63% 和P<0.05,P<0.001),说明一定浓度范围的PMG对于H2O2诱导的神经元氧化应激损伤具有保护作用。与对照组相比,终浓度分别为100、200 μmol/L的PMG对神经元存活没有影响,而PMG终浓度达到400 μmol/L时,细胞的存活率已经下降到57.82%,说明过高浓度的PMG对神经细胞可产生毒性,因此,PMG在做保护性药物时,应合理控制PMG的浓度范围,选择最佳保护浓度。
2.2 TUNEL染色显示PMG对H2O2氧化应激诱导神经元凋亡的抑制
培养7天的细胞采用TUNEL和DAPI染色法观察细胞凋亡率的变化。结果如图1、2显示,DAPI染色正常细胞核呈圆形或椭圆形、浅蓝色;TUNEL染色凋亡细胞核呈强荧光绿色,为大小不均的点状,细胞核固缩或溶解成碎片。对照组正常培养的大鼠海马神经元的TUNEL检测显示无强荧光染色,绿色的细胞凋亡数极少。H2O2损伤组神经元表现出典型的凋亡形态特征:为强荧光绿色,细胞核固缩或溶解成碎片,凋亡率显著提高。浓度为200 μmol/L PMG预先处理的大鼠海马神经元,核固缩细胞的数目或核溶解成碎片明显减少,统计显示PMG+ H2O2预处理组的细胞凋亡率与H2O2损伤组相比下降24%(P<0.01),具有统计学意义;另外,PMG组显示的TUNEL和DAPI染色结果排除了PMG对细胞具有毒性作用。TUNEL染色结果显示PMG可拮抗H2O2诱导的神经元凋亡的形态学变化。

表1 不同浓度PMG对H2O2诱导神经 元毒性损伤细胞存活率的影响Table 1 Effect of different concentrations of PMG on H2O2- induced neuronal toxicity in cell
注:*与Control组比较,*P<0.05;**P<0.01;***P<0.001;#与H2O2损伤组比较,#P<0.05;##P<0.01;###P<0.001。
Note:*Compare with control,*P<0.05;**P<0.01;***P<0.001;#Compare with H2O2injury group,#P<0.05;##P<0.01;###P<0.001.
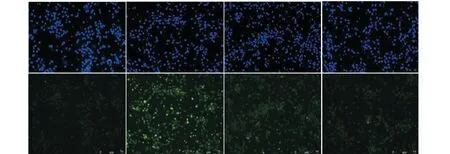
图1 TUNEL检测显示PMG对H2O2诱导的神经元凋亡的影响Fig.1 Effect of PMG on H2O2-induced neuronal apoptosis induced by TUNEL staining
2.3 BDNF/TrkB信号通路激活参与PMG对H2O2诱导神经元氧化应激损伤的保护
2.3.1 MTT法检测BDNF/TrkB信号转导通路阻断剂K252a对细胞存活率的影响
细胞培养至7天,生长状态良好,在PMG预处理组神经元培养基中预先加入BDNF/TrkB信号转导通路阻断剂K252a 2 h后,再按照前文所述的类似步骤进行加药物和MTT检测。MTT检测结果如图3所示:与对照组相比,K252a组细胞存活率没有明显下降;与PMG+H2O2预处理组相比较,当加入K252a后,PMG+H2O2+ K252a组神经元细胞的存活率大幅度下降(P<0.01),PMG失去了原有的保护作用,说明PMG的保护作用与BDNF/TrkB信号转导通路激活密切相关,推测PMG通过上调BDNF及其磷酸化受体TrkB的表达发挥其保护作用。
2.3.2β-Tubulin III染色显示PMG和K252a对细胞骨架形态的影响
培养7天的细胞用β-tubulin III进行荧光染色标记,能反映不同实验组神经细胞骨架形态的变化。β-Tubulin III阳性染色为绿色网状细胞突起,较好地显示细胞骨架的形态。我们的实验结果从图4中看出,对照组正常神经元轴、树突细长和密集,排列有序,交织成网络;H2O2损伤组β-tubulin III阳性神经元显著减少,被β-tubulin III标记的突起稀少和不同程度的断裂弯曲,排列紊乱,不形成网络。而经过PMG+ H2O2预处理组的神经元骨架形态保持相对完整,说明PMG可以通过维护神经元内微管蛋白β-tubulin III的正常形态及表达来有效抑制H2O2诱导的神经元骨架形态损伤。与PMG+H2O2预处理组相比,加入BDNF/TrkB信号转导通路阻断剂K252a,PMG+H2O2+K252a组细胞骨架显示损伤状态,PMG失去了原有的维护神经元骨架形态完整性的作用,说明PMG维护神经元骨架的正常形态与BDNF/TrkB信号转导通路激活相关。

图2 不同处理组量化的凋亡细胞 百分率(TUNEL阳性细胞)统计图Fig.2 Statistics of percentage of apoptotic cells (TUNEL positive cells) quantified by different treatment groups注:*与Control组相比较,*P<0.05;**P<0.01; ***P<0.001。Note:*Compare with control,*P<0.05;**P<0.01; ***P<0.001.
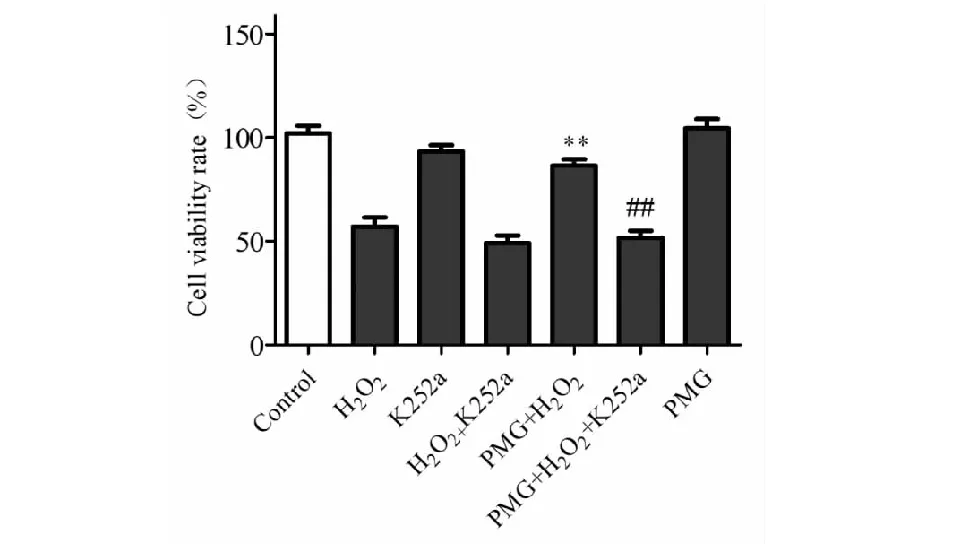
图3 K252a逆转PMG对H2O2诱导神经元氧化 应激损伤细胞存活率的影响(n=6)Fig.3 Effect of K252a reversal of PMG on H2O2-induced neuronal oxidative stress-induced cell viability (n=6)注:*与H2O2损伤组比较,*P<0.05;**P<0.01; ***P<0.001;#与PMG+H2O2组相比较, #P<0.05; ##P<0.01;###P<0.001。Note:* Compare with the H2O2 injury group,*P<0.05; **P<0.01; ***P<0.001; # compare with PMG+H2O2 group, #P<0.05; ##P<0.01;###P<0.001.

图4 β-tubulin Ⅲ染色观察PMG和K252a对H2O2诱导神经元损伤细胞骨架形态的影响(10×20)Fig.4 Effect of PMG and K252a on the cytoskeleton morphology of H2O2-induced neuronal injury by β-tubulin III staining (10×20)注:β-tubulin Ⅲ 显示为绿色细胞突起。Note:β-tubulin III shows green cell protrusion.
2.3.3 Western blot检测PMG对H2O2诱导神经元氧化应激损伤中BDNF和P-TrkB蛋白表达量的影响
通过Western blot法对不同处理组BDNF和其磷酸化TrkB蛋白表达量的检测如图5显示,与正常对照组相比,H2O2处理组BDNF和P-TrkB表达下降;而PMG+H2O2预处理组扭转了H2O2处理组引起的BDNF和P-TrkB表达量的下降 (P<0.001);加入BDNF/TrkB信号转导通路阻断剂K252a后,PMG+H2O2+K252a处理组BDNF和P-TrkB表达下调(P<0.01)。实验结果表明:加入K252a后,通过MTT和Western blot法检测发现PMG原有的保护作用失效,BDNF和P-TrkB表达下降(P<0.01),由此推测,BDNF/TrkB信号转导通路介导了PMG对H2O2诱导的神经元氧化应激损伤的保护作用, BDNF是该过程中的重要因子,BDNF可能通过调控下游信号分子蛋白的表达来实现这一作用的。

图5 Western blot法检测PMG对H2O2诱导神经元损伤中BDNF蛋白表达量的影响(n=5)Fig.5 Western blot assay for the effect of PMG on the expression of BDNF protein in H2O2-induced neuronal injury (n=5)注:A为Western blot法检测BDNF和P-TrkB蛋白表达,B、C为光密度统计分析结果。*与H2O2损伤组比较,***P<0.001; #与PMG+H2O2组比较, ##P<0.01。Note:A is the Western blot method for the detection of BDNF and P-TrkB protein expression,B and C are the results of optical density statistical analysis.*Compared with the H2O2 injury group,***P<0.001;#Compared with the PMG+H2O2 group,##P<0.01.
3 讨论
氧化应激是目前神经损伤研究的一个热点方向,其主要机理是有害刺激引起机体氧化-抗氧化之间的失衡,ROS大量积累,造成钙稳态的失调、细胞色素C的过量释放以及脂类的过氧化,造成神经细胞的死亡[11,12]。研究表明,阿尔兹海默症(Alzheimer’s disease,AD)[13]等神经退行性疾病都与氧化应激损伤有关。过氧化氢(H2O2)是氧化应激模型常用的损伤药物,通过氧化应激作用可能诱导多种细胞的凋亡[11]。
BDNF/TrkB信号通路与神经发生、发育以及疼痛密切相关,而且参与抑郁症等神经疾病的发生发展,BDNF/TrkB控制着下游多个信号转导通路的表达[14,15],在AD患者大脑海马和皮质内BDNF的mRNA水平和蛋白质含量都有降低,提示BDNF可能与AD的发生发展相关[14]。正常老化和AD患者脑中磷酸化TrkB的表达也减少[16]。BDNF与高亲和力的TrkB结合后可以激活MEK/ERK/RSK、PI3K/Akt和Ca2+/CAM/CAMK信号通路[17],诱导CREB磷酸化,从而激活BDNF等神经营养因子的转录[18],促进突触可塑性、增加神经元活性及神经发生[9]。k252a 是一种特异性TrkB的抑制剂,能使 TrkB受体不能磷酸化而发挥作用,阻断了BDNF/TrkB 信号传导通路[19]。因此,在研究中常配合相关药物使用该抑制剂,结合实验结果验证药物发挥作用是否是通过影响BDNF/TrkB信号转导通路实现。
本研究中,我们在前期研究工作基础上,将原代培养的1日龄SD大鼠乳鼠海马神经元与H2O2培养一段时间后进行MTT检测,并采用TUNEL法观察细胞凋亡的形态改变。结果表明,与对照组相比,H2O2可以诱导神经元损伤,而与H2O2损伤组相比,PMG预处理组细胞存活率升高而凋亡细胞数量明显较少,说明了PMG对H2O2诱导大鼠乳鼠海马神经元氧化应激损伤具有一定的保护作用。为进一步探讨BDNF/TrkB信号转导通路对PMG保护作用的影响,本实验向细胞培养基中加入BDNF/TrkB信号转导通路阻断剂K252a,并使用MTT、β-tubulin Ⅲ荧光染色和Western Blot法等进行相关的检测。实验结果表明,与对照组相比,K252a组细胞存活率没有明显下降;与PMG+H2O2预处理组相比较,当加入K252a后,MTT检测PMG+H2O2+K252a组神经细胞存活率大幅度下降(P<0.01),β-tubulin Ⅲ荧光染色显示细胞骨架形态呈损伤状态,PMG失去了原有的保护作用;同时,Western blot检测发现PMG预处理组能逆转H2O2损伤神经元的BDNF和P-TrkB表达量下调(P<0.001),当加入K252a后,PMG+ H2O2+K252a处理组BDNF和P-TrkB表达明显下调(P<0.01)。实验结果表明,PMG的保护作用与BDNF/TrkB信号转导通路激活密切相关。PMG可以阻止H2O2氧化应激诱导的BDNF和磷酸化的受体TrkB表达量的下降,BDNF是该过程中的重要因子。
综上所述,PMG对H2O2诱导的大鼠海马神经元氧化应激损伤具有拮抗作用,其机制可能是通过激活BDNF/TrkB通路,上调BDNF及其磷酸化的受体TrkB表达量,维护神经元骨架的正常形态得以实现,实验结果为临床使用以及进一步开发何首乌苷的药用价值提供了参考。
