基于液相色谱-质谱联用技术的妊娠期糖尿病患者脐带血代谢组学网络分析
2019-07-31张雪芹申河清
吴 衍,张 西,张 洁,张雪芹,申河清
(1.中国科学院城市环境研究所,中国科学院城市环境与健康重点实验室,厦门 361021;2.中国科学院大学,北京 100049;3.厦门市妇幼保健院,厦门 361003)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是常见妊娠期并发症,其定义为妊娠期间首次检测出不同程度的糖代谢异常。流行病学研究[1]指出,我国城镇地区妊娠期糖尿病的发病率在1999~2012年间增加3倍。虽然GDM患者在分娩后糖代谢异常能够恢复至正常水平,但其患糖尿病风险相较正常孕妇有增加的趋势,同时围产期GDM导致的糖脂代谢异常也会对子代远期健康产生不利影响[2]。目前研究认为胰岛素抵抗是导致GDM的重要原因。孕妇通过早期脂肪组织积累以及围产期脂肪分解加强来满足胎儿生长的需要,而脂质代谢过程的变化直接影响胰岛素分泌以及胰岛素抵抗水平的改变[3]。其中,围产期胰岛素对于脂质分解的抑制作用减弱在GDM孕妇中更为明显,并且其效应会进一步导致GDM孕妇餐后脂肪酸累积、肝葡萄糖增加以及更为严重的胰岛素抵抗[4]。此外,孕妇脂肪酸小分子可以通过胎盘直接供给胎儿,但对于复杂的脂质则需要通过特定滋养层脂肪酶水解才能通过胎盘转运,因此母亲代谢状态的改变往往会影响胎儿各类代谢物水平和代谢稳态的改变,进而导致如巨大儿、血液中必要元素缺乏、呼吸窘迫综合征和室间隔增厚等疾病风险的增加[5,6]。虽然通过GDM胎盘基因层面的研究表明,与能量代谢相关的49个基因表达发生了变化,但对于GDM条件下母婴界面代谢的分子机制尚不明确[7]。
近年来,随着色谱分离、质谱检测以及数据处理能力的不断增强,基于液相色谱-质谱联用技术构建的代谢组学平台在疾病诊断、药物作用机制以及病理机制研究中发挥着越来越重要的作用[8,9]。代谢物作为基因的下游产物,能够最直接反应疾病与健康之间的表型差异,并且基因、转录、蛋白质层面的差异能够在代谢层面上被放大表达[6]。同时,对于包括饮食、生活习惯、生存环境、药物使用等环境因子作用下生物体表型的差异,代谢组学也能够很好地说明。本课题组[10]前期对于胎便代谢组学的研究也发现,GDM条件下胎儿的氨基酸与脂质代谢存在差异表达。在此基础上,本研究通过非入侵性样品脐带血探究GDM条件下母婴界面之间代谢轮廓的变化,并结合网络分析探究差异代谢物在母婴代谢网络中的作用,这将有助于理解GDM对子代代谢网络构建的影响,为孕期并发症的预防和治疗提供理论依据。
1 实验部分
1.1 试剂与仪器
UPLC-Q-Exactive超高效液相色谱-质谱联用仪(美国Thermo公司);Waters ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.7 μm,美国Waters公司);Milli-Q超纯水系统(德国Merck公司)色谱纯;甲酸和甲醇(色谱纯,德国Merck公司);高速冷冻离心机(德国Eppendorf公司);真空浓缩仪(美国Thermo公司)。
1.2 脐带血样品收集与制备
本研究通过中国科学院城市环境研究所以及厦门妇幼保健院伦理委员会批准。研究人群是横断面研究(n=2 602)中的巢式病例对照研究。所有参与者都签署知情同意,并且样品排除了包括B组溶血性链球菌感染、异常子宫、α地中海贫血、胎膜早破、甲状腺功能障碍、胎盘障碍、子痫前期、巨大胎儿、胎儿窘迫、高血压、早产、肩难产等消除混杂因素的影响。所有孕妇均为足月自然分娩孕妇。最终确定了106例孕妇最为研究对象,通过病例回溯,其中31例GDM孕妇作为GDM病例组,而75例无明显围产期并发症孕妇作为健康对照。脐带血样品在孕妇分娩后采集,血液样品静置2 h后,以3 000 r/min的速度离心10 min后取上清液,于-80 ℃保存。
根据文献方法[11],采用甲醇-血清体系提取代谢物并沉淀蛋白质,血清样品解冻后取100 μL于离心管中,加入300 μL甲醇,涡旋1 min。于4 ℃以12 000 r/min的速度离心15 min,取上清液于离心管中。上清液于真空离心浓缩仪中浓缩至干燥。将干燥后的提取物复溶于100 μL甲醇-水(1∶1,v/v)中,涡旋1~2 min至完全溶解,于4 ℃以12 000 r/min的速度离心15 min,取上清液于液相色谱瓶中待上机检测。从每个血清样品中取等量并混合,制备为质量控制(QC)样品待上机检测。
1.3 色谱与质谱条件
代谢组学色谱分离采用反向液相分离体系,根据文献方法[11,12],采用甲醇-水体系分离血清代谢物,进样量为5 μL,柱温为40 ℃,样品室温度为4 ℃。流动相A为含有0.1%(体积分数,下同)甲酸的超纯水,流动相B为含0.1%甲酸的甲醇,流速0.3 mL/min。洗脱梯度:0~1.0 min,100%A;1.0~21.0 min,100%A ~95% B;21.0~22.0 min,95%B~100%B;22.0~24.0 min,100%B;24.0~24.1 min,100%B~100%A;24.1~25 min,100%A。电喷雾离子源分别采用正模式(ESI+)和负模式(ESI-)采集数据,全扫描模式下设定其分辨率为70 000,质谱扫描范围为m/z70~1 000。喷针电压在正负模式下均为3 500 V。通过QC样品对仪器稳定性进行评估,样品使用随机进样顺序,QC样品平行穿插于整个分析队列中,每测定20个样品测定1次QC样品及空白溶剂。二级质谱碰撞能量分别为25、35和45 eV。

表1 GDM病例和健康对照孕妇的人口学及临床指标Table1 Demographic and clinical data of GDM(gestational diabetes mellitus)case and healthy pregnant women control
p:the statistical significance was assessed using the Mann-Whitney U test.BMI:body mass index.
1.4 数据处理
LC-MS离子信息通过Compound Discovery软件(CD,美国Thermo公司)实现包括峰提取、峰对齐、未知物的检测、未知物组成预测以及数据库匹配,并且软件提供了最后的离子特征峰信息。通过QC-RLSC(quality control-robust LOESS signal correction)模型进行QC校正后,获得的离子信息进行求和归一化,并导入SIMCA-P 14进行主成分分析(PCA)以及正交偏最小二乘判别分析模型(OPLS-DA)[11,13]。人内源性代谢物鉴定基于HMDB数据库分析。Spearman相关性分析、均值检验以及变化倍数计算基于MetaboAnalyst在线平台和SPSS软件(Version 18);网络分析模型采用Gephi软件;多元线性回归采用R语言。本研究设定p<0.05具有统计学意义。
2 结果与讨论
2.1 人口学及临床指标
参与的106名母亲均为足月自然分娩,具体人口学与临床指标如表1所示。其中,产妇年龄主要集中在25~31岁(占总人群数的25%~75%),孕前身体质量指数(BMI)指数为(20.35±3.13)kg/m2(中位数±标准差)。与此前流行病学研究[14]一致,研究人群中年龄和孕前BMI在疾病对照组间存在显著性差异。即使排除了其他围产期并发症等混杂因素的影响,BMI和GDM之间相关性依然存在,说明产前母亲肥胖与GDM之间的相关性相对独立。因此,孕妇产前超重或肥胖导致的代谢环境的改变可能是GDM发病的一个重要因素[15]。
2.2 血清代谢物谱差异分析
利用UPLC-Q-Exactive-MS平台,采用正负两种离子源模式采集脐带血代谢物质量信息,代谢轮廓谱图如图1所示。本研究利用QC-RLSC模型校正因仪器长时间运行产生的信号误差。QC样品在非监督学习模型PCA得分图中明显聚类且聚类范围较小,说明仪器测定离子信息保留时间和离子强度重现性好,数据满足代谢组学分析要求(见图2)。
基于CD软件提取离子特征峰信息,通过HMDB数据库比对,本研究确认了136个内源性代谢物,其中与脂质代谢和氨基酸代谢相关的内源性代谢物分别占37.5%和30.8%。内源性代谢物种类鉴定说明母婴代谢物质交换过程中氨基酸和脂质类代谢物是重要的组成部分,并且已有研究表明GDM产妇脐带血中支链氨基酸、芳香族氨基酸以及脂肪酸含量与健康产妇脐带血中的含量有明显差异[4]。
为了说明GDM孕妇脐带血的代谢变化,并且减少代谢物相互关系对于差异代谢物判别能力的影响,本试验采用OPLS-DA鉴定不同表型下显著的差异代谢物。如图2所示,OPLS-DA结果表明,GDM孕妇与健康孕妇之间脐带血代谢轮廓存在明显差异。根据均值检验、变化系数以及判别式模型重要性分析结果鉴定出与脂质代谢相关的5个代谢标志物,包括四氢可的松(tetrahydrocortisone)、花生四烯酸(arachidonic acid,AA)、酮基胆固醇(7-ketocholesterol)、胆甾-4,6-二烯-3-酮(cholesta-4,6-dien-3-one)以及酰肉碱(9,12-hexadecadienoylcarnitine,acyl carnitine C16∶2)(见表2)。同时,GDM代谢标志物分析表明,5个差异代谢物在GDM孕妇脐带血中显著降低,这也说明GDM表型下母婴界面脂质代谢稳态的异常变化(见图3)。

图1 脐带血清代谢轮廓谱图Fig.1 Metabolic profiling of umbilical cord serum Control:healthy pregnant woman metabolome;case:GDM pregnant woman metabolome.
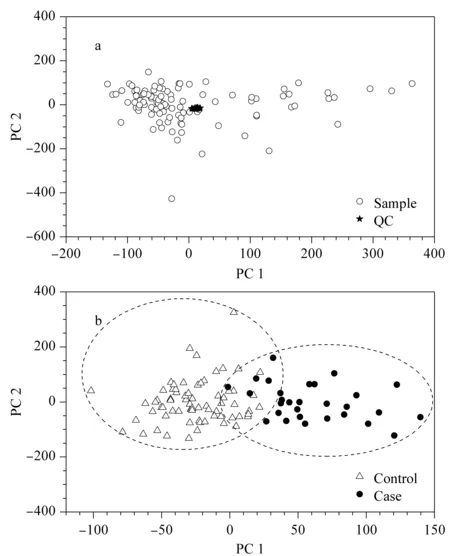
图2 脐带血清代谢组分析Fig.2 Umbilical cord serum metabolomics analysis a.metabolic profiling of umbilical cord serum;b.quanlity control (QC)clustering results in principal component analysis (PCA)score plots;c.metabolome OPLS-DA (orthogonal partial least squares discriminant analysis)score plots of umbilical cord serum.In PCA,the circles and the stars are umbilical cord blood samples and QC,respectively.In OPLS-DA,the black dots and the triangles are GDM cases and health control,respectively.Sample:GDM case sand health pregnant woman control metabolomes.
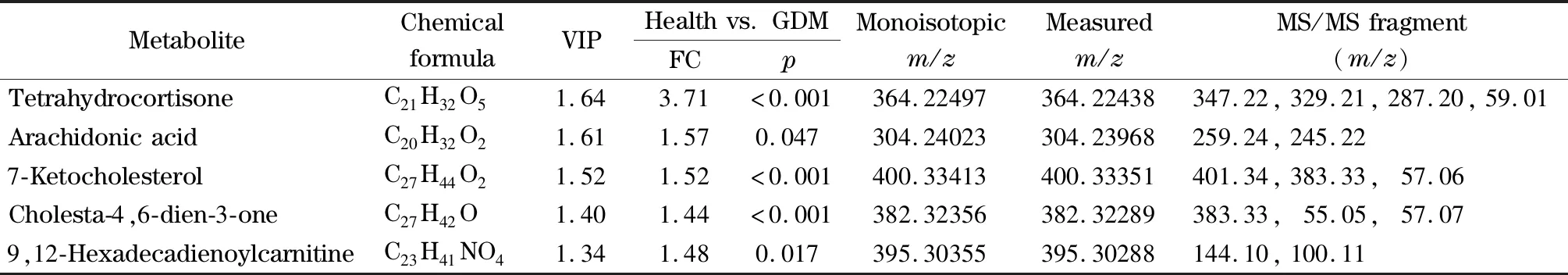
表2 GDM的代谢标志物Table2 GDM metabolic markers
VIP:variable influence on projection;FC:fold change between healthy control and GDM case groups;p:the statistical significance was assessed using the Mann-Whitney U test.

图3 GDM标志代谢物小提琴图Fig.3 Violin plot of GDM metabolic markers * indicates p<0.05;** indicates p<0.01.The red columns represent MS/MS fragments (from Table 2)which match the HMDB database.
2.3 标记代谢物与脂质代谢网络关系
与核磁共振波谱法和气相色谱-质谱技术相比,液相色谱-质谱联用平台对于血液和尿液中代谢物检测覆盖度更广,这也为网络分析提供了可能性。本研究的GDM代谢标志物与脂质相关,因此构建GDM代谢标志物的脂质代谢网络能够进一步说明GDM母亲脐带血的代谢变化。基于Spearman相关性结果,设定相关系数阈值(β0=0.5)考察中等相关强度的核心代谢网络。利用OpenOrd算法剔除非相关独立节点,通过力导向布局算法ForecAtlas2构建脂质代谢拓扑网络。如图4a所示,其中溶血卵磷脂和脂肪酸类代谢物构建起核心脂质代谢网络,而在妊娠期糖尿病孕妇胎盘基因表达的研究中也发现与能量代谢相关的49个明显变化的基因中有67%与脂质通路相关,而与葡萄糖代谢通路有关的基因仅占9%[7]。同时,代谢标志物中花生四烯酸(AA)与核心代谢网络相关性较强,而其他代谢标志物与脂肪酸能量代谢过程中的三羧酸循环通路相关。通过网络模块化分析表明(模块解析度1.5),GDM孕妇脐带血代谢标志物中花生四烯酸的变化会直接影响其通路相关代谢物白三烯A4(LTA4)、前列腺素E2(PGE2)的变化(见图4b)。
进行网络节点重要性分析(网络加权度),结果如图4所示,网络节点大小与其在脂质代谢网络中重要性成正比,表明GDM标记代谢物中花生四烯酸(AA)与脂质代谢网络的重要节点显著相关。同时,在BMI和年龄作为校正因素下,多元线性回归模型的结果也表明脐带血中AA含量与母亲是否患有GDM存在显著相关性(见表3)。

图4 脂质代谢网络分析Fig.4 Network analysis of lipid metabolism a.correlation between the metabolic biomarkers and the key network of lipid metabolism.The red and green dots were GDM metabolic biomarkers and key metabolic network nodes,respectively.b.module analysis of the lipid metabolism network.The different colors correspond to different modules using modularization analysis of metabolic networks.AA:arachidonic acid;EPA:eicosapentaenoic acid;PGE2:Prostaglandin E2;LTA4:leukotriene A4.
表3 GDM代谢标志物脂质代谢网络重要性分析Table3 Weight analysis of GDM metabolic markers in the network of lipid metabolism
pwas tested using multiple linear regression,and the adjustment factors were BMI and age.
2.4 脐带血代谢标记物相关的代谢过程
本研究发现GDM条件下,母婴交互界面中不饱和脂肪酸代谢发生了显著性变化,其中生物标志物花生四烯酸在GDM脐带血中含量明显偏低(见图3),并且其代谢过程对于整体脂质代谢网络影响较为显著。相关分子生物学研究[16]表明,细胞膜磷脂脂肪酸的成分对于胰岛素分泌及其自身生物学效应都有重要的作用,特别是AA以及二十二碳六烯酸(docosahexaenoic acid (22∶6n-3),DHA)对胰岛素抗性的影响。同时,部分研究[5,17]通过比较健康和GDM母亲血清和脐带血中非饱和脂肪酸含量也表明,GDM母亲血液以及脐带血中AA与DHA的含量显著偏低,但是GDM母亲脐带血中饱和脂肪酸的比例明显升高。虽然没有证据表明是胎盘转运或者是母亲自身代谢异常导致脂质组分的变化,但是包括AA与DHA在内的n-6和n-3不饱和脂肪酸在脐带血中含量的减少会导致胎儿对相应脂肪酸利用率的增强,而其代谢稳态的改变可能会影响子代长期健康状态[5]。另一方面,本研究发现在AA影响的核心网络中,溶血磷脂酰胆碱(LPC)也是其中一个重要组成部分,而目前LPC代谢在孕期对母婴健康的影响还尚未确定。
3 结论
本研究通过液相色谱-质谱对人脐带血血清代谢组学研究,鉴定了与脂质代谢相关的5个潜在生物标志物。通过标志物与GDM脐带血脂质代谢物的表达网络分析说明,GDM条件会对母婴之间脂质代谢特别是不饱和脂肪酸产生影响。本研究提供了评估代谢标志物生物学权重的新思路,发挥液相色谱-质谱优势,提高了代谢组学数据的利用率,同时也为组学在GDM病理研究和治疗以及多组学结合的精准医学提供了可行的方法。
