2型糖尿病临床血清样本的内源性多肽定量组学分析
2019-07-31张红燕彭佳喜赵兴云周孝禹万丽红吴仁安
牛 欢,张红燕,彭佳喜,王 莉,赵兴云,周孝禹,万丽红,吴仁安*
(1.中国科学院大连化学物理研究所,辽宁 大连 116023;2.中国科学院大学,北京 100049)
糖尿病是一种由多种因素引起糖代谢稳定功能受损而致高血糖为主要特征的全身性代谢紊乱综合征,患者高血糖的形成与肝脏、胰脏、肠道、脂肪肌肉组织、肾脏、脑等多脏器的功能失调相关,已成为严重危害人类健康的全球性流行的多发疾病[1,2]。血糖控制的失稳可导致多种糖尿病并发症,如:并发心脑血管、肾脏、视网膜及神经系统的慢性病变和各种感染,严重时可发生酮症酸中毒等,甚至导致残疾或死亡[3]。据统计,我国已成为全球糖尿病第一大国,目前糖尿病人数已超过1亿,其中,1型糖尿病主要由自身免疫系统损害所致,约占糖尿病患者总数的5%;2型糖尿病(T2D)主要以胰岛素抵抗和胰岛β细胞功能受损为特点,患者数约占糖尿病患者总数的90%[4]。糖尿病的早发现、早诊断及早治疗对于病情的延缓和控制至关重要。在分子水平上呈现、跟踪糖尿病发生发展过程中的变化分子谱图,对糖尿病临床诊断、分子分型及病理过程的理解可提供更加全面的数据支持。
随着系统生物学的发展,组学分析技术已发现部分蛋白质、糖、脂质、代谢物等生物分子在糖尿病中异常表达,可以作为糖尿病的潜在分子标志物[5-8]。内源性多肽是相对分子质量小于10 kDa的多肽或蛋白质水解片段,是细胞合成、调控等过程的重要内源性生物分子,能够反映机体基因表达的变化,也能引起相应新陈代谢活动的改变[9-11]。多肽组学作为一门系统性、全面性研究内源性多肽结构、功能及变化规律的学科,是蛋白质组学的重要补充,也是目前的热点研究领域[12-15]。血清中含有丰富的内源性多肽,可实时反映人体生理、病理状态的变化和特性,被认为是最有价值的生物标本之一。血清内源性多肽组的研究对于疾病标志物的筛选、早期诊断、疾病动态监测及治疗具有重要的临床意义,已受到研究者的广泛关注[16-18]。针对白血病,有研究者采用弱阳离子交换磁珠对血清内源性多肽进行纯化并结合基质辅助激光解吸-飞行时间质谱(MALDI-TOF-MS)鉴定技术,对比分析了急性淋巴细胞白血病患者和健康对照者血清样本的内源性多肽组,筛选出33条差异多肽[19]。此外,葡萄膜黑色素瘤[20]、儿童自闭症[21]及脓毒症[22]等多种疾病研究中也通过多肽组学技术鉴定到潜在的血清内源性多肽标志物。针对2型糖尿病,Wang等[23]通过对糖尿病患者和健康对照者血清样本的内源性多肽组的分析,鉴定到6条差异多肽,可作为诊断2型糖尿病的潜在多肽标志物。在临床样品分析的多肽组学技术中所使用的MALDI-TOF-MS定性定量分析准确性往往较差,而液相色谱-串联质谱(LC-MS/MS)能够提供较为稳定、精确的多肽定性定量结果。本工作应用低浓度乙腈辅助超滤联合LC-MS/MS的定量多肽组学技术,对临床上健康组、糖尿病前期组及2型糖尿病组的血清样本的内源性多肽组进行对比分析,筛选识别糖尿病发展过程中的差异内源性多肽,旨在寻找2型糖尿病早期诊断及分子分型的多肽分子标志物。
1 实验部分
1.1 试剂与材料
截留相对分子质量为10 kDa的离心超滤管购于Millipore公司(美国);甲酸(formic acid,FA)购自Sigma-Aldrich公司(美国);23例人血清样品(包括7例健康者血清样本、7例糖尿病前期患者血清样本和9例2型糖尿病患者血清样本)来自上海第六人民医院。实验用的乙腈为色谱纯(Merck公司),实验用水全部经Milli-Q(Millipore,美国)处理。
1.2 样本的采集与预处理
血液样品采集后保存于-80 ℃冰箱。糖尿病前期患者和2型糖尿病患者由专家确诊或排除,3组受试人群的年龄、体重指数(BMI)、血糖等指标均相匹配。血液样品获得当地医院伦理委员会的批准,所有受试者都签署知情同意书。样本临床信息见表1。
血清内源性多肽的提取采用低浓度乙腈辅助超滤离心法。具体操作流程如下:从-80 ℃冰箱中取出血样并在冰浴中解冻,涡旋混匀,20 000 g离心5 min,弃去脂质。每例血清样本取25 μL于1.5 mL离心管中,加入125 μL去离子水稀释并煮沸变性5 min。待温度冷至室温后,加入150 μL 40% ACN(含0.1% FA)溶液使乙腈终体积分数为20%,涡旋混匀并于冰浴中静置40 min。然后将样品转移到截留相对分子质量为10 kDa超滤管中,在6 000 g、4 ℃条件下离心20 min,并用300 μL 20% ACN(含0.1% FA)溶液清洗滤饼两次。收集滤液,冷冻干燥,经C18 SPE柱除盐后,储存在-80 ℃冰箱中备用。进样分析前,样品复溶到25 μL 0.1% FA溶液中,涡旋混匀2 min,在20 000 g、4 ℃条件下离心5 min,取上清液置于进样瓶中用于nano-LC-MS/MS分析。

表1 血液样本的临床信息Table1 Clinical information of blood samples
1.3 LC-MS/MS分析
LC-MS/MS数据采集由nano-RPLC-MS/MS系统完成。该系统由四元梯度泵的高效液相色谱(Ultimate 3000)、自动进样器和线性离子阱-静态轨道阱(LTQ-Orbitrap Elite)组成,采用3 cm长的C18预柱(200 μm i.d.)辅助自动进样,样品首先保留到预柱上,然后经梯度洗脱到分析柱上(150 μm i.d.,14 cm)进行分离,质谱鉴定。
液相色谱流动相组成:A相为0.1%的FA水溶液,B相为80% ACN(含0.1% FA)溶液。分离梯度设为:0~10 min,2%B;10~13 min,2%B~5%B;13~73 min,5%B~28%B;73~88 min,28%B~45%B;88~89 min,45%B~95%B;89~94 min,95%B;94~95 min,95%B~2%B;95~105 min,2%B。流动相流速为0.5 μL/min。
质谱条件:LTQ离子传输管的温度设为275 ℃,电喷雾电压设为2.7 kV。所有的数据采集模式均为数据依赖模式(data-dependent mode,DDA),质谱全扫描在Orbitrap中采集,扫描范围为200~2 000 Da,分辨率设为12 000。二级质谱扫描在LTQ中采集,采用碰撞诱导解离(CID)碎裂方式。利用Xcalibur软件(version 2.1,Thermo公司)进行系统控制和数据收集。
1.4 质谱数据检索分析
LTQ-Orbitrap质谱仪所采集的质谱数据利用Mascot(Version 2.6.0)软件进行数据检索,检索数据库为人源库(UniProt,约17万个蛋白质)。检索参数设为:甲硫氨酸残基(+15.994 9 Da)为可变修饰,无酶切,母离子质量误差为20 ppm,二级碎片离子误差为0.8 Da。多肽筛选门槛设定如下:得分值高于20,假阳性率(FDR)小于1%。多肽定量采用MaxQuant软件(http://maxquant.org/,version 1.6.1.0)进行数据分析。假阳性率(false discovery rate,FDR)为0.01。
1.5 生物信息学和统计学分析
将MaxQuant软件所得的肽段信号强度导入Perseus软件进行过滤无效值、对数变换、正态分布以及缺失值补齐等数据前处理。采用悟空平台(https://www.omicsolution.org/wu-kong-beta-linux/main/)构建PLS-DA模型及非参数检验。使用在线数据库Panther和String分别对差异肽段匹配的蛋白质进行GO功能和KEGG信号通路分析。
2 结果与讨论
2.1 方法评价与表型区分
采用超滤法提取血清内源性多肽时,多肽与蛋白质的结合以及超滤膜的吸附作用会导致严重的多肽损失。为此,本实验对超滤法提取血清内源性多肽过程进行了优化,以低浓度乙腈处理超滤管中被截留的蛋白质组分,改善了多肽回收率。标准多肽回收率测试表明,无低浓度乙腈处理的直接超滤法中,强疏水性多肽(AINVAVHVF、VLDAVRGSPAINVAVHVF、NVHSAGAAGSRMNFRPGVLS)无法被检测到,弱疏水性和亲水性多肽(ATASRGASQAGAPQGR、SSKITHR、RHDWGHEKQ)的回收率均低于40%。而经低浓度乙腈处理后,弱疏水性和亲水性多肽的回收率均提高至90%以上,强疏水性多肽被质谱成功鉴定,回收率也可达约30%~50%。进一步将该方法用于血清内源性多肽的提取中,通过LC-MS/MS可从5 μL健康人血清中鉴定到868条内源性多肽,3针重复可鉴定到598条内源性多肽,是血清直接超滤鉴定数量的2倍,显示了低浓度乙腈辅助超滤在实际样本多肽组深度鉴定中的有效性与可靠性。由此,建立了低浓度乙腈辅助超滤法结合LC-MS/MS的多肽组学分析方法,用于糖尿病3个发展阶段的血清内源性多肽组的分析鉴定。根据Mascot检索结果及MaxQuant定量结果,认为至少一组中有60%以上样本鉴定到的肽段为可靠肽段。对23例血清样本所鉴定的unique peptide取并集,共鉴定到690条可靠血清内源性肽段。构建PLS-DA模型,将实际样品投影到两个主成分组成的二维平面上(见图1),对照组(N组)、糖尿病前期组(preT2D组)和2型糖尿病组(T2D组)之间有明显的分离趋势,表明3类样本在多肽水平上具有显著性差异。
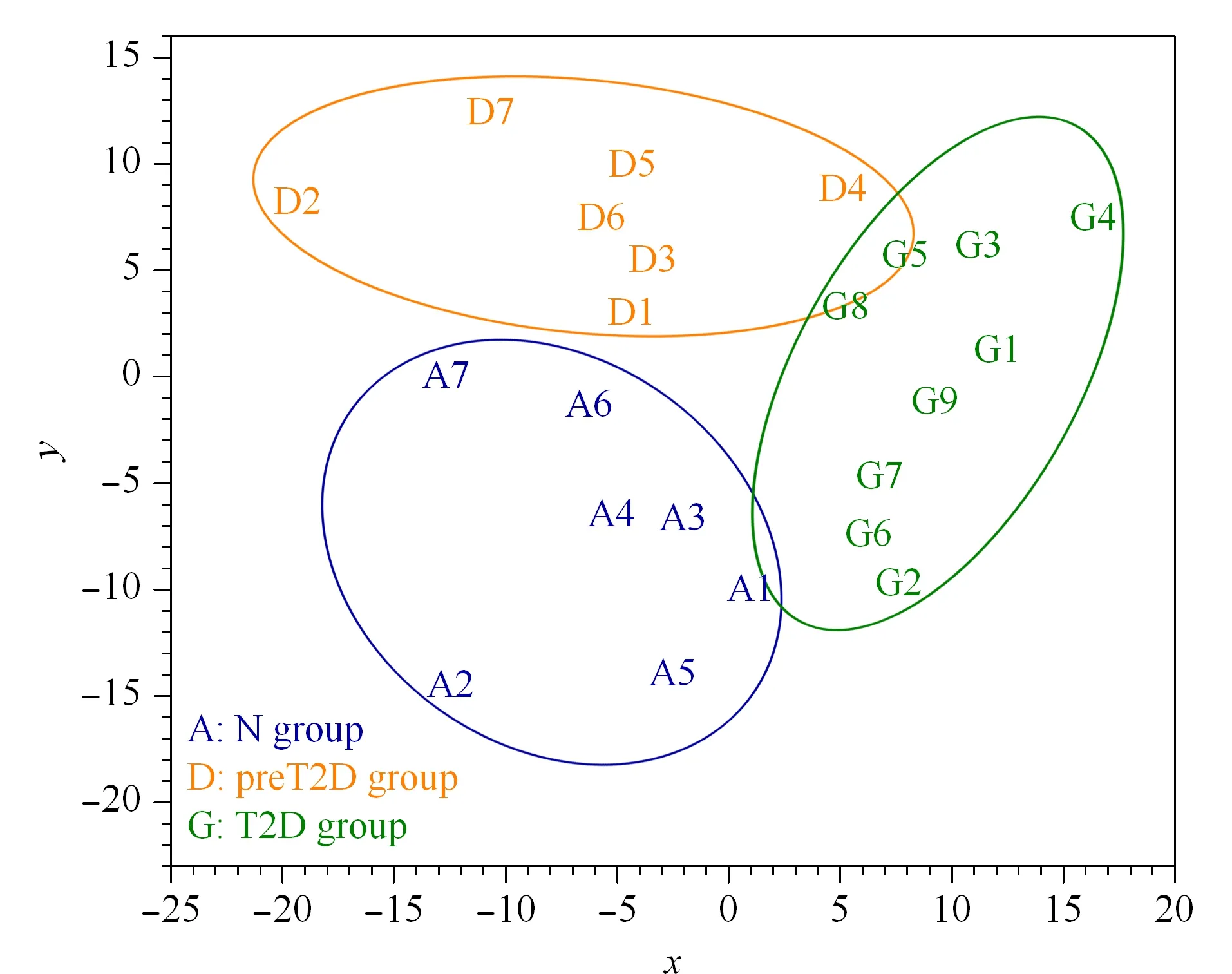
图1 3组样品间构建的PLS-DA模型散点图Fig.1 Partial least squares-discriminant analysis(PLS-DA)score plots for the three groups
2.2 筛选血清内源性差异多肽
2.2.1仅在preT2D组表达和仅在T2D组表达的血清内源性多肽
对这690条可靠肽段进一步分析发现有39条内源性多肽(对应23个蛋白质)仅在preT2D组中被鉴定(表2,上标为a的肽段),有97条内源性多肽(对应43个蛋白质)仅在T2D组中被检测(表2,上标为b的肽段)。

表2 差异多肽及匹配蛋白质的详细信息列表Table2 Detailed information of differential peptides and matched proteins

表2 (续)Table2 (Continued)

表2 (续)Table2 (Continued)

表2 (续)Table2 (Continued)
a:endogenous peptides detected only in preT2D group;b:endogenous peptides detected only in T2D group;-:not significantly changed peptide compared with the normal group.
2.2.2ANOVA方差分析寻找3组间显著性变化的内源性多肽
对3组均鉴定到的内源性多肽(376条)进行ANOVA方差分析(p-value<0.05,fold change>2),发现3组间有27条显著性变化多肽。
对这27条差异多肽做聚类分析并对每个聚类部分的差异多肽在3组中的强度进行统计(见图2),结果显示这些差异肽段主要聚类为4部分(以N组作为参考),包括在T2D组显著性变化的肽段(图2a:下调4条肽段,上调9条肽段)、在preT2D组显著性变化的肽段(图2b:下调3条肽段,上调2条肽段)、在preT2D组和T2D组同时显著性变化的肽段(图2c:1条下调和5条上调的肽段)以及3条在preT2D组上调而在T2D组下调的肽段(图2d)。
将2.2.1节和2.2.2节所得的差异多肽进行汇总,共筛选出163条差异多肽(匹配56个蛋白质),作为进一步研究糖尿病标志物的候选集。它们的详细信息(包括肽段序列、匹配的蛋白质信息以及它们在preT2D组和T2D组的变化趋势)见表2。

图2 3组间显著性变化多肽的强度Fig.2 Intensities of the significantly changed peptides among the three groups a.Cluster that the peptide contents are significantly different (p-value<0.05,fold change>2)only in the type 2 diabetes (T2D)group;b.cluster that the peptide contents are significantly different only in the preT2D group.c.cluster that the peptides are up-regulated or down-regulated in both preT2D and T2D groups;d.cluster that the peptides are up-regulated in the preT2D group but down-regulated in the T2D group.
2.3 血清内源性差异多肽所匹配蛋白质的生物学分析
2.3.1GO功能分析
对这些差异多肽所匹配的蛋白质通过在线数据库Panther进行功能注释分析(见图3)。结果表明这些蛋白质的功能类别主要涉及分子水平的结合、催化、转运、调节,其中结合功能占主导地位;它们多数位于细胞外,也有一部分位于细胞膜以及组织中;所参与的生物学过程主要为代谢、应激、生物黏附、免疫系统、生物调节等过程。

图3 差异多肽所匹配蛋白质的GO分析Fig.3 Gene ontology analysis of the differential peptide matched proteins a.molecular function analysis;b.cellular component analysis;c.biological process analysis.

图4 差异多肽匹配蛋白质的KEGG信号通路分析Fig.4 KEGG signal pathway of differential peptide matched proteins
2.3.2KEGG信号通路分析
将差异蛋白质导入在线数据库String中进行KEGG信号通路分析,结果显示这些蛋白质主要富集在补体(complement cascade)和凝血(coagulation cascade)通路中,共涉及14个蛋白质(见图4)。此外,还有4个蛋白质(APOA1、APOA4、APOC3、APOE)富集在胆固醇代谢(cholesterol metabolism)通路中。补体系统是固有免疫系统的重要组成部分,通过经典途径、旁路途径及凝集素途径被激活,主要介导免疫和炎症过程。补体系统的激活也与胰岛素抵抗存在潜在联系,可能与2型糖尿病及其并发症相关[24,25]。凝血系统在机体中也发挥着重要的作用,尤其是在抵抗感染和维持机体止血方面。糖尿病的发生发展过程也涉及凝血系统的激活,研究发现高血糖可以通过加剧葡萄糖氧化和使线粒体产生活性氧成分而增加氧化应激,损伤血管内膜使病人处于凝血、纤溶等血液病理状态[26,27]。糖尿病患者长期高凝血状态还是其发生心血管疾病脑卒中和栓塞的高风险因素[28,29]。另外,血脂代谢的异常也被报道为2型糖尿病高风险因素以及病理表现特点之一,可以作为糖尿病早期筛查和诊断以及预测糖尿病患者脂质代谢紊乱相关并发症的早期指标[30]。
除此之外,还有包括S100-A8蛋白、凝溶胶蛋白、丛生蛋白、结合珠蛋白、组蛋白H2B型F-S、胰岛素样生长因子结合蛋白3、胸腺素β4、α2-HS-糖蛋白、甲状腺素转铁蛋白等蛋白质可能也参与了2型糖尿病的病理过程。S100-A8蛋白、凝溶胶蛋白主要介导炎症过程,与糖尿病的发生发展密切相关[31-35]。丛生蛋白和结合珠蛋白被报道与糖尿病眼病、肾病等并发症有关[36-39]。胰岛素样生长因子结合蛋白3是一种癌症风险的保护剂,是评估癌症风险的重要因子,具有潜在的应用价值,也与糖尿病相关[40-42]。胸腺素β4具有多重生物学功能,在组织再生、重塑、创伤愈合、维持肌动蛋白平衡、肿瘤发病与转移、细胞凋亡、炎症、血管生成、毛囊发育等生理、病理过程中扮演着极为重要的角色,也可能参与糖尿病病理过程[43]。α2-HS-糖蛋白是先天免疫Toll-like受体(TLR)-4,也可以与胰岛素受体β亚单位相结合来阻止胰岛素受体酪氨酸激酶调节胰岛素信号,从而出现胰岛素抵抗,与T2D的发病关系密切[44]。
3 小结
综上所述,通过对2型糖尿病3个不同发展阶段的血清样本内源性多肽组的定性定量分析,从正常组、糖尿病前期组及2型糖尿病组样品中筛选出163条差异内源性多肽,为2型糖尿病早期筛查、早期诊断及分子分型等生物标志物的发现提供了可能。
