游离亚硝酸预处理对剩余污泥电解及微生物群落结构的影响
2019-07-31刘芝宏魏瑶丽樊雅欣段燕青周爱娟岳秀萍
刘芝宏,魏瑶丽,樊雅欣,段燕青,周爱娟,2,岳秀萍*
游离亚硝酸预处理对剩余污泥电解及微生物群落结构的影响
刘芝宏1,魏瑶丽1,樊雅欣1,段燕青1,周爱娟1,2,岳秀萍1*
(1.太原理工大学环境科学与工程学院,山西 太原 030024;2.香港大学土木工程学院,环境工程研究中心,香港 999077)
为打破传统厌氧发酵周期长,有机质利用率低等瓶颈,增强污泥的资源利用和能源回收,探讨了游离亚硝酸(FNA)预处理对剩余污泥电解效果及微生物群落的影响.对比分析了FNA预处理前后剩余污泥在微生物电解池(MEC)中的电流和氢气产生、溶解性有机物和挥发酸的释放和利用及功能菌群的变化情况.结果表明,FNA预处理能有效地促进剩余污泥在MEC系统中的水解和酸化,其溶解性糖类、蛋白和挥发酸的含量远高于未预处理组,进而促进了水解发酵菌、产电菌及反硝化菌的生长和富集,最终挥发酸利用率均在97%以上,表现为电流(1.9mA)和氢气(0.86mL/g VSS)的增强,分别是空白组的3.8倍和5.1倍.
游离亚硝酸预处理;剩余污泥;微生物电解池;挥发性脂肪酸;氢气;群落结构
剩余污泥作为污水厂生物处理段的伴生产物,其产量随着生产规模的扩大而逐年增加.由于其中含有大量有机物、重金属及病原体,若得不到合理的处置会导致二次污染.厌氧消化(AD)作为有效处理剩余污泥的技术,可通过水解酸化过程将污泥中的有机物转化为挥发酸等小分子有机物,可作为水厂外加碳源或用于产甲烷.但由于微生物细胞的半刚性结构及污泥胞外聚合物(EPS)的包裹,导致厌氧消化水解和酸化过程受限.因此,预处理污泥非常必要.游离亚硝酸(FNA)是一种很强的灭菌剂[1],其及其衍生产物(NO, N2O3和NO2等)能破坏脂质、蛋白质、糖类和脱氧核糖核酸(DNA)[2].金宝丹等[3]和委燕等[4]发现,FNA可有效杀死微生物细胞(41%~80%),增强污泥溶胞.徐雪芹等[5]将FNA预处理后污泥与烟草废物共消化,发现其强化了有机物水解酸化进程并为产甲烷菌提供基质.这些研究均证实了FNA用于污泥预处理强化污泥水解产酸的可行性.
然而,传统的厌氧消化存在发酵时间长,有机物利用率低,能源回收率低等问题[6].微生物电解池(MEC)通过阳极富集的产电微生物(如等)氧化有机物(乙酸、葡萄糖、蛋白质和甘油等),在外接电压(0.2~0.8V)条件下产生电子和质子,分别经外电路和溶液内部进行传输,在阴极结合产生氢气[7].其库伦效率和能源回收效率(氢气)可高达90%和200%以上[8-9].目前MEC普遍使用的缓冲溶液为磷酸盐,引入的过量磷酸盐易导致二次污染.研究表明,使用NaCl溶液作为电解液,仍可得到很好的产电产氢效能[10].
本研究将FNA预处理技术用于MEC产氢系统中,通过促进污泥中有机物在电化学系统中的水解酸化进程为产电菌提供基质,并以NaCl溶液为电解质,研究FNA预处理对MEC电解剩余污泥的影响,包括氢气产量,有机物释放及利用效果,采用高通量测序分析阳极功能菌群,旨在为剩余污泥资源化提供参考.
1 材料与方法
1.1 剩余污泥来源及性质
剩余污泥取自山西省晋中市第一污水厂浓缩池,经4℃条件下静置浓缩24h后弃去上清液,使用40目筛网过滤污泥中的杂质颗粒,置于4℃条件下备用.浓缩后污泥经10000r/min 离心10min,上清液经0.45μm的滤膜过滤,分析测定相关指标.剩余污泥初始性质如表1所示.
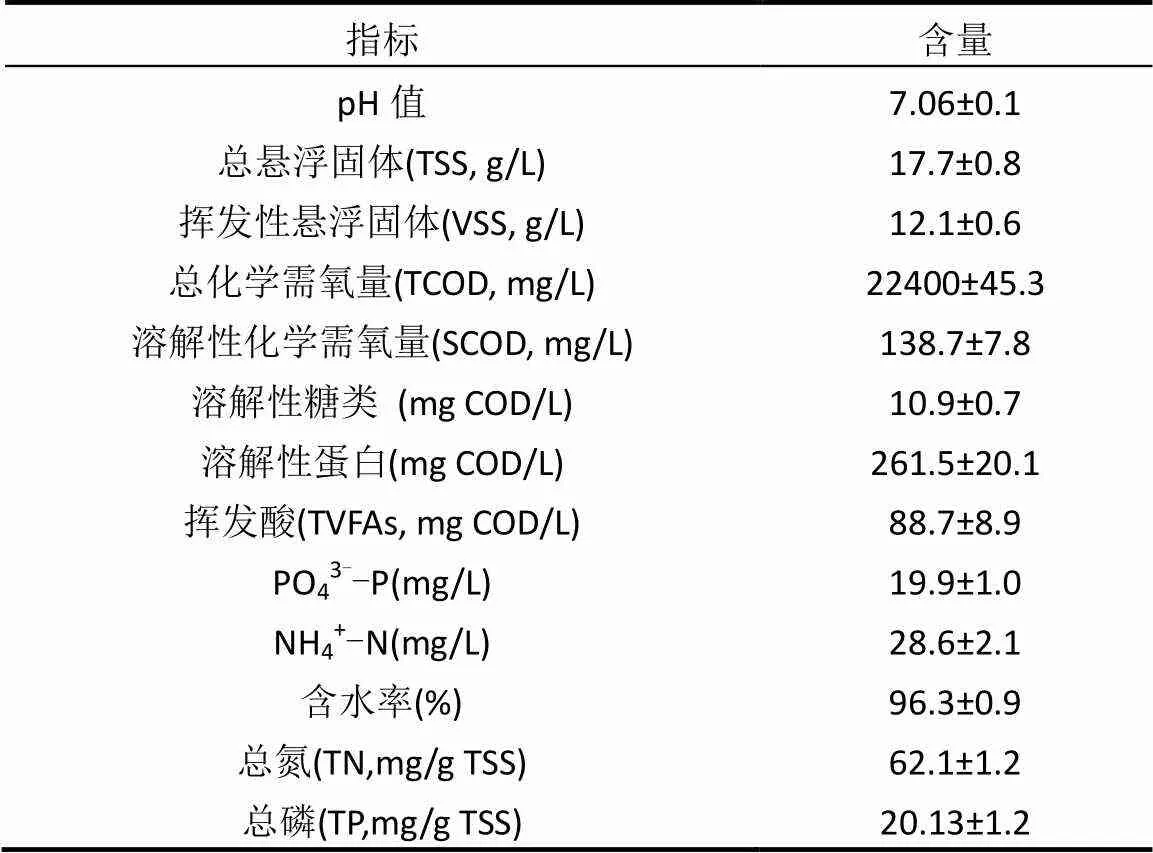
表1 剩余污泥初始性质
1.2 FNA预处理实验
量取900mL剩余污泥进行FNA预处理:加入亚硝酸钠储备液,使污泥中NO2--N浓度为300mgN/L,通过投加1mol/L的盐酸溶液调节pH值为(5.5±0.1),并经公式FNA=NO2--N/(a×10pH)和a=e-2300/(273+T)计算得出污泥中FNA的浓度为2.13mg N/L.将处理后的污泥均匀分配到3个容积为500mL的厌氧反应器中,通入高纯氮气10~15min,以去除反应器中的氧气.将反应器置于恒温震荡培养箱中,在(22±1)℃下连续运行12h后,即得预处理后污泥.
1.3 微生物电解池(MECs)启动及运行
同步启动10个MECs反应器.反应器容积为28mL,阳极和阴极分别为碳刷和涂有Pt-C催化剂的碳布.每个MEC反应器外加0.8V电压,并接10 Ω电阻以计算电流,采用数据记录仪(Keithley 2700)实时监控.启动前3个周期按照与营养液(1500mg/L乙酸钠, 3.6g/L的NaCl溶液,维生素和矿物质溶液)1:9的体积比接种新鲜的剩余污泥,用1.0mol/L的盐酸和氢氧化钠溶液调节混合液的pH值为(7.0±0.1);之后停止接种污泥,将乙酸钠浓度降为1000mg/L,每个周期运行1d,运行10个周期.当反应器电流和库伦效率分别达2mA和90%以上时,即认为反应器启动成功.
在成功启动的MECs中挑选6个运行良好且性能相似的反应器进行电解实验.分别以原污泥(空白组)和FNA预处理污泥(FNA预处理组)与NaCl缓冲溶液以1:1体积比混合后作为MECs反应器基质进行电解,每组设置3个平行.采用数据记录仪实时监控电压,运行周期为3d,探究MECs中有机物变化及产氢性能.
1.4 分析测试方法
TSS、VSS、TCOD、SCOD、PO43--P和NH4+-N、TN和含水率浓度均采用国家标准法测定[11],TP采用SMT分级提取法测定.溶解性蛋白和糖类分别采用BCA试剂盒和苯酚-硫酸法.气体(H2、CH4和CO2)和TVFAs采用气相色谱仪测定,检测器分别为热导检测器(TCD)和氢火焰离子化检测器(FID),以高纯氩气作为载气.电压和电流采用数据记录仪(Keithley 2700),每10min记录一次,库伦效率(E)和氢气产率[H2,m3-H2/(m3×d)]分别采用公式(1)和(2)计算.
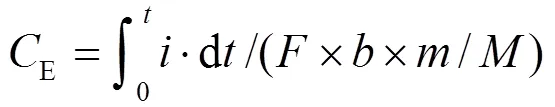
式中:为法拉第常数,96485C/mol;为1mol底物完全氧化的失电子数;为底物消耗的质量,g;为底物消耗的物质的量,g/mol.
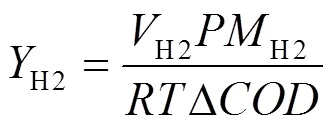
式中:H2为产氢体积,L;为大气压,bar;H2为氢气的分子量,2g/mol;为理想气体常数,0.08314L bar/K mol;为热力学温度;ΔCOD为一定时间内初始和最终点COD的浓度之差,mg/L;H2为底物的分子量,g/mol.
将MEC反应器运行3d后的阳极污泥取样,进行微生物群落分析.污泥样品经DNA提取后,进行PCR扩增.引物选取Miseq测序平台V3-V4区域的通用引物341F和805R.之后采用Illumina测序平台将不同污泥样品进行高通量测序(上海生工).
为便于比较分析,上述测得的有机物浓度(mg/L)均换算为COD浓度(mg COD/L),其转化系数分别为:1.50g COD/g蛋白,1.06g COD/g糖类,1.07g COD/g乙酸,1.51g COD/g丙酸,1.82g COD/g (正/异)丁酸和2.04g COD/g (正/异)戊酸.
2 结果与讨论
2.1 MECs电流及产氢
电流和氢气的产生可反映出MECs的启动和运行程度[12].MECs在启动10个周期后电流高达4.5mA,库伦效率和氢气产率分别为99.8%和105.1%,说明反应器已启动成功.
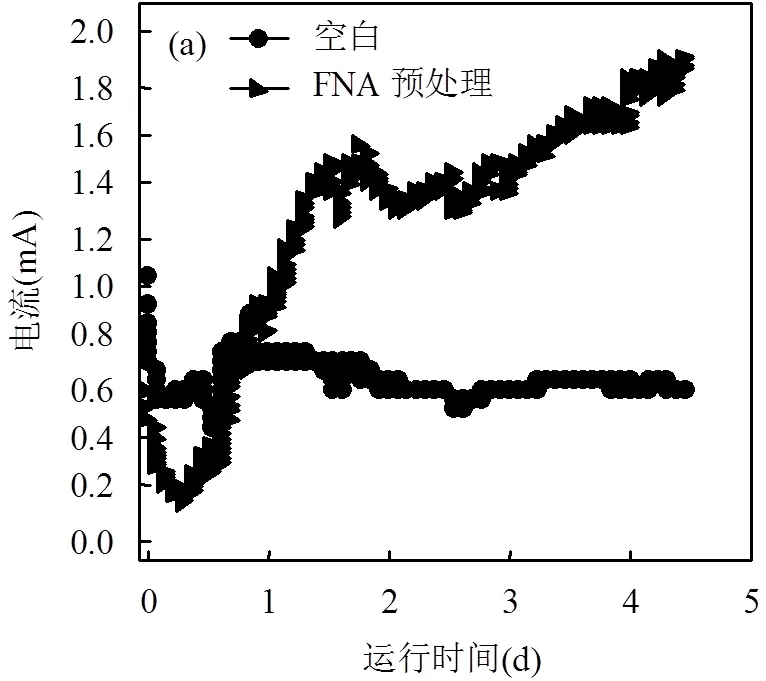
由图1可以看到,电流均呈现先下降后缓慢上升的趋势,第3d电流达峰值后趋于平稳.FNA预处理组的峰值电流高达1.9mA,是空白组的3.2倍.其原因可能是FNA预处理有效地促进了污泥中溶解性有机物的释放,进而为阳极产电微生物提供了充足的底物.同时, FNA预处理组的氢气产量为0.86mL/g VSS,是空白组的5.1倍.
2.2 有机物的释放及利用
2.2.1 溶解性有机物的变化情况 蛋白质是微生物细胞的主要组成部分,占剩余污泥TCOD的35%~61%,碳水化合物占7%~11%,而油脂和其他化合物占比小于1%[13].因此,剩余污泥的水解效果可通过溶解性糖类和蛋白质的释放来证明.图2展示了2组剩余污泥中溶解性有机物的变化情况.经FNA预处理12h后,溶解性糖类和蛋白质含量高达120.9,592.2mg COD/L,相比原污泥分别增加了10倍和1.3倍.说明FNA及其衍生物促进了微生物细胞壁和胞外聚合物(EPS)的破裂,进而导致胞内物质的释放.据报道,FNA预处理会损害细胞和EPS的脂质、蛋白质、碳水化合物及脱氧核糖酸等[14],且对细胞膜的破裂极其有效[15].在MEC运行过程中, FNA预处理组溶解性糖类在48h达到峰值259.8mg COD/L,是空白的4.8倍;溶解性蛋白浓度在36h达最高值1385.1mg COD/L,是空白的1.7倍.上述结果表明FNA预处理促进了后续溶解性有机物的水解.而由于未预处理污泥细胞壁的半刚性结构阻碍了有机物的释放和溶出,因而其在MEC系统中的释放和水解效果远不如FNA预处理后污泥的处理情况.
最终,溶解性糖类在两组中均呈现不同程度的利用.溶解性糖类在空白组和FNA预处理组的利用率分别为16.7%和22.2%.同时,溶解性蛋白在FNA预处理组中利用率高达7%,打破了传统厌氧发酵不能利用蛋白质的瓶颈.而其在空白组中仍呈现缓慢的上升,说明蛋白在该系统中仍进行缓慢的水解过程.溶解性有机物含量下降可能是由于其在产酸发酵菌的作用下转化为挥发酸,以便更好地为产电菌提供理想的基质.

2.2.2 挥发酸产生及利用情况 MECs可利用多种物质作为底物,如乙酸、乙醇等小分子物质,蛋白质、碳水化合物等大分子物质,餐厨废水、生活污水等有机废水[16].挥发酸随时间的变化情况如图3所示,挥发酸浓度随时间呈现先增加后快速减小的趋势.挥发酸总产量在两系统中均在48h达到峰值, FNA预处理组中产量高达697.1mg COD/L (520.9mg/L),是空白组(140.8mg/L即181.3mg COD/L)的3.8倍.挥发酸由溶解性有机物转化而来,因此,FNA预处理可强化剩余污泥在MEC中的酸化过程,进而为产电菌提供底物. MECs运行48h时两组中挥发酸的组成成分情况为:乙酸占比在空白组和FNA预处理组中占比分别为55.8%和46.8%,而乙酸和丙酸的占比分别高达75.3%和69.4%,恰恰为产电菌提供了最理想的基质产电和产氢,因此,VFAs最终得到了有效利用,其在FNA预处理组和空白组中的利用率分别为98.4%和97.5%.挥发酸的利用进一步表现为氢气和电流的产生,因此, FNA预处理组产电和产氢效能优于空白组,与图1结论一致.
2.3 氨氮的释放效果

图4 MECs中NH4+-N释放情况
厌氧发酵过程中,细胞的死亡会导致有机物和有机氮进一步释放到上清液[17],而氨氮作为蛋白质的副产物,会随着进一步的水解酸化而释放,氨氮的释放率可由生物量组成式CH1.93O0.53N0.2来得出[18],因此,氨氮的释放可侧面反映细胞的死亡情况及有机物的水解效果.图4反映了不同处理系统中氨氮随时间的变化情况.两实验组中氨氮浓度整体上均呈现持续上升的趋势. FNA预处理组氨氮浓度在电解8h后高达330.0mg/L,是空白组的2.9倍,说明经FNA预处理对污泥中微生物的灭活作用明显;空白组和FNA预处理组的氨氮浓度均在MEC运行72h达最大值,且FNA预处理组氨氮浓度高达560.5mg/L,是空白组浓度的1.8倍,该结果与图2b中蛋白质变化结果一致,说明溶解性蛋白的逐渐释放.
2.4 微生物群落解析
MECs反应器中有机物的释放和利用及产电产氢效果与阳极微生物的种类及丰度有密不可分的关系.图5反映了不同反应器中阳极功能菌群分别在门,纲和属水平的相对丰度.可以看出,两样品的微生物主要分布在3个门:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),均为目前已报道的最常见的发酵菌门[19-20]和产电菌门[21-22].从纲水平来看,拟杆菌纲(Bacteroidia)和鞘脂杆菌纲(Sphingobacteriia)同属于拟杆菌门(Bacteroidetes),其中拟杆菌纲是典型的发酵菌,主要参与污泥中固体成分的分解和有机酸的积累[23],其在FNA预处理组中丰度高达19.5%,高于空白组(16.0%),鞘脂杆菌纲是降解纤维素的重要菌群[24].α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria), δ-变形菌纲(Deltaproteobacteria)和ε-变形菌纲(Epsilonproteobacteria)都属于变形菌门.相比空白组, FNA预处理组中δ-变形菌纲由空白组的7.1%显著增加到18.8%,是绝大多数产电菌(如菌属)所属的菌纲[25].说明FNA预处理极大地促进了产电菌在MECs中的生长与富集.此外,同属于厚壁菌门(Firmicutes)的梭状芽孢杆菌纲(Clostridia)和杆菌纲(Bacilli),能够释放水解酶,并利用有机物产酸[26].
根据属水平上的群落分布,微生物被分成3类:发酵产酸菌、产电菌和反硝化菌.总体来讲,发酵产酸菌在FNA预处理组样品中相对丰度高达21.3%,而空白组其含量仅为15.6%.其中,为典型的发酵菌,可利用碳水化合物产生乳酸盐、乙酸和丁酸,在FNA预处理组中含量为7.2%,是空白组的7倍;同时,可代谢多种碳水化合物生成有机酸,并有生成H2和CO2的能力,其在FNA预处理组中含量高达2.7%,高于空白组的1.2%.因此,可得出结论:FNA预处理通过破坏EPS和细胞膜导致有机物外泄,进而强化了污泥中发酵产酸菌的富集,该结论证实了图3中挥发酸的富集过程.,,和已被证实是生物电化学系统中典型的产电菌,通过优先消耗有机物酸化过程产生的VFAs,将e-和H+转化为H2[27].这4种产电菌在FNA预处理组和空白组中的累积丰度分别为6.8%和4.7%,这也是FNA预处理组中的电流和产氢高于空白组的主要原因.此外,3种典型的反硝化菌:,和在FNA预处理组中的累积丰度高达9.5%,而其在空白组中仅占4.2%,且在MECs反应器运行末期未检测到NO2--N和NO3--N,说明FNA预处理通过富集反硝化菌,强化了反硝化过程.因此,整个预处理环保高效,无二次污染风险.
3 结论
3.1 FNA预处理强化了剩余污泥在MECs系统中的产电和产氢,其值分别为1.9mA和0.86mL/g VSS,分别是空白组的3.2倍和5.1倍.
3.2 FNA预处理强化了剩余污泥中有机物在微生物电化学系统中的释放和利用.溶解性糖和蛋白在FNA预处理组中高达259.8,1385.1mg COD/L,分别是空白组的4.8和1.7倍.由糖和蛋白进一步酸化产生的挥发酸含量在FNA预处理组中高达697.1mg COD/L,是空白组的3.8倍,且其最终的利用率均在97%以上.
3.3 FNA预处理强化了阳极水解发酵菌,产电菌和反硝化菌的生长和富集,其相对丰度分别高达21.3%,6.8%和9.5%,均高于其在空白组的含量.
[1] Pijuan M, Wang Q, Ye L, et al. Improving secondary sludge biodegradability using free nitrous acid treatment [J]. Bioresource Technology, 2012,116:92-98.
[2] Wang Q, Jiang G, Ye L, et al. Enhancing methane production from waste activated sludge using combined free nitrous acid and heat pre-treatment [J]. Water Research, 2014,63:71-80.
[3] 金宝丹,王淑莹,邢立群,等.不同发酵方式对污泥厌氧发酵性能的影响及其发酵液利用 [J]. 中国环境科学, 2016,36(7):2079-2089. Jin B D, Wang S Y, Xing L Q, et al. The effect of different fermentation methods on the sludge anaerobic fermentation performance and the utilization of fermentation liquor [J]. China Environmental Science, 2016,36(7):2079-2089.
[4] 委 燕,王淑莹,马 斌,等.游离亚硝酸预处理强化剩余污泥发酵同步反硝化性能 [J]. 中国环境科学, 2015,35(3):742-747. Wei Y, Wang S Y, Ma B, et al. Free nitrous acid pretreatment enhances performance of waste activated sludge anoxic fermentation and denitrification system [J]. China Environmental Science, 2015,35(3): 742-747.
[5] 徐雪芹,李小兰,黄善松,等.游离亚硝酸预处理强化剩余污泥和烟草废物共消化产甲烷 [J]. 中国环境科学, 2017,37(9):3423-3430. Xu X Q, Li X L, Huang S S, et al. Free nitrite pretreatment enhanced methane production from co-digestion of waste activated sludge and tobacco waste [J]. China Environmental Science, 2017,37(9):3423- 3430.
[6] Sun R, Xing D, Jia J, et al. Methane production and microbial community structure for alkaline pretreated waste activated sludge [J]. Bioresource Technology, 2014,169:496-501.
[7] Cheng S, Logan BE. Sustainable and efficient biohydrogen production via electrohydrogenesis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2007,104(47):18871-18873.
[8] Logan BE, Call D, Cheng S, et al. Microbial electrolysis cells for high yield hydrogen gas production from organic matter [J]. Environmental Science & Technology, 2008,42(23):8630-8640.
[9] Call D, Logan BE. Hydrogen production in a single chamber microbial electrolysis cell lacking a membrane [J]. Environmental Science & Technology, 2008,42(9):3401-3406.
[10] Cai W, Liu W, Cui D, et al. Hydrogen production from buffer-free anaerobic fermentation liquid of waste activated sludge using microbial electrolysis system [J]. RSC Advances, 2016,6(45):38769- 38773.
[11] 国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002. Nation Environmental Protection Administration. Water and wastewater monitoring and analysis methods [M]. Beijing: China Environmental Science Press, 2002.
[12] Liu W, Huang S, Zhou A, et al. Hydrogen generation in microbial electrolysis cell feeding with fermentation liquid of waste activated sludge [J]. International Journal of Hydrogen Energy, 2012,37(18): 13859-13864.
[13] Lu L, Xing D, Liu B, et al. Enhanced hydrogen production from waste activated sludge by cascade utilization of organic matter in microbial electrolysis cells [J]. Water Research, 2011,46(4):1015-1026.
[14] Li X, Zhao J, Wang D, et al. An efficient and green pretreatment to stimulate short-chain fatty acids production from waste activated sludge anaerobic fermentation using free nitrous acid [J]. Chemosphere, 2016,144:160-167.
[15] Wu J, Yang Q, Luo W, et al. Role of free nitrous acid in the pretreatment of waste activated sludge: Extracellular polymeric substances disruption or cells lysis? [J]. Chemical Engineering Journal, 2018,336:28-37.
[16] Sun R, Zhou A, Jia J, et al. Characterization of methane production and microbial community shifts during waste activated sludge degradation in microbial electrolysis cells [J]. Bioresource Technology, 2014,175C:68-74.
[17] Ma X, Wang Y, Zhou S, et al. Endogenous metabolism of anaerobic ammonium oxidizing bacteria in response to short-term anaerobic and anoxic starvation stress [J]. Chemical Engineering Journal, 2017,313: 1233-1241.
[18] Lu L, Xing D, Ren N. Pyrosequencing reveals highly diverse microbial communities in microbial electrolysis cells involved in enhanced H2production from waste activated sludge [J]. Water Research, 2012,46(7):2425-2434.
[19] 温凯丽.酿造废弃物碳氮调质强化污泥厌氧发酵产酸及微生物群落结构分析[D]. 太原:太原理工大学, 2017. Wen K L. VFAs bio-production from waste activated sludge fermentation stimulated by brewing wastes carbon/ nitrogen conditioning: mechanism research and microbial community analysis [D]. Taiyuan: Taiyuan University of Technology, 2017.
[20] Rui S, Zhou A, Jia J, et al. Characterization of methane production and microbial community shifts during waste activated sludge degradation in microbial electrolysis cells [J]. Bioresource Technology, 2015, 175(6):68-74.
[21] 李志亮.基于亚氧化钛电极的单室微生物燃料电池产电性能研究 [D]. 西安:长安大学, 2017.Li Z L. Effect of titanium suboxide electrode on electricity generation in air single-chamber microbial fuel cell [D]. Xi’an: Chang'an University, 2017.
[22] Liu Z, Zhou A, Zhang J, et al. Hydrogen Recovery from Waste Activated Sludge: Role of Free Nitrous Acid in a Prefermentation– Microbial Electrolysis Cells System [J]. ACS Sustainable Chemistry & Engineering, 2018,6(3):3870-3878.
[23] 杨春雪.嗜热菌强化剩余污泥水解及短链脂肪酸积累规律研究 [D]. 哈尔滨:哈尔滨工业大学, 2015.Yang C X. Enhanced effects of thermophiles on waste activated sludge hydrolysis and short-chain fatty acids production [D]. Harbin:Harbin Institute of Technology, 2015.
[24] 雷晓芬.同步硝化反硝化与反硝化除磷耦合强化脱氮除磷研究[D]. 南京:东南大学, 2013.Lei X F. Research on the combination of SND and denitrifying dephosphatation for enhanced denitrification and phosphorus removal [D]. Nanjing:Southeast University, 2013.
[25] 郑贤虹.微生物电化学系统强化废水生物脱氮的工艺研究 [D]. 浙江:浙江大学, 2017.Zheng X H. Technical study on enhancement of biological denitrification in wastewater by microbial electrochemical system [D]. Zhejiang: Zhejiang University, 2017.
[26] Kato S, Haruta S, Cui Z J, et al. Clostridium straminisolvens sp. nov., a moderately thermophilic, aerotolerant and cellulolytic bacterium isolated from a cellulose-degrading bacterial community [J]. International Journal of Systematic and Evolutionary Microbiology, 2004,54(6):2043-2047.
[27] Zhang Y C, Jiang Z H, Liu Y. Application of electrochemically active bacteria as anodic biocatalyst in microbial fuel cells [J]. Chinese Journal of Analytical Chemistry, 2015,43(1):155-163.
Role of free nitrous acid on waste activated sludge bio-electrolysis and key microflora shift.
LIU Zhi-hong1, WEI Yao-li1, FAN Ya-xin1, DUAN Yan-qing1, ZHOU Ai-juan1,2, YUE Xiu-ping1*
(1.College of Environmental Science and Engineering, Taiyuan University of Technology, Taiyuan 030024, China;2.Environmental Engineering Research Centre, Department of Civil Engineering, The University of Hong Kong, Hong Kong 999077, China)., 2019,39(7):2953~2959
It is a major bottleneck as efficient energy recovery from waste activated sludge (WAS) often require long treatment time during traditional anaerobic fermentation. In order to further enhance the resource utilization efficiency and shorten the treatment time, bio-eletrolysis, i.e., microbial electrolysis cells (MECs), assisted with free nitrous acid (FNA) was employed for WAS treatment in this study. The performance of current and hydrogen generation during bio-eletrolysis from FNA-treated WAS was compared with that obtained from un-pretreated sludge. FNA significantly boosted the hydrolysis and acidification of WAS in MECs, in detail, the concentrations of soluble carbohydrates, proteins and volatile fatty acids (VFAs) were much higher than that of un-pretreated sludge. The utilization efficiency of VFAs was higher than 97% in the MEC-FNA test with the increase of current (1.9mA) and hydrogen yield (0.86mL/g VSS), which were 3.8 and 5.1 folds higher than that in the control. What’s more, pyrosequencing revealed that the abundance of anaerobic fermentation bacteria, electrochemically active bacteria and nitrate-reducing bacteria were notably enhanced.
free nitrous acid;waste activated sludge;microbial electrolysis cells;volatile fatty acids;hydrogen;key microflora
X703.5
A
1000-6923(2019)07-2953-07
刘芝宏(1993-),女,山西忻州人,太原理工大学环境科学与工程学院博士研究生,主要从事剩余污泥资源化研究.发表论文2篇.
2018-11-26
国家自然科学基金青年基金资助项目(51608345);国家博士后科学基金资助项目(2017T100170)
* 责任作者, 教授, yuexiuping@tyut.edu.cn
