高效液相色谱法提取和分析β-胡萝卜素
2019-07-31陈君尧
陈君尧
(武汉轻工大学生物与制药工程学院 湖北武汉 430000)
1 前言
β-胡萝卜素是一种非常常见的类胡萝卜素。β-胡萝卜素的颜色是黄色和橙色,很容易从水果和其他植物中提取。
β-胡萝卜素不仅在食品技术中有许多用途,更重要的是,它对人体也有许多益处,因此,在研究中变得越来越重要。从食品科学的角度研究β-胡萝卜素可以全面了解其成分、组成元素、化学性质和营养价值。
β-胡萝卜素是一种抗氧化剂,但是对于吸烟者来说,他们摄入的β-胡萝卜素的高含量可能会增加患癌症的风险。因此,适量的β-胡萝卜素有利于人体健康。
β-胡萝卜素可以在人体内转化为维生素A,而维生素A 是必需的维生素。维生素A 有许多重要用途,也有一些研究证实,通过饮食摄入β-胡萝卜素中的维生素A 可以应用于人体的许多方面。例如,维生素A 有利于皮肤健康和黏液膜、免疫系统和视力;也有一些研究证明,每天摄入适量的β-胡萝卜素可以减少癌症和心血管疾病。
β-胡萝卜素的另一个益处是其可以延迟认知辨别能力的下降。在人们的身体中,氧化应激是导致认知能力下降的主要原因,研究证实了这一点。在这种情况下,β-胡萝卜素是一种抗氧化剂,可以防止认知能力的恶化,因为补充抗氧化剂可以调节机体的活性氧种类和抗氧化系统之间的平衡[1]。因此,越来越多的研究者将使用不同的抗氧化剂。本实验采用高效液相色谱法对β-胡萝卜素进行了分析。
高效液相色谱(HPLC)是分析化学中的一项现代技术。它用于检测混合物的不同成分,依靠泵的功率使样品混合物通过填充有固体吸附材料的柱,样品中的不同组分与吸附材料有不同程度的反应,这将导致不同组分在管,最终结果是组件彼此分离[2]。此外,高效液相色谱根据物质的极性或是否为亲水性组分离不同的物质。目前,高效液相色谱法已在许多应用中得到应用,例如,药物、分离生物样品的研究和医学方面。在食品研究领域,高效液相色谱法也被广泛应用于食品成分的研究,如脂质、维生素、氨基酸和无机阴离子等,是食品分析研究的热点[3]。
2 材料与方法
2.1 材料
实验器材:电动搅拌器;烧杯;锡箔;磁力搅拌器;真空过滤器;布氏漏斗;Whatman 42 号滤纸;收集瓶;100 mL 容量瓶;250 mL 圆底瓶;旋转蒸发器;超声波浴;高效液相色谱瓶;50 mL 容量瓶;25 mL容量瓶。
2.2 实验方法
在电动搅拌器中对胡椒粉进行均质化,并在干净、干燥的烧杯中称取5 g 匀浆,烧杯确保用锡箔包裹。将 62 mL 萃取溶剂(甲醇)、2.5 g 无水硫酸盐和0.5 g 碳酸镁添加到匀浆中,并将所有成分混合5 min。在这一步中使用了磁力搅拌器,必须在烟雾柜中进行。在此过程中,烧杯被锡箔覆盖,匀浆通过装有Whatman 42 号滤纸的Buchner 漏斗真空过滤。在这个过程中,收集瓶和布氏漏斗的顶部被锡箔覆盖。当没有更多的滤液通过时,用2×10 mL 等份提取溶剂清洗滤饼。
清洗滤饼的滤液转移到干净、干燥的250 mL 圆底烧瓶中,在旋转蒸发器中蒸发至干燥。将旋转蒸发器的温度控制在30℃~40℃,保持仪器不受光照。用超声波浴将残余物重新溶解在10 mL 甲醇中。最后,将溶液样品注入高效液相色谱小瓶中,并在高效液相色谱中分析,条件为:波长450 nm、流动相(乙腈)∶四氢呋喃(THF)∶水为 85∶12.5∶2.5、流速 2.0 mL/min,在此条件下β-胡萝卜素的保留时间应约为10 min。
2.3 样品制备
称取12.5 mg β-胡萝卜素,溶解于最小体积的THF 中,用50 mL 容量瓶添加样品,用THF 将 50 mL容量瓶定容,并用锡箔覆盖。从储备溶液中取出0.25 mL、0.50 mL、0.75 mL、1.00 mL 等分试样,并将其转移到单独的25 mL 容量瓶中。用THF 将25 mL容量瓶定容,并用锡箔覆盖4 个容量瓶,用上述高效液相色谱法对这些标准品进行分析。
3 实验结果
标准溶液配置的浓度详见表1,用高效液相色谱法测定的4 个浓度梯度和1 个样品的含量详见表2,β-胡萝卜素标准线图详见图1。
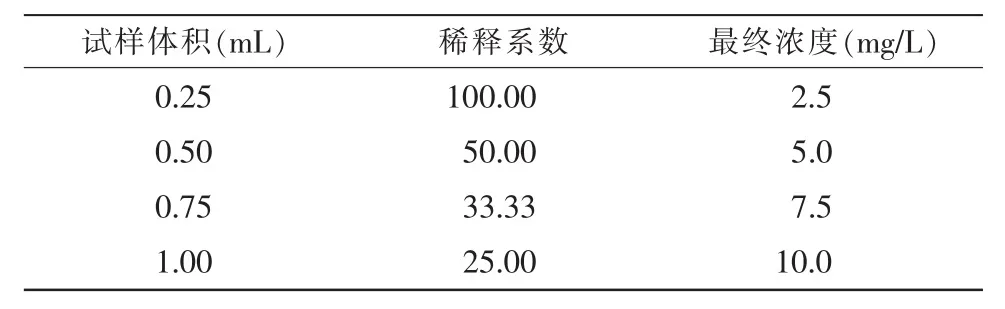
表1 标准溶液的浓度
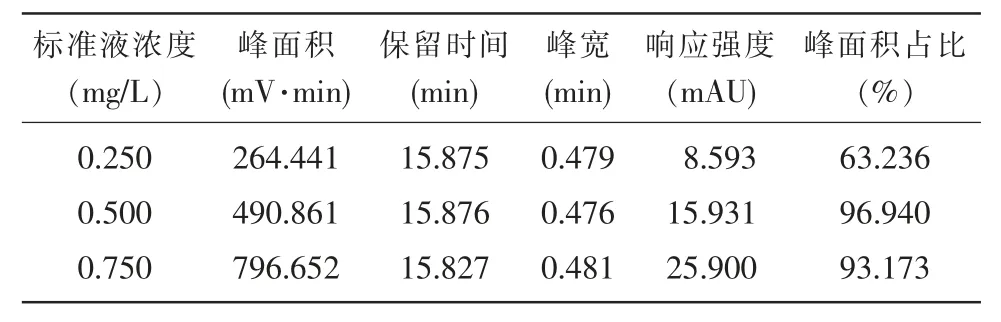
表2 高效液相色谱法测定的4 个浓度梯度和1 个样品的含量
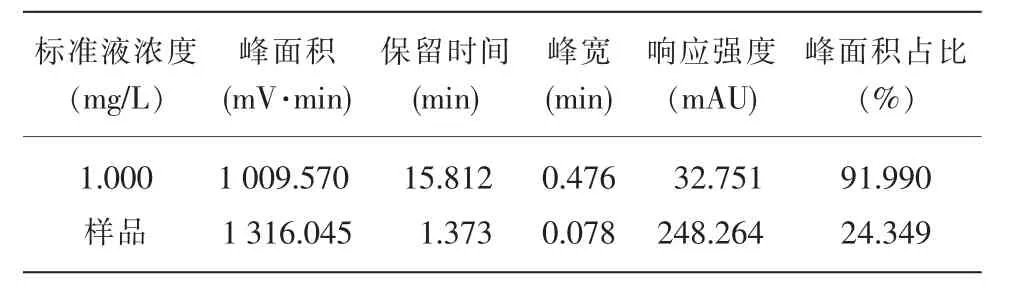
(续表2)
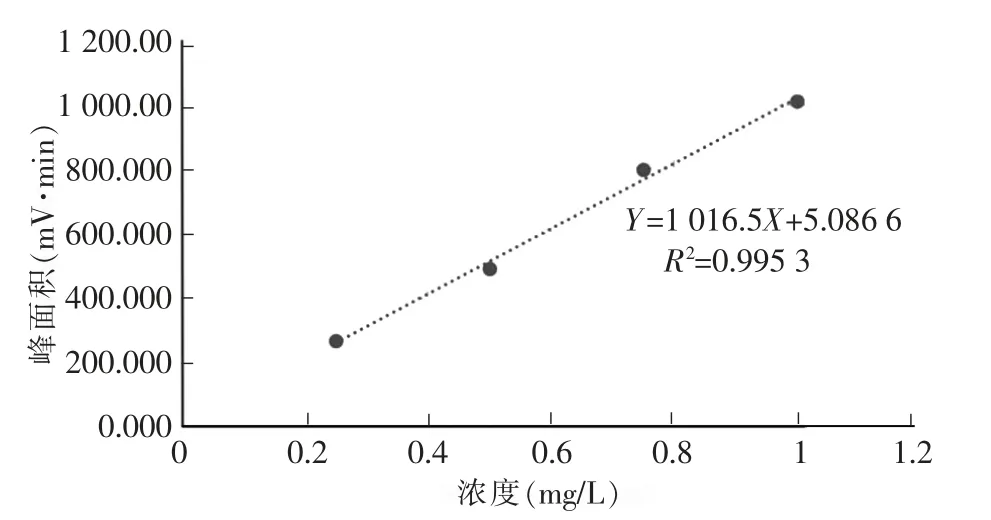
图1 β-胡萝卜素标准线
未知浓度溶液的计算如下:
Y=1 016.5X+5.086 6,X 为样品浓度,Y 为样品峰面积=1 316.045,M 为坡度=1 016.500,C 为截距=5.086,Y=MX+C
重新排列得到结果如下:
X=(Y-C))/M 即 X=(1316.045-5.086))/1016.500=1.290 mg/L
参考值为100 g,但本实验中,将5 g 样品放入烧杯中,因此,需要将实验值返回到参考值,并且2 个砝码之间的差值的倍数为100/5=20。因此,最终计算结果需要乘以20。所以,未知溶液浓度的最终结果为 1.290×20=25.806 mg/100g。
4 讨论与分析
4.1 批判性分析
在本实验中,主要的误差是光、氧、热不能在实验室中完全分离,β-胡萝卜素对光、氧、热、不稳定,因此,本实验中的所有玻璃容器在整个过程中都被锡箔覆盖。当实验过程进行到真空过滤时,实验员将烧杯的锡箔取出,通过布氏漏斗对匀浆进行真空过滤,由于光线的照射,使得β-胡萝卜素的浓度低于正常值。此外,当使用旋转蒸发器干燥圆底烧瓶时,助手应在此过程中除去锡箔。幸运的是,标准函数中的确定系数非常接近1(R2=0.995 3),这意味着4 个梯度标准数据非常匹配。
在第2 个实验中,主要的误差来自于溶液的定容和光照。由于透视上的差异,在这个过程中,改变了溶液体积,这可能导致标准溶液浓度的偏差。另一个产生误差的原因是,当溶液转移到HPLC 小瓶时,β-胡萝卜素溶液的梯度浓度被倒入不同的烧杯中,在此期间,标准溶液暴露在光下。
4.2 方法比较
测定β-胡萝卜素的方法还有很多,例如,紫外分光光度法和纸色谱法。
4.2.1 紫外分光光度法
对于紫外分光光度法而言,该方法检测β-胡萝卜素的优点在于,它能够以简单、快速的方式检测成分,同时不会污染环境和降低成本;更重要的是,其具有较高的重现性和重复性,但主要缺点是精度不够高[4]。
其操作方法如下:
样品在玻璃烧杯中称取1 g,振荡15 min,向烧杯中加入5 mL 冷丙酮,温度控制在约4℃,最后高速离心10 min,上层分离的上清液在另一管中收集。5 mL 丙酮和再萃取将活性化合物混合并离心,然后取上清液与第1 个上清液混合,将上清液通过Whatman 第42 号滤纸,在紫外-可见分光光度计中以449 nm 波长测定提取物的吸光度。
对胡萝卜样品的空白溶液进行梯度浓缩稀释处理,提取方法与上述方法相同。通过后插法将光密度值绘制为浓度对应的标准曲线,从而计算β-胡萝卜素的含量。
4.2.2 纸色谱法
纸色谱法利用混合物的不同极性和溶解性来实现分离,纸色谱法的优点是分离效率高,但操作步骤更为复杂,在进行大量的数据分析和处理时,有许多限制因素,而且不够精确[5]。
其操作方法如下:
将滤纸切割成12 cm×14 cm 的形状,确保边缘必须垂直,在纸边缘用铅笔画出1.5~2 cm 的线,将胡萝卜汁浸入毛细血管中,放在铅笔画的直线上,重复多次,直到直线上有一个大约2 cm 的小圆圈,将12 cm 的端部卷成圆柱形,并使用回形针固定端部。将纸卷和一定量的分离液放入烧杯中,将烧杯密封5 min,然后取出滤纸,观察β-胡萝卜素的运动并记录最远的距离,最后计算β-胡萝卜素的距离颜色行程/溶剂前行程即Rf 值。
4.3 实验数据的改进
实验中存在一定的误差,这一系列结果之间的一致性程度可以通过重复性实验进行检验。重复性实验的定义是:同一方法、同一试剂、同一样品进行多次实验,2 个独立试验结果在概率水平为95%时的最大差异,由于一个实验的偶然性,它是需要多次进行实验以提高准确性。重复性实验之所以重要,是因为无论是在机器加工上还是在样品制备过程中,通常都会有一些误差,但重复性实验可以大大减少这些误差。MENT 是最佳选择,从统计学的角度来看,为了减少每组数据之间和每组数据内的误差,进行了多次重复性实验,同时计算平均值和标准差以确定重复性的成功,通常标准偏差值越小,重复性越好[6]。
在本实验中,误差可分为人为误差和系统误差两大类。为了减少系统误差,首先要做的是校准仪器。例如,在本实验中,可以在实验前向高效液相色谱中注入空白对照溶液,通过峰图确定机器是否可以正常使用;另一种减小误差的方法是多次重复实验,因此也可以多次注入样品溶液,并比较从机器获得的数据。通过计算标准差,可以选择最小值的数据,这是一种减少系统误差的方法。
对于人为错误,这可以通过团队来减少错误的发生。例如,在这个实验中,β-胡萝卜素样品溶液可以被同一个团队多次配置,每个团队成员都将被分配任务,并且团队成员可以互相监督以遵守实验的步骤,每个步骤都将遵循实验规则,避免了单一样品溶液中的偶然误差,最后通过对高效液相色谱分析数据的比较,选择标准偏差最小的数据集作为最合适的实验数据。
