脾脏酪氨酸激酶和核因子-κB对新城疫病毒-血凝素-神经氨酸酶上调自然杀伤细胞TRAIL蛋白表达的影响▲
2019-07-30钟伟娟宋德志田雯钰赖振屏樊晓晖
钟伟娟 梁 莹 宋德志 田雯钰 赖振屏 樊晓晖
(广西医科大学基础医学院微生物教研室,南宁市 530021,电子邮箱:3230390976@qq.com)
作为肿瘤生物治疗的候选病毒株,新城疫病毒(Newcastle disease virus,NDV)具有几乎无毒的安全优势和显著的抑瘤效果。NDV不仅可直接诱发肿瘤细胞的凋亡和自噬,还可以通过激活机体抗瘤免疫应答来清除肿瘤细胞[1-2]。研究表明,自然杀伤(natural killer,NK)细胞的肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)表达上调,是NK细胞杀伤肿瘤细胞的重要机制。NDV可通过上调TRAIL的表达来增强NK细胞的抗瘤效应[3-5]。然而,在NK细胞中介导这一过程的信号通路目前尚未清楚。我们前期研究证实在不依赖干扰素(interferon,IFN)-γ情况下,NDV经血凝素-神经氨酸酶(hemagglutinin-neuraminidase,HN)途径诱导TRAIL表达来增强NK细胞的抗瘤效应;此外,信号抑制剂阻断实验结果显示,脾脏酪氨酸激酶(spleen tyrosine kinase,Syk)和核因子-κB(nuclear factor-kappaB,NF-κB)是TRAIL活化的重要通路分子[6]。考虑到信号抑制剂作用靶点的非唯一性,本研究用小干扰RNA(small interfering RNA,siRNA)特异性敲低IFN-γ受体缺失的NK细胞(IFN R-/-NK)的信号分子Syk、NF-κB,进一步阐明Syk、NF-κB在TRAIL活化中的作用,为NDV抗瘤的免疫活化机制研究提供参考依据。
1 材料与方法
1.1 材料 NDV-HN为本实验室保存的大肠杆菌表达纯化产物。无血清RPMI-1640培养基、兔抗小鼠磷酸化IκBα单抗(批号:I1212)、兔抗鼠Syk单抗(批号:12311)、兔抗鼠TRAIL单抗(批号:E01040-1630)均购自SantaCruz公司,辣根过氧化物酶标记羊抗兔IgG单抗(批号:ZS230)、兔抗β-肌动蛋白(β-actin)抗体(批号:130906)均购自ZSGB-BIO公司,兔抗小鼠p65单克隆抗体(批号:B2312)购自Pierce公司,Lipofectamine 3000(批号:L3000008)、胎牛血清(批号:1828728)均购自赛默飞公司,胰酶(批号:20180625)购自索莱宝公司,MiniBEST Universal RNA盒(批号:9767/9767S)、逆转录试剂盒(批号:RR036A)、SYBR Premix Ex TaqTMⅡ(批号:RR820A)购自TaKaRa公司,小鼠分泌型TRAIL蛋白酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号:10M22A)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定增强型试剂盒(批号:AR0146)、硝酸纤维素膜(批号:AR0135502)、电化学发光显影试剂盒(批号:12L22C)均购自Boster公司,磷酸缓冲盐溶液(phosphate-buffered saline,PBS)购买自吉诺生物公司(批号:GNM20012)。
1.2 方法
1.2.1 细胞培养:IFN R-/-NK细胞株购自赛齐生物制品有限公司,用含有链霉素(100 U/mL)、青霉素(100 U/mL)、谷氨酰胺(2 mM)、10%胎牛血清的RPMI-1640培养基,并置于37℃、5% CO2细胞培养箱中培养72 h。
1.2.2 细胞分组与瞬时转染:(1)分组。用RPMI-1640培养基重悬IFN R-/-NK细胞,以2×105个细胞/孔接种于6孔细胞板,将细胞分为siRNA-Syk1组、siRNA-Syk2组、siRNA-Syk3组、siRNA-p65-1组、siRNA-p65-2组、siRNA-p65-3组、未处理组、脂质体组、siRNA-NC组。(2)瞬时转染。先把siRNA粉末配成20 pmol/μL,将5 μL siRNA(Syk1-siRNA、Syk2-siRNA、Syk3-siRNA,p65-1-siRNA、p65-2-siRNA、p65-3siRNA,厂家均为上海吉玛基因,批号:66618、66422、66423、66619、66620、66621)、3.75 μL Lipofectamine 3000和250 μL Opti-MEM培养基(Gibco公司,批号:2003808)混匀配置成转染复合物,siRNA-Syk1组、siRNA-Syk2组、siRNA-Syk3组、siRNA-p65-1组、siRNA-p65-2组、siRNA-p65-3组细胞分别加入相应的转染复合物,未处理组细胞加入相同体积的PBS,脂质体组细胞加入由Lipofectamine 3000和Opti-MEM培养基组成的转染复合物,siRNA-NC组加入由非特异性siRNA(上海吉玛基因,批号:171211)、Lipofectamine 3000和Opti-MEM培养基组成的转染复合物。siRNA序列详见表1,瞬时转染操作按照Lipofectamine 3000瞬时转染试剂盒说明书进行。36 h后,检测Syk或p65 mRNA、蛋白的表达水平。
1.2.3 敲低Syk或p65对NDV-HN作用后IFN R-/-NK细胞TRAIL蛋白表达的影响:瞬时转染16 h后,于siRNA-Syk1组、siRNA-Syk2组、siRNA-Syk3组、siRNA-p65-1组、siRNA-p65-2组、siRNA-p65-3组、脂质体和siRNA-NC组细胞中加入500 ng NDV-HN,并分别设为siRNA-Syk1+HN组、siRNA-Syk2+HN组、siRNA-Syk3+HN组、siRNA-p65-1+HN组、siRNA-p65-2+HN组、siRNA-p65-3+HN组、脂质体+HN和siRNA-NC+HN组,未处理组加入相同体积的PBS。继续培养20 h后,PBS洗涤两次,分别收集细胞和上清液,检测膜型和分泌型TRAIL蛋白表达水平。实验重复3次。
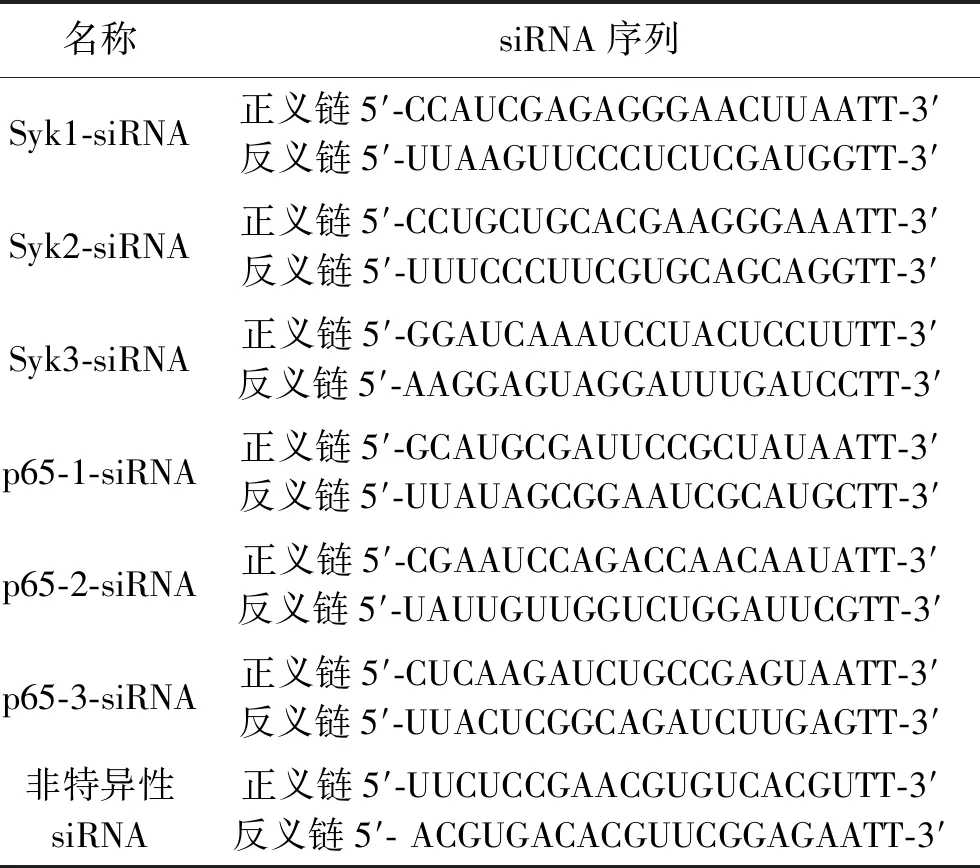
表1 siRNA序列
1.2.4 敲低Syk对NDV-HN作用后IFN R-/-NK细胞IκBα磷酸化的影响:瞬时转染16 h后,于siRNA-Syk1组、siRNA-Syk2组、siRNA-Syk3组、脂质体组和siRNA-NC组细胞中加入500 ng/mL NDV-HN,并分别设为siRNA-Syk1+HN组、siRNA-Syk2+HN组、siRNA-Syk3+HN组、脂质体+HN和siRNA-NC+HN组,未处理组加入相同体积的PBS,继续培养1 h后,PBS洗涤两次,收集细胞,测定磷酸化IκBα蛋白表达水平。
1.2.5 实时荧光定量PCR法检测Syk及p65 mRNA表达水平:提取细胞总RNA,按照MiniBEST Universal RNA提取试剂盒说明书进行操作。采用紫外光光度计鉴定RNA纯度及质量后,按照逆转录试剂盒说明书进行反转录反应获得cDNA。按照SYBR Premix Ex TaqTMⅡ说明书进行实时荧光定量PCR反应。反应体系包括12 μL SYBR Premix Ex TaqTMⅡ、0.5 μL 10 μM PCR上游引物、0.5 μL 10 μM PCR下游引物、1.0 μL cDNA模板和6 μL RNase Free d H2O。反应条件:预变性94℃ 3 min、变性94℃ 30 s、退火59℃ 30 s、延伸72℃ 30 s,共40个循环,延伸72℃ 10 min后,于4℃终止反应。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,目的基因及内参基因的引物序列见表2。按照2-△△Ct方法计算Syk及p65的相对表达量,△△Ct=实验组Ct -脂质体组Ct。

表2 p65、Syk、GAPDH的引物序列
1.2.6 蛋白质印迹法检测Syk、p65、TRAIL蛋白及磷酸化IκBα水平:提取细胞总蛋白,按照BCA蛋白浓度测定增强型试剂盒说明书进行蛋白定量,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,加样量为5 μg总蛋白,利用半干法,以100 mA恒流40 min进行电转膜,室温洗膜3次,5 min/次,用含5%脱脂牛奶和0.5%吐温20的PBS液室温封闭1 h后用PBST液洗涤3次,5 min/次,加入一抗(1 ∶1 000),4℃孵育过夜,PBST液洗涤3次,5 min/次。加入辣根过氧化物酶标记的羊抗兔二抗(1 ∶20 000),室温孵育1 h,PBST液洗涤3次,5 min/次,采用电化学发光显影后进行灰度值扫描。其中以β-actin作为内参。
1.3 统计学分析 采用SPSS 18.0软件进行统计学分析。计量资料以(x±s)表示,多组样本间的比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2结果
2.1 瞬时转染后细胞Syk或p65 mRNA及蛋白表达情况 瞬时转染36 h后,siRNA-Syk1、siRNA-Syk2、siRNA-Syk3组的Syk mRNA及蛋白表达水平低于脂质体组;siRNA-p65-1、siRNA-p65-2、siRNA-p65-3 组p65 mRNA及蛋白表达水平低于脂质体(均P<0.05)。见表3~4及图1~2。
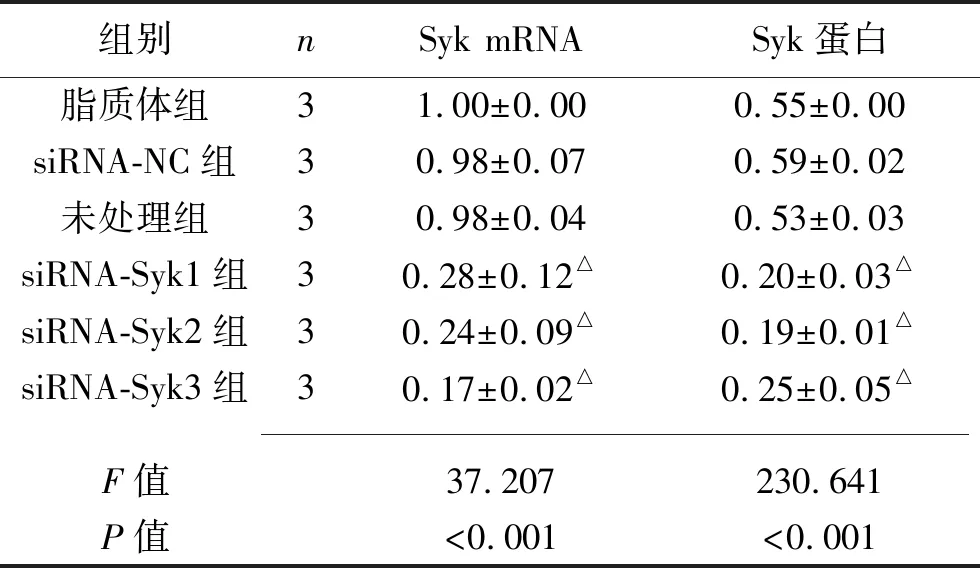
表3 瞬时转染36 h后6组细胞Syk mRNA及蛋白的相对表达水平比较(x±s)
注:与脂质体组比较,△P<0.05。
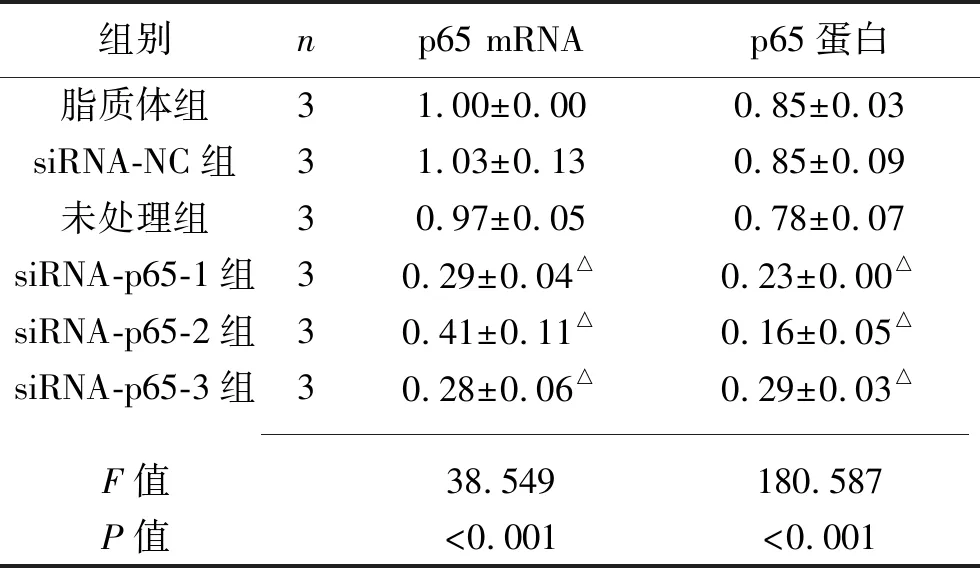
表4 瞬时转染36 h后6组细胞p65 mRNA及蛋白的相对表达水平比较(x±s)
注:与脂质体组相比,△P<0.05。
图1 瞬时转染36 h后各组细胞Syk蛋白的表达情况
注:① 未处理组;② 脂质体组;③ siRNA-NC组;④ siRNA-Syk1组;⑤ siRNA-Syk2组;⑥ siRNA-Syk3组。
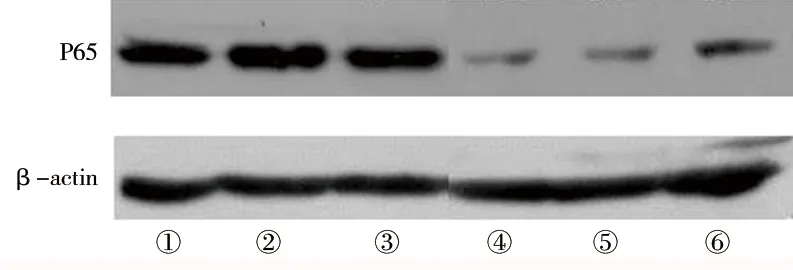
图2 瞬时转染36 h后各组细胞p65蛋白的表达情况
注:① 未处理组;② 脂质体组;③ siRNA-NC组;④ siRNA-p65-1组;⑤ siRNA-p65-2组;⑥ siRNA-p65-3组。
2.2 敲低Syk或p65对NDV-HN干预IFN R-/-NK细胞TRAIL蛋白表达的影响 未处理组的膜型TRAIL蛋白及分泌型TRAIL蛋白表达水平均低于其他组,siRNA-Syk1+HN组、siRNA-Syk2+HN组、siRNA-Syk3+HN组及siRNA-p65-1+HN组、siRNA-p65-2+HN组、siRNA-p65-3+HN组的膜型TRAIL蛋白及分泌型TRAIL蛋白表达水平均低于脂质体+HN组(均P<0.05)。见图3及表5~6。
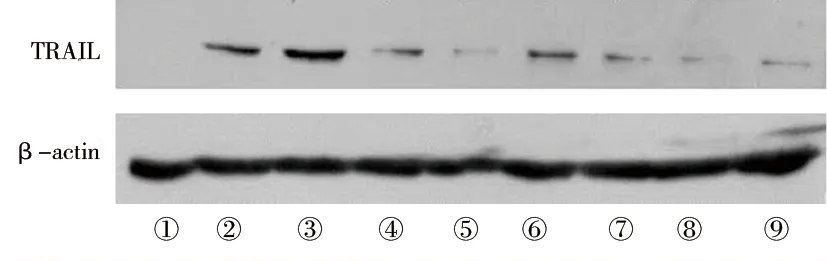
图3 各组细胞膜型TRAIL的表达情况
注:① 未处理组;② 脂质体+HN组;③ siRNA-NC+HN组;④ siRNA-Syk1+HN组;⑤ siRNA-Syk2+HN组;⑥ siRNA-Syk3+HN组;⑦ siRNA-p65-1+HN组;⑧ siRNA-p65-2+HN组;⑨ siRNA-p65-3+HN组。
注:与未处理组比较,*P<0.05;与脂质体+HN组相比,△P<0.05。
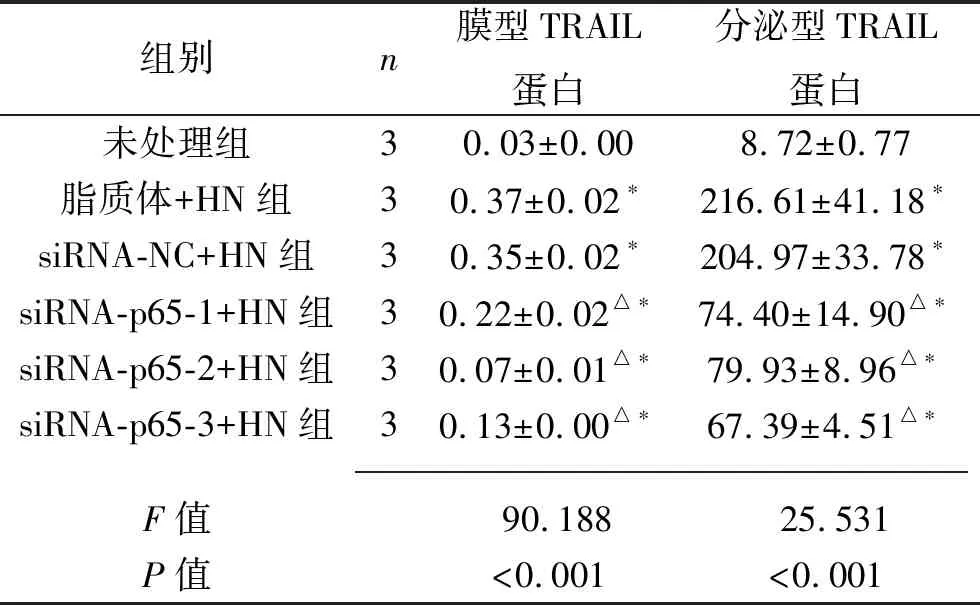
表6 敲低p65后细胞的TRAIL蛋白相对表达水平(x±s)
注:与未处理组比较,*P<0.05;与脂质体+HN组相比,△P<0.05。
2.3 敲低Syk对IκBα磷酸化的影响 未处理组磷酸化IκBα的蛋白表达水平均低于其他组,siRNA-Syk1+HN、siRNA-Syk2+HN、siRNA-Syk3+HN组磷酸化IκBα蛋白表达水平均低于脂质体+HN组(均P<0.05)。见图4及表7。
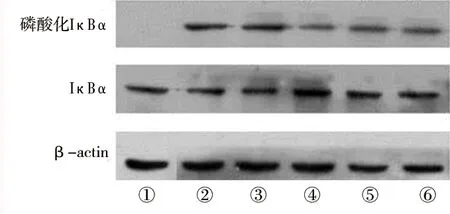
图4 各细胞的磷酸化IκBα蛋白表达情况
注:① 未处理组;② 脂质体+HN组;③ siRNA-NC+HN组;④ siRNA-Syk1+HN组;⑤ siRNA-Syk2+HN组;⑥ siRNA-Syk3+HN组。
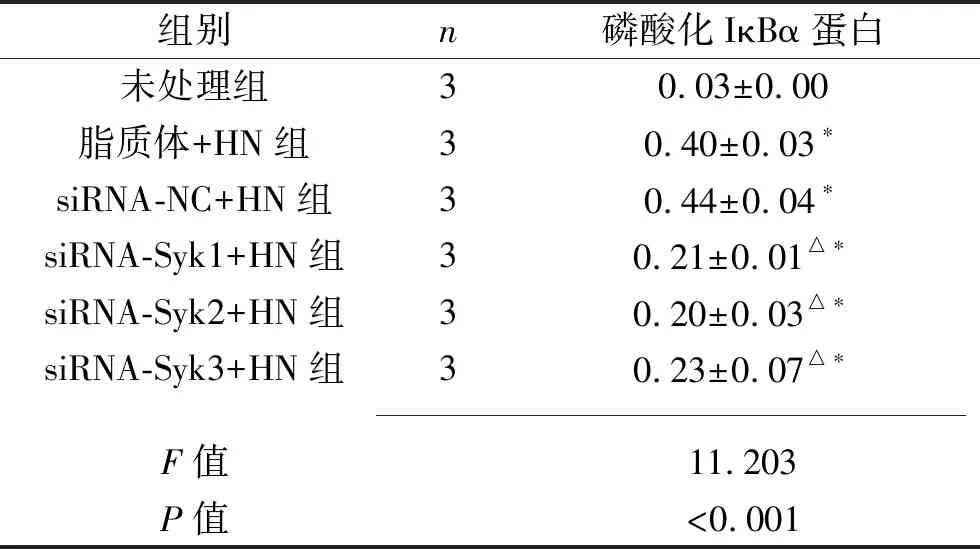
表7 敲低Syk后6组细胞磷酸化IκBα蛋白相对表达水平(x±s)
注:与未处理组比较,*P<0.05,与脂质体+HN组相比,△P<0.05。
3 讨 论
TRAIL是肿瘤坏死因子超家族的Ⅱ型跨膜蛋白,分为膜型和分泌型。与膜型TRAIL相比,分泌型TRAIL仅为完整TRAIL蛋白C末端亲水片段的241个氨基酸,是膜型TRAIL经水解作用后的解离片段。研究表明,TRAIL的活性部位是C末端亲水片段区内,分泌型TRAIL的N端缺失并不影响其活性[6]。有学者发现,TRAIL基因的启动子存在可与NF-κB二聚体结合的κB序列,提示NF-κB可能参与TRAIL表达的信号转导[6]。
在抗肿瘤免疫应答的初始阶段,肿瘤细胞的清除需依赖于NK细胞的胞毒效应。抗体依赖性细胞介导的细胞毒效应(antibody dependent cell-mediated cytotoxicity,ADCC)、Fas配体、颗粒酶/穿孔素及TRAIL是NK细胞行使胞毒效应的主要机制。Syk属于非受体型的Syk家族成员之一,是先天免疫应答信号转导通路的重要分子。Syk不仅参与巨噬细胞和树突状细胞免疫应答启动的活化[7],还参与NK细胞的ADCC、颗粒酶/穿孔素介导,以及TRAIL胞毒效应的触发[8-9]。我们在前期研究中发现,NDV体外刺激NK细胞后,细胞中的Syk发生磷酸化从而可上调TRAIL的表达,增强胞毒效应,而Syk信号抑制剂可以削弱这个作用[7]。因此我们认为Syk信号通路可被溶瘤病毒NDV体外活化,是NDV的抗肿瘤免疫活化的机制之一。本研究结果显示,siRNA-Syk1+HN组、siRNA-Syk2+HN组及siRNA-Syk3+HN组的膜型及分泌型TRAIL表达水平低于脂质体+HN组,即敲低Syk基因后,NDV-HN诱导NK细胞TRAIL上调的效应被削弱,且膜型和分泌型TRAIL蛋白变化趋势一致,提示在NK细胞中,Syk的信号转导对NDV-HN所致的TRAIL介导的胞毒效应具有重要作用。
我们在前期研究中还发现,NDV体外刺激NK细胞后,NK细胞中TRAIL介导的细胞毒效应显著增强,而NF-κB信号抑制剂可以削弱这个作用[10],表明具有活性的NF-κB二聚体在NDV上调NK细胞TRAIL表达过程中起信号调控作用。也有研究表明,在NK细胞的胞毒效应启动过程中,进入细胞核识别靶基因需要转录调控元件,而具有活性的NF-κB二聚体在这个过程中起着重要作用[11-13]。p65是NF-κB二聚体的亚单位,本研究结果显示,siRNA-p65-1+HN组、siRNA-p65-2+HN组及siRNA-p65-3+HN组的膜型及分泌型蛋白均低于脂质体+HN组(P<0.05),即敲低p65后NDV-HN上调NK细胞表达TRAIL蛋白的作用减弱,提示NF-κB信号通路在NDV体外活化NK细胞上调抗瘤效应分子TRAIL中起着信号转导的作用。
IκBα是NF-κB的负调控元件,在细胞质内,IκBα可与NF-κB二聚体发生结合,形成NF-κB-IκBα三聚体,导致NF-κB处于失活状态;当感知外界信号时,IκBα激酶被激活,致IκBα从三聚体上解离,NF-κB二聚体的核定位信号结构域被暴露,NF-κB二聚体进入细胞核内,与含有κB序列的DNA分子结合,开启该基因的转录及表达。IκBα磷酸化水平越高,进入细胞核的NF-κB二聚体就越多。本研究结果显示,siRNA-Syk1+HN组、siRNA-Syk2+HN组、siRNA-Syk3+HN组磷酸化IκBα的蛋白表达水平均低于脂质体+HN组(均P<0.05),表明Syk-NF-κB可能是NDV-HN的胞内活化信号的路径,即Syk将活化信号传导给NF-κB,导致TRAIL的上调。但该结论及其具体的机制仍需进一步的实验研究验证。
综上所述,敲低Syk或p65可以削弱NDV-HN上调NK细胞表达TRAIL蛋白的作用,Syk和NF-κB信号通路可能参与NDV-HN增强NK细胞的抗瘤效应。
