2型糖尿病患者辅助性T细胞和调节性T细胞水平及其与胰岛素抵抗、胰岛B功能的相关性
2019-07-30朱亦堃焦玉睿李喜全
曹 洁 朱亦堃 焦玉睿 李 青 李喜全
(山西医科大学第二医院内分泌科,太原市 030001,电子邮箱:1436280728@qq.com)
长期慢性炎症状态对胰岛B的损伤是2型糖尿病(type 2 diabetes mellitus,T2DM)患者发生胰岛素抵抗的重要机制[1]。既往研究表明,这种炎症损伤主要累及人体的先天免疫功能,通过先天性免疫细胞释放炎症因子而导致胰岛素抵抗[2-3]。但近年来有学者认为,适应性免疫调节,特别是CD4+T细胞亚群的调节,在T2DM的发生发展过程中起着非常重要的作用[4]。动物和临床研究均表明,脂肪组织中CD4+T细胞亚群在调节体重、胰岛素抵抗程度中发挥了重要作用[5-6]。但国内外关于CD4+T细胞与T2DM之间关系的研究多集中在脂肪组织中的CD4+T细胞亚群,而鲜有关于外周血CD4+T细胞与胰岛素抵抗及脂代谢关系的研究。CD4+T细胞分为抗炎细胞调节性T细胞(regulatory T cell,Treg)、Th2,以及促炎细胞Th1、Th17。本文主要探讨T2DM患者外周血Th17、Treg水平与胰岛素抵抗、胰岛B功能的相关性。
1 资料与方法
1.1 临床资料 纳入2016年10月至2018年5月在我院内分泌科诊治的35例T2DM患者(T2DM组),均符合1999年世界卫生组织制定的诊断标准。排除存在影响免疫功能疾病的研究对象,疾病包括风湿系统疾病,1型糖尿病,T2DM急性并发症(酮症酸中毒、感染等),肿瘤,炎症性疾病及严重肝、肾疾病患者,并除外服用对血糖影响药物的患者,包括性激素、糖皮质激素、利尿剂、精神类药物等。选取同时间段在我院体检中心进行体检的30例健康者作为对照组。两组基本资料差异均无统计学意义(均P>0.05),见表1。
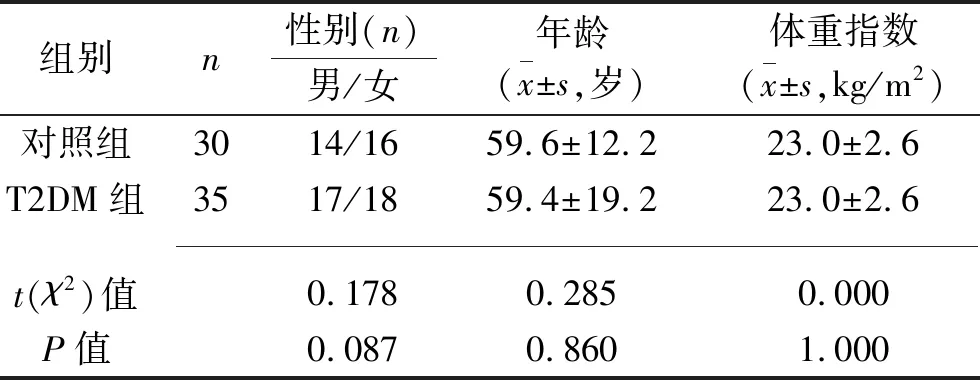
表1 两组基本资料的比较
1.2 资料收集
1.2.1 基本资料:包括年龄、性别、身高、体重等,同时计算体重指数。
1.2.2 实验室指标:所有研究对象均空腹8 h后采集静脉血;采用葡萄糖氧化酶法测定空腹血糖;采用化学发光法测定空腹胰岛素(fasting insulin,FINS);采用酶联免疫吸附法测定糖化血红蛋白(hemoglobin A1c,HbA1c);采用流式细胞术检测Treg及Th17水平,并计算Th17/Treg比值。正常值范围:空腹血糖<6.1 mmol/L,HbAlc<7%,FINS为5~20 mIU/L,Th17为3.07~14个/UL,Treg为17.70~54.20个/UL,Th17/Treg为0.09~0.47。
1.2.3 T2DM患者胰岛素抵抗及胰岛功能的评估:计算稳态模型胰岛素抵抗(homeostasis model assessment-insulin resistance,HOMA-IR)指数,HOMA-IR指数=FINS×空腹血糖/22.5,以HOMA-IR指数>2.69为存在胰岛素抵抗;应用稳态模型胰岛B功能(homeostasis model assessment-islet β function,HOMA-β)指数评价胰岛B功能,HOMA-β=FINS×20/(空腹血糖-3.5)。
1.3 统计学分析 采用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用t检验;计数资料以例数表示,组间比较采用χ2检验。采用Pearson相关系数分析相关性。以P<0.05为差异有统计学意义。
2结果
2.1 两组观察指标的比较 与对照组相比,T2DM组空腹血糖、HbA1c、HOMA-IR指数、Th17水平、Th17/Treg比值升高,HOMA-β指数及Treg水平减低(均P<0.05 )。见表2。
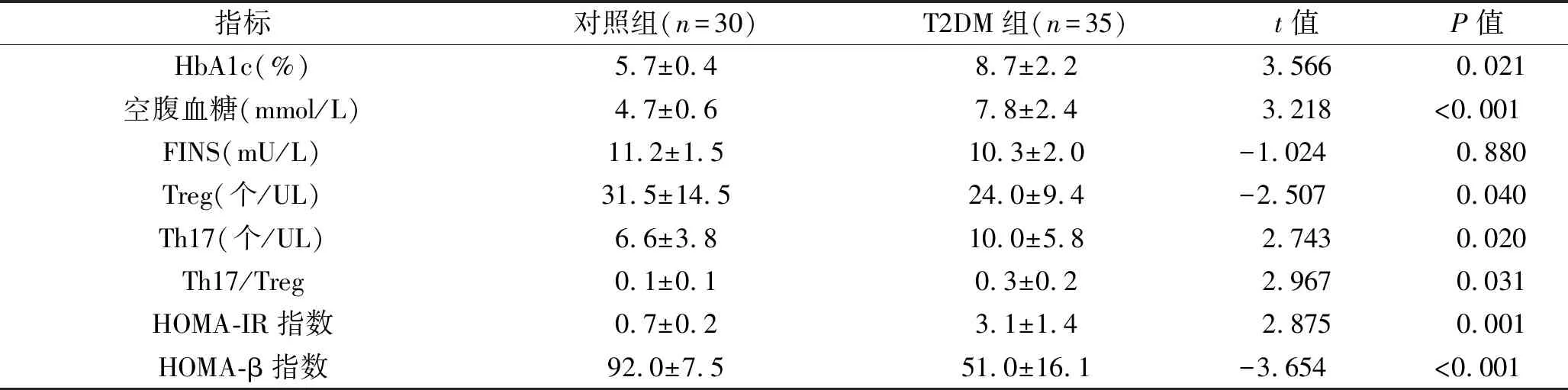
表2 两组观察指标的比较(x±s)
2.2 T2DM患者血清免疫细胞水平与血糖、胰岛素代谢指标的相关性 Treg水平与HOMA-IR指数呈负相关,与HOMA-β指数呈正相关(P<0.05),与空腹血糖、HbA1c、FINS无相关性(均P>0.05);Th17/Treg比值、Th17水平与HOMA-IR指数、HbA1c呈正相关,与HOMA-β指数呈负相关(均P<0.05),与空腹血糖、FINS均无相关性(均P>0.05)。见表3。
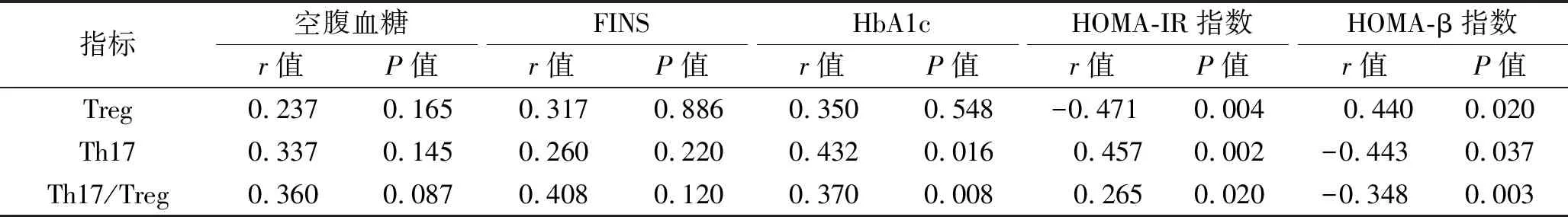
表3 T2DM患者血清免疫细胞水平与血糖、胰岛素代谢指标的相关性
3 讨 论
胰岛素抵抗的发生涉及胰岛素与受体结合发挥作用中的多个环节,最重要的分子机制是靶细胞胰岛素受体后信号传导通路的缺陷[7]。近年来的研究显示,胰岛素受体后信号通路与炎症因子的信号传导存在交叉作用,单核细胞、巨噬细胞、抗原提呈B淋巴细胞、树突细胞、内皮细胞等非特异性细胞及其所产生的炎症因子(白细胞介素6、白细胞介素1、肿瘤坏死因子α等),可干扰胰岛素受体底物/磷脂酰肌醇-3激酶信号传导通路,而这是导致胰岛素抵抗的主要分子机制[8-9]。
既往针对T2DM胰岛素抵抗的研究多集中在先天免疫功能上,即巨噬细胞通过分泌促炎细胞因子诱导胰岛素抵抗[10]。但最近有研究表明,适应性免疫功能也在T2DM的发生发展中起重要作用。有学者发现,高脂饮食诱导的肥胖小鼠在诱导5周后即出现胰岛素抵抗及内脏脂肪组织CD4+T淋巴细胞浸润,而巨噬细胞浸润较CD4+T淋巴细胞延迟,提示炎性T淋巴细胞的浸润早于巨噬细胞[11]。此外,另有动物实验结果显示,CD4+T细胞亚群比例失衡促使巨噬细胞向不同方向分化,炎性细胞Th1、Th17的比例增高可促使巨噬细胞向炎性巨噬细胞极化,并增强其释放促炎性介质白细胞介素6、白细胞介素1、肿瘤坏死因子α的功能,进一步导致炎性胰岛素抵抗;而Treg、Th2的比例增高时,具有抗炎作用的白细胞介素4和白细胞介素13可促进巨噬细胞向M2型分化[12-14]。因此,胰岛素抵抗的起始可能并非首先由先天免疫细胞直接触发。CD4+T细胞亚群能更早、更直接地影响胰岛素抵抗,其可通过影响先天免疫细胞的极化来调节胰岛素抵抗。
CD4+T细胞亚群与许多炎症性疾病的发生相关,许多自身免疫性疾病或慢性炎症性疾病存在Th17和Treg失衡[15]。有研究表明,Th17可通过分泌白细胞介素17来激活核因子-κB通路,从而上调炎症因子基因的表达,刺激促炎因子(白细胞介素6、肿瘤坏死因子α等)的产生,而肿瘤坏死因子α又可激活c-Jun氨基末端激酶和抑制核因子-κB激酶导致胰岛素受体底物的丝氨酸磷酸化,从而诱导胰岛素抵抗[16-17]。Treg及其分泌的细胞因子可以调节脂肪细胞表面转运载体-4的表达和对葡萄糖的代谢,从而阻止胰岛素抵抗的发生[18]。本研究结果显示,T2DM患者HOMA-IR指数增高(P<0.05),HOMA-β指数降低(P<0.05),提示T2DM患者存在胰岛素抵抗及胰岛B功能障碍。两组的Th17及Treg水平、Th17/Treg均在正常范围,但与健康人群相比,T2DM患者外周血Th17水平、Th17/Treg比值增高,Treg水平降低(均P<0.05),提示相对于正常人群,T2DM患者的Th17/Treg平衡相对失调,CD4+T细胞的促炎性极化可帮助区分T2DM患者与健康人群。此外,T2DM患者的Th17、Th17/Treg比值与HOMA-IR指数呈正相关,Treg细胞与HOMA-IR呈负相关(均P<0.05)。这一结果为适应性免疫调节与T2DM患者发生胰岛素抵抗提供了另一种解释,即胰岛素抵抗并非单纯由Th17细胞增高所致,可能同时是由于Treg细胞的免疫抑制功能降低引起的,而Th17与Treg的失衡可能是导致胰岛素抵抗最重要的原因之一。
T2DM的另一个重要环节是胰岛素分泌缺陷,而胰岛素分泌缺陷的原因是胰岛B功能受损。既往多数学者认为免疫炎症在胰岛素靶组织(脂肪、肝脏等)中发挥重要作用[19-20]。近年来,有研究表明,在T2DM患者的胰岛中也存在炎症因子表达、免疫细胞浸润[10]。浸润胰岛的免疫细胞产生的白细胞介素6、白细胞介素1β可破坏胰岛细胞,而CD4+T细胞亚群与炎症因子密切相关,这提示细胞免疫可能在T2DM患者的胰岛功能破坏中发挥着重要作用[21-22]。本研究中,T2DM患者外周血Treg水平与HOMA-β呈正相关,Th17水平与HOMA-β呈负相关(均P<0.05),提示T2DM患者Th17与Treg的失衡不仅可加重胰岛素抵抗,还可影响胰岛B功能。
综上所述,相对于正常人群,T2DM患者的Th17/Treg平衡相对失调,这可能与T2DM患者胰岛素抵抗、胰岛B功能受损可能有关。维持促炎性T细胞和抗炎性T细胞的平衡,对于控制T2DM的发生和发展具有重要作用。因此,可将T细胞失衡作为治疗T2DM患者的新靶点,通过调节CD4+T细胞平衡从而改善胰岛B功能并降低胰岛素抵抗。
