中华山蓼对重金属Cu胁迫的生理响应*
2019-07-30李涛李和繁徐伟江
李涛,李和繁,徐伟江
(云南师范大学 生命科学学院,教育部生物质能可持续发展与利用工程研究中心,云南 昆明 650500)
中华山蓼(Oxyriasinensis)是蓼科(Polygonaceae)山蓼属(Oxyria)植物[1],该植物具有雌雄异株的特点,主要分布在云南、四川以及西藏地区海拔1 600-3 800 m的山坡和山谷等环境资源较为匮乏的地方,且常见于铜锌矿区,被认为是铜矿的指示植物,因此中华山蓼又被称为铜矿草[2].中华山蓼可以克隆生长[3],同时具有较强的抗旱能力[4],因此中华山蓼能在恶劣的环境中通过根的克隆生长迅速占领生境,是一种较好的先锋植物.由于中华山蓼具有在矿区生长和克隆繁殖的特性,故可以作为矿区植被恢复的重要植物.然而,目前对中华山蓼在重金属胁迫下的相关研究还非常少,限制了对这一物种的合理利用.
当植物受到重金属铜胁迫时,体内会产生较多活性氧,最终导致细胞膜结构和功能的破坏,使得细胞内物质大量外渗,同时外界有毒物质也进入细胞内[5],对植物的正常发育(如蛋白质和叶绿素的合成等)造成较大的伤害[6].面临铜胁迫的环境,耐铜植物自身进化出了一套保护系统,即抗氧化系统,由超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及抗坏血酸还原酶(APX)组成,这些抗氧化酶通过清除代谢过程所产生的活性氧,将植物的活性氧含量维持在相对安全的范围[7].
本文利用不同浓度的重金属Cu(0、50、150、300和500 mg/L)对采自矿区东川和非矿区丽江、不同性别的中华山蓼进行为期一个月或两个月的处理,检测了中华山蓼的抗氧化系统的各项酶指标,主要包括SOD、POD、CAT、APX.此外还检测了处理后植株的蛋白质含量、叶绿素含量、脯氨酸(Pro)、丙二醛(MDA)及Cu2+含量等,以了解中华山蓼受重金属Cu胁迫后的一系列生理变化,为后续该物种的持续利用提供理论支持.
1 材料与方法
1.1 试验材料
2016年4月,分别在东川和丽江随机选择中华山蓼幼苗,标记幼苗的性别,然后采集地下根并用湿苔藓包好带回云南师范大学.将中华山蓼幼苗的根部用剪刀剪切成5~10 cm的长度,将其分别种植在规格一致的花盆内,并做好标记.花盆内均装有相同质量的珍珠岩和腐殖土混合土,实验开始之前正常浇水,确保中华山蓼的生长,直至长出新叶.所有的幼苗在温室中培养,温室温度和湿度等环境影响因素和外界一致.
1.2 试验设计
使用土培的方法,Cu胁迫因子来自CuSO4.用3.91 g硫酸铜加入1 L蒸馏水制备浓度为1 g/kg的Cu2+溶液,再按照相应比例稀释为50、150、300及500 mg/kg的浓度,同时设置空白对照.Cu2+采用逐层喷洒和翻土混合的形式加入,胁迫实验开始之后,定期定量进行浇水.每个浓度水平不同地区不同性别分别种有10株中华山蓼植株,处理一个月以后取5株中华山蓼植株,剩余5株在两个月以后取样.取样后进行生理指标和Cu2+含量的检测.
1.3 测定方法
抗氧化系统中酶含量(SOD、POD、CAT和APX)的测定参考Gossett[8]、Beauchamp和Fridovich[9]、Tatiana[10]、Aebi[11]及Nakano[12]等人.丙二醛(MDA)参考TBA法,可溶性蛋白参考G250法,脯氨酸(Pro)参考茚三酮测定法测定,叶绿素含量参考丙酮萃取法测定,Cu2+含量参考ICP-OES测定[13].
1.4 数据分析
利用Excel整理原始数据,再利用R软件包对其进行Box-Cox转换,并对转换后数据进行方差分析.
2 结果与分析
2.1 中华山蓼各项酶活性指标对重金属Cu胁迫的响应
2.1.1 超氧化物歧化酶
从表1可得,不同器官的SOD含量有显著差异(P<0.05),其他因素对SOD含量没有显著影响,表明中华山蓼不同器官对重金属Cu的胁迫有不同响应.从图1中看出,叶中SOD值显著高于根,且SOD由根、茎、叶逐渐递增.胁迫开始时,SOD最先做出响应,开始清除活性氧自由基[14].根部最先接受重金属胁迫且能累积较多重金属,经过茎的运输作用进入植物叶片的Cu2+一部分会被植物自身所利用,一部分将会通过叶片挥发到外界,还有一部分留在植物体内[15].虽然根中Cu2+含量较叶片多,但根部有较强的耐受性,能通过络合及螯合等作用累积大量重金属离子,减少胁迫压力,而叶片耐受性较弱,大量Cu2+的进入使其受胁迫程度较根部大,因此中华山蓼叶中SOD值显著高于根.
表1不同因素对超氧化物歧化酶含量的影响
Table1 Effects of different treatments on the content of Superoxide Dismutase
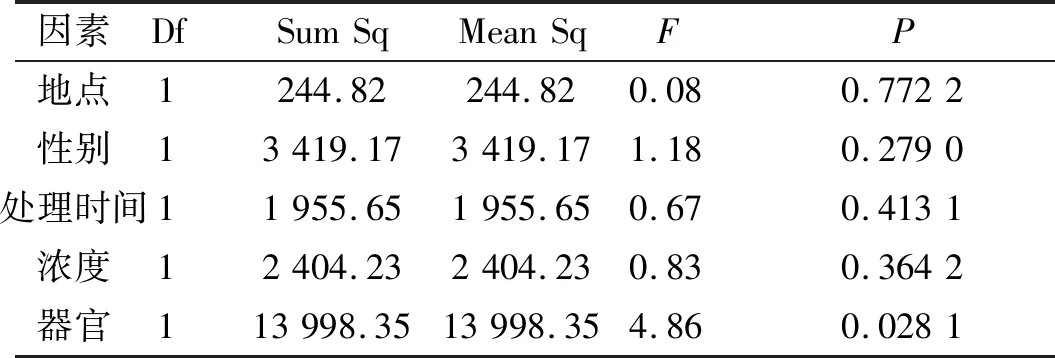
因素DfSumSqMeanSqFP地点1244.82244.820.080.7722性别13419.173419.171.180.2790处理时间11955.651955.650.670.4131浓度12404.232404.230.830.3642器官113998.3513998.354.860.0281
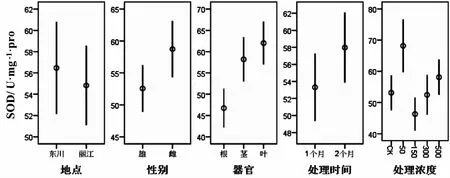
图1 不同因素对超氧化物歧化酶含量的影响Fig.1 Effects of different treatments on the content of Superoxide Dismutase
2.1.2 过氧化物酶
从表2可以看出,不同处理时间和不同部位的POD值有显著差异(P<0.05),其他因素对POD的含量没有显著影响.从图2可知,处理时间为一个月的POD值明显比处理两个月的高,而根的POD值明显比叶高.POD能分解SOD作用后得到的H2O2,又能和SOD一样消除自由基,两者互补作用,维持植物体内活性氧的平衡[16].当植物受到胁迫时,产生大量的POD,在植物适应胁迫后,活性自由基含量减少,所产生的POD也随之减少,所以,处理时间为一个月的POD值显著比处理两个月的高.由2.1.1可知,SOD在叶片中含量较多,根中较少,可能由于SOD和POD互补作用的关系,根中POD的含量增加以弥补SOD含量的不足,维持植物体内的活性氧自由基保持在相对稳定的水平[17],所以根中的POD显著比叶中的高.
表2不同因素对过氧化物酶含量的影响
Table 2 Effects of different treatments on the content of Peroxidase
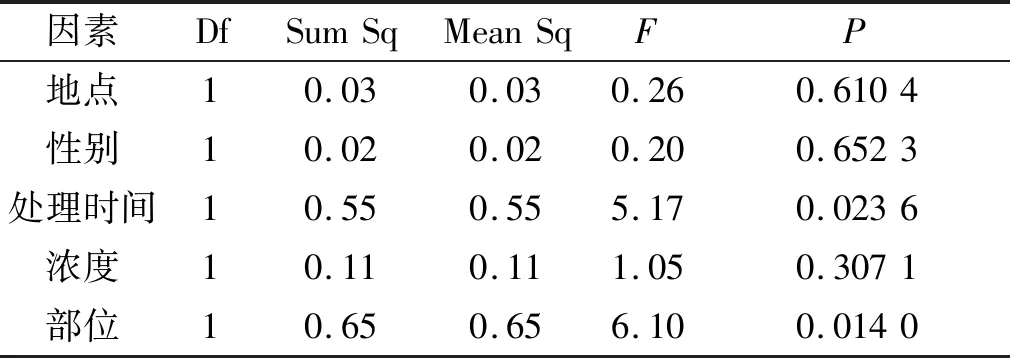
因素DfSumSqMeanSqFP地点10.030.030.260.6104性别10.020.020.200.6523处理时间10.550.555.170.0236浓度10.110.111.050.3071部位10.650.656.100.0140
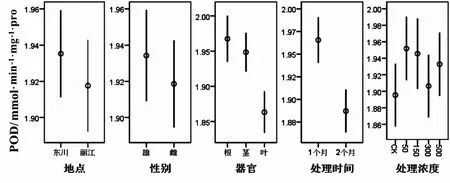
图2 不同因素对过氧化物酶含量的影响Fig.2 Effects of different treatments on the content of Peroxidase
2.1.3 过氧化氢酶
从表3可以看出,五个因素对中华山蓼植株中的CAT含量都没有显著影响(P>0.05,图3).CAT的作用是和POD一起将SOD作用后所产生的H2O2分解为氧和水,可能POD的作用已能够维持分解SOD作用后所得到的H2O2,从而使植物体内活性氧自由基维持在相对安全的范围内,从而导致CAT的含量没有显著性差异.
表3不同因素对过氧化氢酶含量的影响
Table 3 Effects of different treatments on the content of catalase
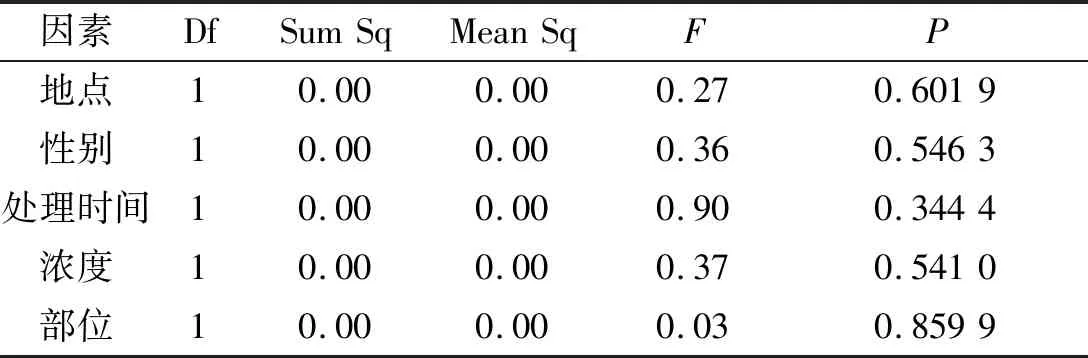
因素DfSumSqMeanSqFP地点10.000.000.270.6019性别10.000.000.360.5463处理时间10.000.000.900.3444浓度10.000.000.370.5410部位10.000.000.030.8599
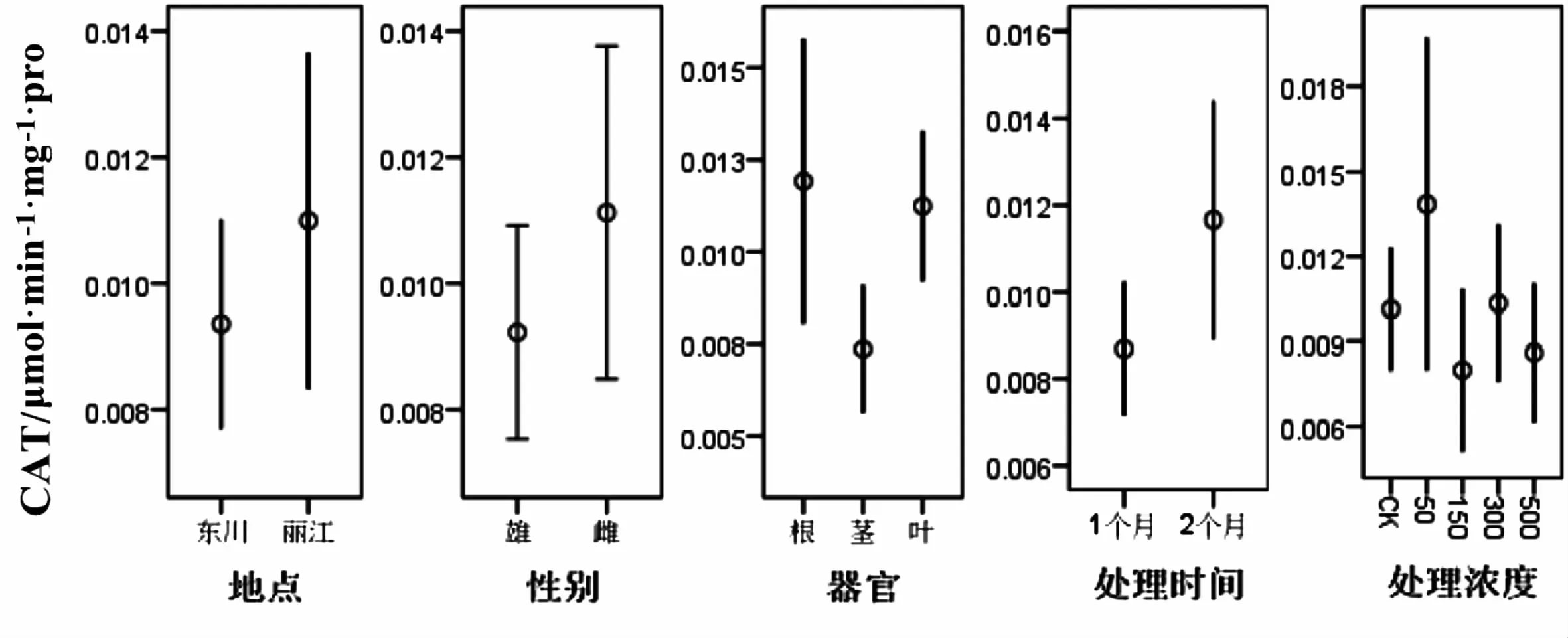
图3 不同因素对过氧化氢酶含量的影响Fig.3 Effects of different treatments on the content of catalase
2.1.4 抗坏血酸过氧化物酶
利用R软件包对数据做Box-Cox处理后,地点、性别、处理时间和浓度四个影响因素均满足方差分析要求,但不同器官的APX含量不满足,对其进行非参数检验,得出总体分布存在显著差异(P<0.05).从表4可以看出,四种因素对APX值均没有显著影响(P>0.05,图4).APX可使超氧自由基活性降低,清除叶绿体内的H2O2,其含量没有明显差异的原因可能和CAT类似.
表4不同因素对抗坏血酸还原酶含量的影响
Table 4 Effects of different treatments on the content of ascorbate reductase
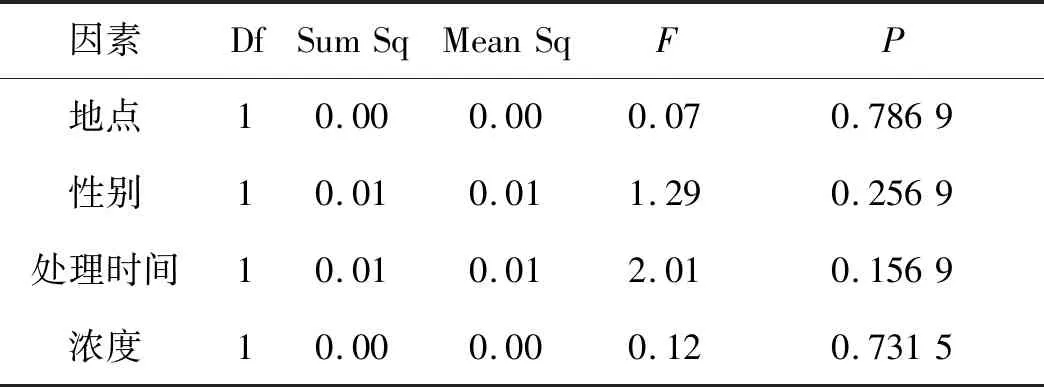
因素DfSumSqMeanSqFP地点10.000.000.070.7869性别10.010.011.290.2569处理时间10.010.012.010.1569浓度10.000.000.120.7315
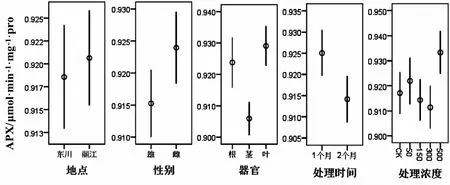
图4 不同因素对抗坏血酸还原酶含量的影响Fig.4 Effects of different treatments on the content of ascorbate reductase
2.2 中华山蓼的蛋白质含量对重金属Cu胁迫的响应
利用R软件包对数据做Box-Cox处理后,地点、性别、浓度和器官四个影响因素均满足方差分析要求,但不同处理时间下不满足,对其进行非参数检验.不同处理时间的蛋白质含量的总体分布不存在明显差异(P>0.05);从表5可以看出,不同器官的蛋白质含量呈现显著性差异(P<0.05),其余三个因素都不显著,说明中华山蓼的不同器官(根、茎、叶)的蛋白质含量对重金属Cu的胁迫存在不同的响应.从图5可以知,叶中蛋白质含量明显比根和茎低.植物在受到胁迫时,植物体内会合成大量蛋白质,用来螯合重金属,降低其毒性,维持正常的细胞代谢[18].根部为最先接触胁迫的一个器官,所以根部的蛋白质含量最高.
表5不同因素对蛋白质含量的影响
Table 5 Effects of different treatments on the content of proteins
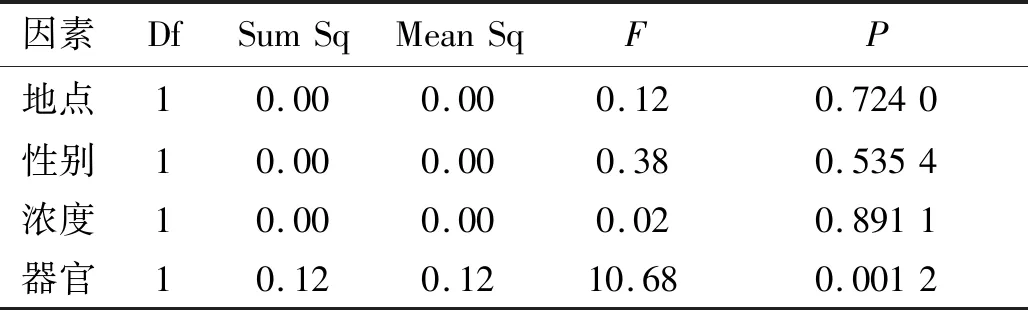
因素DfSumSqMeanSqFP地点10.000.000.120.7240性别10.000.000.380.5354浓度10.000.000.020.8911器官10.120.1210.680.0012
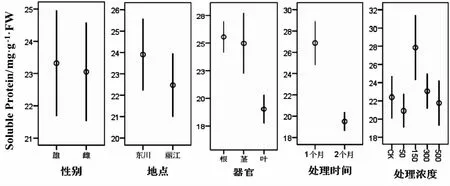
图5 不同因素对蛋白质含量的影响Fig.5 Effects of different treatments on the content of proteins
2.3 丙二醛、脯氨酸和叶绿素含量
由于MDA、Pro及叶绿素含量仅在中华山蓼的叶片中开展了检测,所以不存在不同器官这一影响因素.
2.3.1 丙二醛
利用R软件包对数据做Box-Cox处理后,地点、性别和浓度三个因素均满足方差分析要求,不同处理时间的MDA含量不满足,对其进行非参数检验,得出总体分布有明显差异(P<0.05);从表6可知,地点、性别和浓度三个因素对MDA的含量无明显影响(P>0.05).MDA是衡量膜脂过氧化损害的指标,MDA含量增加,细胞膜透性增大,最终导致细胞对重金属的吸收增大,但本研究中不同处理浓度、不同取样地点、不同性别及不同部位中华山蓼MDA的含量均不存在显著性差异,表明其细胞膜没有受到重金属Cu的损伤,证明中华山蓼是一种耐铜的植物.虽然处理时间增长会造成MDA含量累积显著提高的现象,但总体水平下,并未造成对中华山蓼植株的伤害.
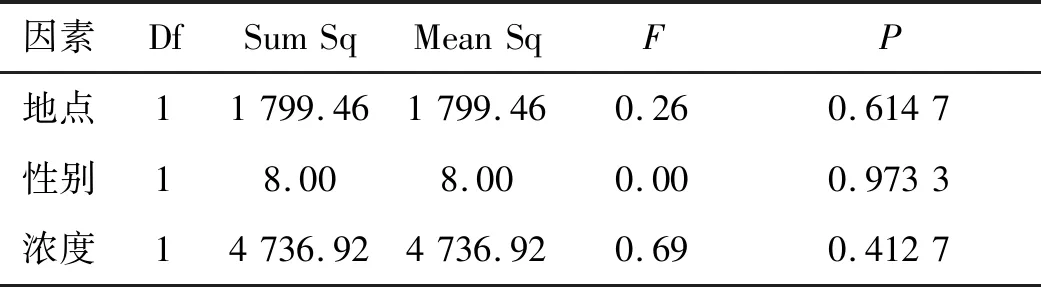
表6 不同因素对MDA的影响Table 6 The effect of different factors on MDA
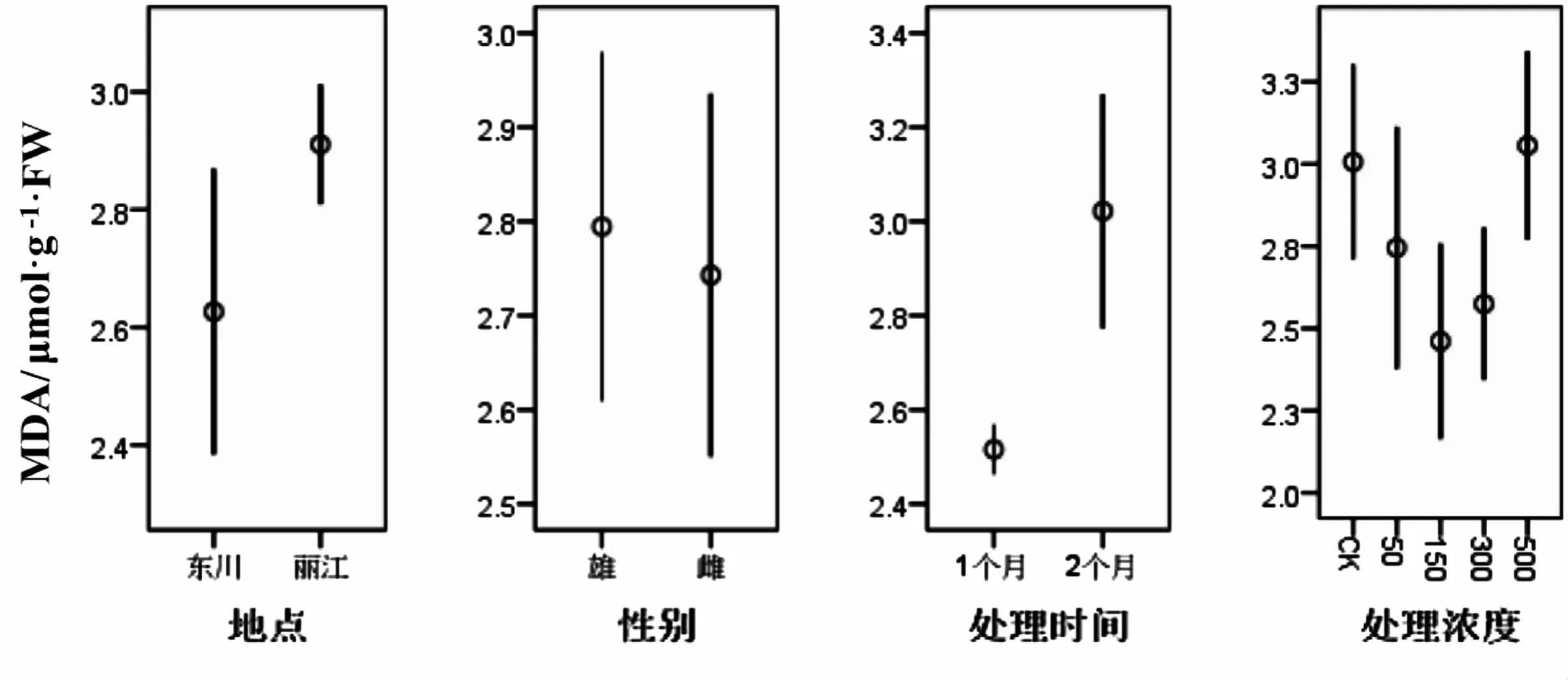
图6 不同因素对MDA的影响Fig.6 The effect of different factors on MDA
2.3.2 脯氨酸
从表7得出,不同处理时间对Pro含量有明显影响(P<0.01),其他的因素均没有.从图7得出,时间为一个月的Pro含量极显著高于两个月的.Pro作为重要的调节渗透物质,通常它在植物中含量不高,但当植物处于胁迫下,其含量就会提高,但当植物已经能抵抗胁迫,确保植物内环境处于稳定状态,Pro含量随之降低.
表7不同因素对Pro含量的影响
Table 7 Effects of different treatments on the content of Pro
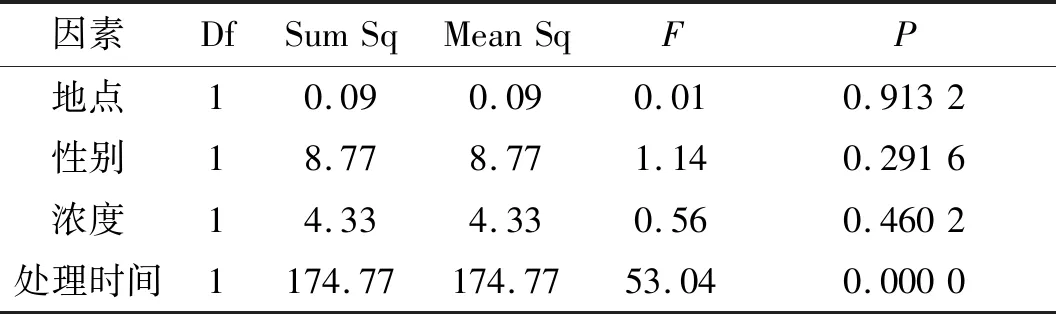
因素DfSumSqMeanSqFP地点10.090.090.010.9132性别18.778.771.140.2916浓度14.334.330.560.4602处理时间1174.77174.7753.040.0000
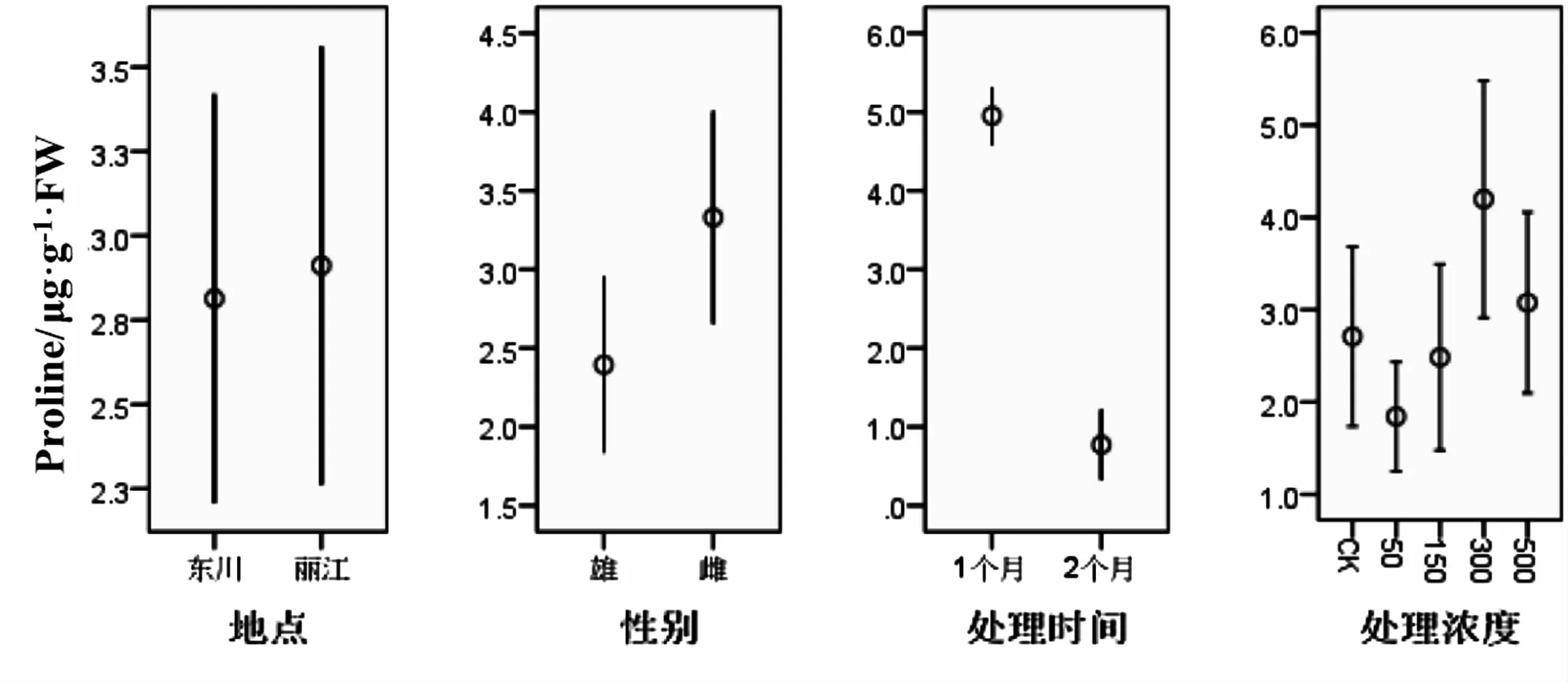
图7 不同因素对Pro含量的影响Fig.7 Effects of different treatments on the content of Pro
2.3.3 叶绿素含量
从表8可以看出,不同地点和不同时间对中华山蓼叶绿素值有明显影响(P<0.05),其他的因素均无影响.从图8可以看出,东川的中华山蓼的叶绿素含量显著高于丽江,处理时间为一个月的中华山蓼叶绿素含量显著高于两个月的.叶绿素的多少可直接反映出植物的生长情况,采集自东川矿区的中华山蓼对重金属的耐受性较非矿区丽江的中华山蓼强,所以当受到胁迫时,东川地区的中华山蓼的叶绿素含量显著高于丽江地区的中华山蓼,随着处理时间的增加,重金属胁迫能影响叶绿素的合成,造成植物色素含量降低,因此,处理时间为一个月的叶绿素含量显著高于两个月的.
表8不同因素对叶绿素含量的影响
Table 8 Effects of different treatments on the content of chlorophyll
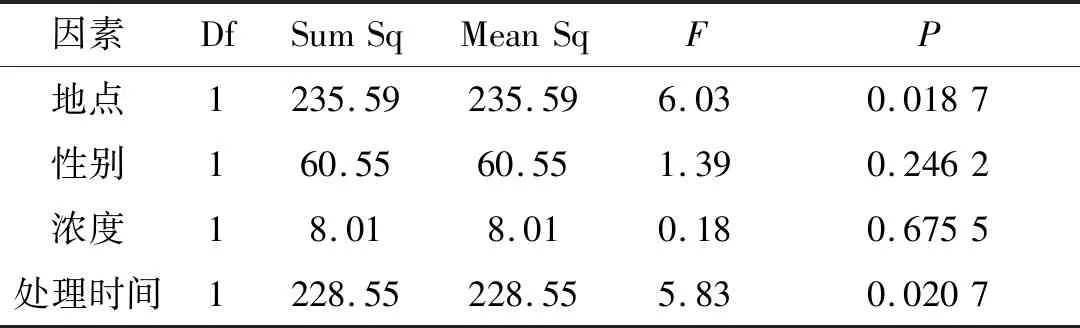
因素DfSumSqMeanSqFP地点1235.59235.596.030.0187性别160.5560.551.390.2462浓度18.018.010.180.6755处理时间1228.55228.555.830.0207
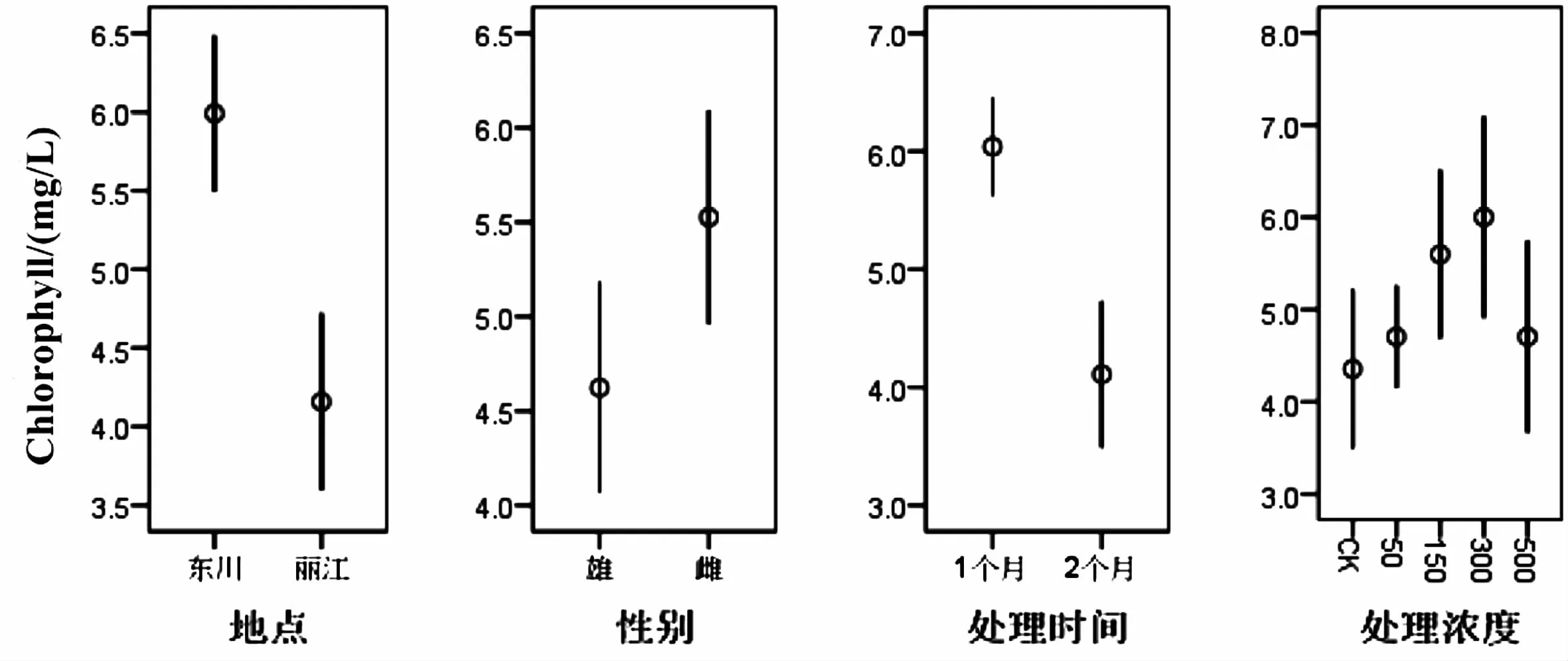
图8 不同因素对叶绿素含量的影响Fig.8 Effects of different treatments on the content of chlorophyll
2.4 不同处理下中华山蓼体内Cu2+含量对重金属Cu胁迫的响应
利用R软件包对数据做Box-Cox处理后,地点、性别、处理时间、浓度四个因素均满足方差分析要求,不同器官的Cu2+含量不满足,进行非参数检验,得出总体分布是有明显差异(P<0.05);从表9可知,不同浓度和不同时间对中华山蓼的Cu2+含量有明显影响(P<0.05),其他因素的影响均不显著.从图9可得,时间为一个月的Cu2+含量显著比两个月的高,不同处理浓度下的Cu2+含量显著比对照组高.其原因可能是:实验初期,中华山蓼对Cu因子还未产生有效的应对机制,当植物受到一段时间的胁迫后,会外排或阻止重金属Cu的吸收,还可以通过螯合、络合作用来减少游离态金属离子,所以处理时间不同,植物体内Cu2+含量会有所差异.不同处理浓度下中华山蓼体内Cu2+含量显著高于对照组是必然结果.
表9不同因素对Cu2+含量的影响
Table 9 Effects of different treatments on the content of heavy Metal Cu
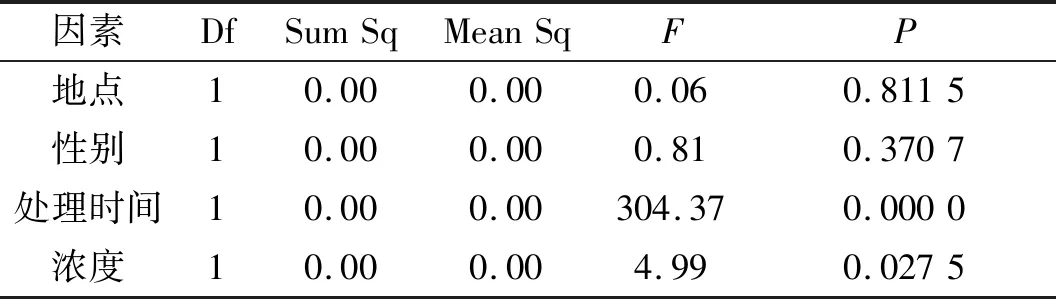
因素DfSumSqMeanSqFP地点10.000.000.060.8115性别10.000.000.810.3707处理时间10.000.00304.370.0000浓度10.000.004.990.0275
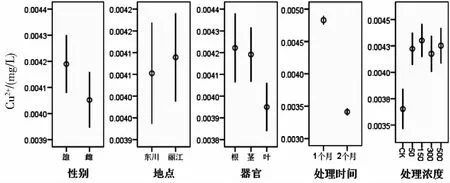
图9 不同因素对Cu2+含量的影响Fig.9 Effects of different treatments on the content of Cu2+
3 讨论与小结
在重金属胁迫的环境下,植物体内的活性氧累积会引起膜脂过氧化,最终破坏细胞结构和功能.植物体内的抗氧化物酶系统(SOD、POD、CAT和APX)则可以清除植物体内的活性自由基,保持体内活性氧的平衡,使细胞膜不受活性氧的伤害[19].本研究中,SOD作为植物抵抗逆境胁迫的第一道防线,在中华山蓼对重金属Cu的胁迫响应中起到了重要的作用.该物种不同部位SOD的含量存在显著性差异,叶中SOD含量显著高于根,可能是由于根部有较强的耐受性,能通过络合及螯合等作用累积重金属离子,减少胁迫压力,但叶片耐受性弱受胁迫程度大.POD在重金属Cu胁迫中协助SOD消除活性氧,使植物体内活性氧维持在稳定水平.不同处理下CAT和APX对重金属Cu的胁迫均没表现出显著差异响应,导致这样结果的原因可能是中华山蓼对重金属Cu耐受性较强,POD和SOD的协同作用就能维持植物体内的活性自由基的稳定.
重金属离子在植物体内与其他化合物结合成金属络合物或螯合物,导致植物代谢活动受到抑制尤其是蛋白质的合成[20].因此,可溶性蛋白的多少可以直观地反映出植物是否受到胁迫的伤害.从图5得出,中华山蓼不同部位(根、茎、叶)的可溶性蛋白质含量有显著差异,根系可溶性蛋白含量显著比茎和叶高,茎的可溶性蛋白质含量显著高于叶片,表明根对Cu的耐受性最强.
MDA是膜脂过氧化的产物之一,因此其含量是植物在逆境条件下受害程度的体现.游离脯氨酸的功能是能调节渗透平衡、抵制超氧自由基所产生的伤害作用及加强细胞结构上的稳定程度,类似于可溶性蛋白.叶绿素的含量和植物光合作用的速率有着直接的联系,而光合作用又是提供植物生长发育的物质基础和能量来源的重要环节[21-22].从图6-8可知,在重金属Cu胁迫下,不同处理下MDA含量均没有明显差异,表明Cu2+对植物的伤害程度较低,也验证了中华山蓼对重金属Cu有较高的耐受性.不同处理时间下中华山蓼的Pro和叶绿素含量对重金属Cu的胁迫均表现出不同的响应,时间为一个月的Pro和叶绿素含量均显著比第二个月高.Pro的作用是调节植物体内的渗透压,只有在受到胁迫的时候其含量会增加,当中华山蓼适应胁迫环境之后,Pro又降低到一个正常水平.重金属Cu胁迫能影响叶绿体中的类囊体薄膜,高浓度的铜能使叶绿素酶失活,加速叶绿体的分解,从而导致叶绿素合成受到影响.本研究发现来自东川矿区的中华山蓼的叶绿素含量显著高于丽江地区,可能是由于东川的中华山蓼长期处于矿区的胁迫环境下,其叶绿素的合成已适应了重金属Cu胁迫.
总之,中华山蓼对重金属Cu胁迫具有较强的耐受能力,主要表现在SOD和POD的含量差异,而抗氧化系统中其他的酶可能并未参与到耐受胁迫过程中;而受重金属胁迫后植物常见的蛋白质含量和Pro含量升高、叶绿素含量降低现象,在中华山蓼中仅表现为蛋白质含量的增加,进一步证明了中华山蓼对重金属Cu胁迫的耐受能力.此外,在重金属Cu的胁迫下,来自矿区(东川)的中华山蓼比非矿区(丽江)的植株具有更强的耐受性,主要表现在叶绿素含量的差异,表明东川矿区的中华山蓼对重金属Cu胁迫的适应能力较强,可能已经形成独特的遗传资源.因此,在开展矿区生态恢复时,中华山蓼可作为备选植物之一,而生长在矿区的中华山蓼植株可作为矿区植被恢复的重要种质资源.
