细胞蛋白质组学和代谢组学整合策略表征散斑型BTB/POZ蛋白质突变调控的关键代谢通路
2019-07-30许国旺朴海龙
颜 敏,刘 静,夏 天,许国旺,朴海龙*
(1.中国科学院大连化学物理研究所,中国科学院分离分析重点实验室,辽宁 大连 116023;2.中国科学院大学,北京 100049)
世界范围内,前列腺癌是发病率第二、死亡率第五的男性癌症[1]。近期的流行病学统计发现,在中国,前列腺癌发病率正在逐年提高[2],并具有低龄化趋势[3]。代谢紊乱是前列腺癌特征之一。正常前列腺组织中含有高浓度的锌,可通过抑制乌头酸酶使柠檬酸氧化受阻,导致柠檬酸浓度升高[4]。在转变为前列腺癌后,组织中锌浓度降低,三羧酸(TCA)循环得到恢复,因此可产生更多ATP促进癌细胞增殖[5]。另外,脂代谢紊乱也是前列腺癌的一个重要特征。研究发现,同源性磷酸酶-张力蛋白(PTEN)缺失的前列腺癌中胆固醇酯含量增加,并能够促进前列腺癌侵袭和增殖[6]。因此,代谢紊乱已成为前列腺癌新的研究趋势。
在前列腺癌中,散斑型BTB/POZ蛋白(SPOP)是突变频率最高的蛋白之一,6%~15%的前列腺癌患者携带SPOP突变[7]。SPOP是一种E3泛素化连接酶,可以介导底物蛋白质发生泛素化降解[8]。已知SPOP底物雄激素受体(AR)、DEK-原癌基因和ETS转录因子(ERG)等均为代谢相关重要因子[9-11]。因此,推断SPOP突变与前列腺癌代谢紊乱高度相关。在之前的研究中,本课题组[12]通过对SPOP突变前列腺癌和癌旁组织进行代谢组学分析后发现,SPOP突变可促进TCA循环和脂肪酸代谢中多个基因和代谢物表达量增加。但是,还没有基于整合组学对SPOP调控的代谢通路进行深层次分子机制研究。
代谢组学是研究生物体内代谢物变化规律的一门新兴技术,已被用来研究多种疾病机制[13]。其中,基于细胞的代谢组学分析主要用来研究药物及基因引起的代谢重编程[14,15]。蛋白质组学是研究生物体内大分子蛋白质变化规律的技术[16]。在本研究中,利用LNCaP对照组细胞(LNCaP CON)、LNCaP SPOP野生型过表达细胞(SPOP_WT)、LNCaP SPOP Y87N突变体过表达细胞(SPOP_Y87N)和F133L突变体过表达细胞(SPOP_F133L),进行代谢组学及蛋白质组学分析。研究了SPOP突变调控的代谢物、代谢酶及代谢通路,并在Du145 SPOP敲除细胞系中进行了验证。
1 实验部分
1.1 仪器与试剂
使用GCMS-QP 2010气相色谱-质谱联用仪(日本岛津)进行代谢组学分析。使用DGU-20A5液相色谱碱性-pH RPLC(日本岛津)进行肽段分离。使用ultra-HPLC EASY-nLC 1000系统连接Q Exactive质谱(美国Thermo Fisher Scientific)进行蛋白质组学分析。使用Fusion Fx化学发光仪(法国VILBER)进行蛋白免疫印迹(western blot)分析。
超纯水来自于Milli-Q水纯化系统(美国Millipore)。纯乙腈和纯甲醇购自德国Merck公司。甲氧胺盐酸盐(纯度≥98%)、吡啶(纯度≥99.9%)、二氯甲烷(纯度≥99.8%)、N-甲基-N-(三甲基硅基)三氟乙酰胺(MSTFA,纯度≥98.5%)、十三酸(纯度≥98%)、二硫苏糖醇(DTT,纯度≥99%)、碘乙酰胺(IAA,纯度≥99%)、尿素(纯度≥99.5%)、28%(质量分数)氨水、甲酸(纯度≥96%)和乙酸铵(纯度≥98%)购自美国西格玛奥德里奇公司。Tris-Cl(纯度≥99.9%)、EDTA(纯度≥99.5%)、5%(体积分数)Nonidet P-40(NP-40)水溶液、脱氧胆酸(纯度≥99%)和5%(体积分数)Triton水溶液均购自中国索莱宝公司。NaCl(纯度≥99.5%)和甘油(纯度≥99%)购自中国科密欧公司。RPMI 1640培养基、DMEM培养基、磷酸盐缓冲溶液(PBS)、杀稻瘟菌素(10 g/L)、嘌呤霉素(10 g/L)、双抗(10 000单位青霉素/mL和10 000 μg链霉素/mL)、细胞转染试剂、上样缓冲溶液和串列质量标签(tandem mass tag,TMT)均购自美国Thermo Fisher Scientific公司。胎牛血清购自德国Serana公司。10 cm培养皿购自美国Corning公司。聚偏二氟乙烯(PVDF)膜购自美国Bio-Rad公司。蛋白酶和磷酸化抑制剂购自美国InvivoGen公司。
放射免疫沉淀测定(radio-immunoprecipitation assay,RIPA)裂解液由实验室自配,包含50 mmol/L pH7.4的Tris-Cl、150 mmol/L NaCl、1 mmol/L pH8的EDTA、1%(体积分数,下同)NP-40、0.125%脱氧胆酸、10%甘油、1% Triton和1%蛋白酶和磷酸化抑制剂,并用纯水补齐。兔抗人SPOP多抗(16750-1-AP,1∶1 000,v/v)和兔抗人Flag多抗(20543-1-AP,1∶1 000,v/v)购自美国Proteintech公司,鼠抗人Vinculin单抗(V4505,1∶2 000,v/v)购自美国西格玛奥德里奇公司。
SPOP_WT和突变型(Y87N和F133L)质粒分别由中国科学院北京基因组研究所刘江教授和复旦大学王陈继教授赠予。将其克隆到带有3×Flag标签的pLOC-RFP载体上,质粒酶切位点为Not I和Nhe I。通过BsmBI酶切位点将SPOP CRISPR/Cas9插入序列克隆到lentiCRISPRv2载体上。SPOP CRISPR/Cas9插入序列分别为sgSPOP1:CCAGTAACAGGTAAAGTGAC;sgSPOP2:GGTTT GTGCAAGGCAAAGAC;sgSPOP3:CAAGCTTACC CTCTTCTGCG。
1.2 细胞培养和转染
LNCaP和Du145细胞均培养在含10%胎牛血清和1%双抗的RPMI 1640培养基中。HEK293T细胞培养在含10%胎牛血清和1%双抗的DMEM培养基中。质粒转染是通过在HEK293T细胞中包慢病毒对癌细胞进行感染的方法进行的。LNCaP CON(pLOC-RFP空载体)、SPOP_WT、SPOP_Y87N、SPOP_F133L慢病毒包装好后,经0.22 μm滤器过滤,加入LNCaP细胞,感染24 h。72 h后,用杀稻瘟菌素进行筛选。sgControl、sgSPOP1、sgSPOP2、sgSPOP3慢病毒包装好后,经0.22 μm滤器过滤,加入Du145细胞感染24 h。72 h后,通过嘌呤霉素进行筛选。
1.3 Western blot分析
加入RIPA裂解液进行细胞裂解。于4 ℃以12 000 r/min的速度离心15 min,取上清,加入上样缓冲溶液变性。等量的蛋白质通过SDS-聚丙烯酰胺凝胶电泳分离,结束后将蛋白转移到PVDF膜上。一抗4 ℃孵育过夜,二抗室温孵育1 h后,通过化学发光试剂进行条带检测。
1.4 细胞代谢物提取及衍生
10 cm细胞培养皿培养细胞达到80%时,抽走培养液,用4 ℃的PBS冲洗2次。加入1 mL含10 mg/L十三酸的甲醇-水(4∶1,v/v)溶液,将细胞刮下至Eppendorf(EP)管中,充分涡旋。于4 ℃以14 258 r/min的速度离心15 min,取上清,混合每种样品得到质量控制样本,冻干。
采用两步法对冻干的样本进行硅烷化衍生。首先,在每个样品中加入50 μL甲氧胺吡啶溶液(20 g/L),于37 ℃反应1.5 h。然后,在每个样品中加入40 μL MSTFA,于37 ℃反应1 h后,于4 ℃以13 273 r/min的速度离心15 min,取上清进样。
1.5 代谢组学分析
GC-MS代谢组学分析条件和文献[17]所述相同,只稍作改变。简单来讲,样品通过30 m×250 μm×0.25 μm DB-5 MS毛细管柱(美国J&W Scientific)进行分离。初始柱温为70 ℃,保持3 min,以5 ℃/min的速率升至300 ℃,保持10 min。采用电子轰击电离源,温度为230 ℃,采用70 eV电离模式。通过ChromaTOF 4.43软件(美国LECO)进行解卷积、峰检测,并结合数据库及组内标样进行代谢物定性。通过GCMS solution软件(日本岛津)进行定量分析,得到原始代谢物峰表。
1.6 蛋白质组学分析
细胞重悬到8 mol/L的尿素中,超声破碎。定量后,于56 ℃下和DTT孵育1 h,打开二硫键,在暗室中与IAA反应40 min,进行烷基化。用50 mmol/L pH 8.0 PBS将体系中的尿素稀释到1 mol/L,并按照质量比1∶50(酶:蛋白)的比例加入胰酶,于37 ℃过夜孵育并除盐。LNCaP CON、SPOP_WT、SPOP_Y87N和SPOP_F133L样品分别用TMT进行标记。将TMT试剂溶解在41 μL的无水乙腈中,加入50 μg的肽段。室温孵育1 h后,加入8 μL 5%氨水淬灭,孵育15 min。等质量混合LNCaP CON、SPOP_WT、SPOP_Y87N和SPOP_F133L样品。
通过DGU-20A5液相色谱碱性-pH RPLC进行肽段分离。使用缓冲液A(pH 10,含2%乙腈、98%水、10 mmol/L乙酸铵)和缓冲液B(pH 10,含80%乙腈、20%水、10 mmol/L乙酸铵)在自制的C18柱上以0.5 mL/min的流速梯度洗脱。梯度为:0.01~57.00 min,6.25%B~43.75%B;57.00~60.00 min,43.75%B~100%B。将肽段分离为60个组分,按照1+13+25+37+49、2+14+26+38+50、……、12+24+36+48+60的顺序分别合并各组分,得到12个样本。冻干后用含0.1%甲酸的水复溶。
接下来,进行LC-MS/MS蛋白质组学分析。样本在自制的C18柱(150 mm×150 μm,1.9 μm)上分离。缓冲液A为含0.1%甲酸的乙腈-水(2∶98,v/v);缓冲液B为含0.1%甲酸的乙腈-水(98∶2,v/v)。流动相流速为600 nL/min。梯度洗脱程序为:0~45 min,5%B~25%B;45~65 min,25%B~40%B;65~70 min,40%B~80%B。通过数据依赖模式,在Orbitrap全扫描模式、70 000分辨率条件下,从m/z300到1 800进行扫描。自动增益控制目标设定为3×106离子容量,最大注入时间设定为60 ms。二级碎片采集分辨率为17 500。
1.7 数据处理和统计分析
通过内标峰面积和蛋白质干重对代谢组学数据校正后进行分析。通过(代谢物峰面积-均值)/标准差进行归一化,并通过MeV 4.8.1软件进行热图可视化。通过SIMCA-P 11.0软件(瑞典Umetrics)进行偏最小二乘判别分析(PLS-DA),统计主成分1上变量重要性投影(variable importance for the projection,VIP)值大于1的代谢物。通过单因素方差分析进行3组及3组以上的比较,通过T检验进行两组间的比较。通过在线软件MetaboAnalyst 3.0[18]和KOBAS 3.0[19]分别进行差异代谢物和差异蛋白通路富集分析。通过GraphPad Prism 5软件绘制柱状图。
2 结果与讨论
2.1 SPOP突变对前列腺癌LNCaP细胞代谢的影响
构建了LNCaP CON、SPOP_WT、SPOP_Y87N和SPOP_F133L 4种细胞系。Y87N和F133L突变位点位于SPOP底物结合域,为前列腺癌病人中最常见的突变[7]。Western blot分析(见图1)发现,SPOP_WT、SPOP_Y87N和SPOP_F133L细胞中SPOP表达上调,说明高表达细胞系构建成功。
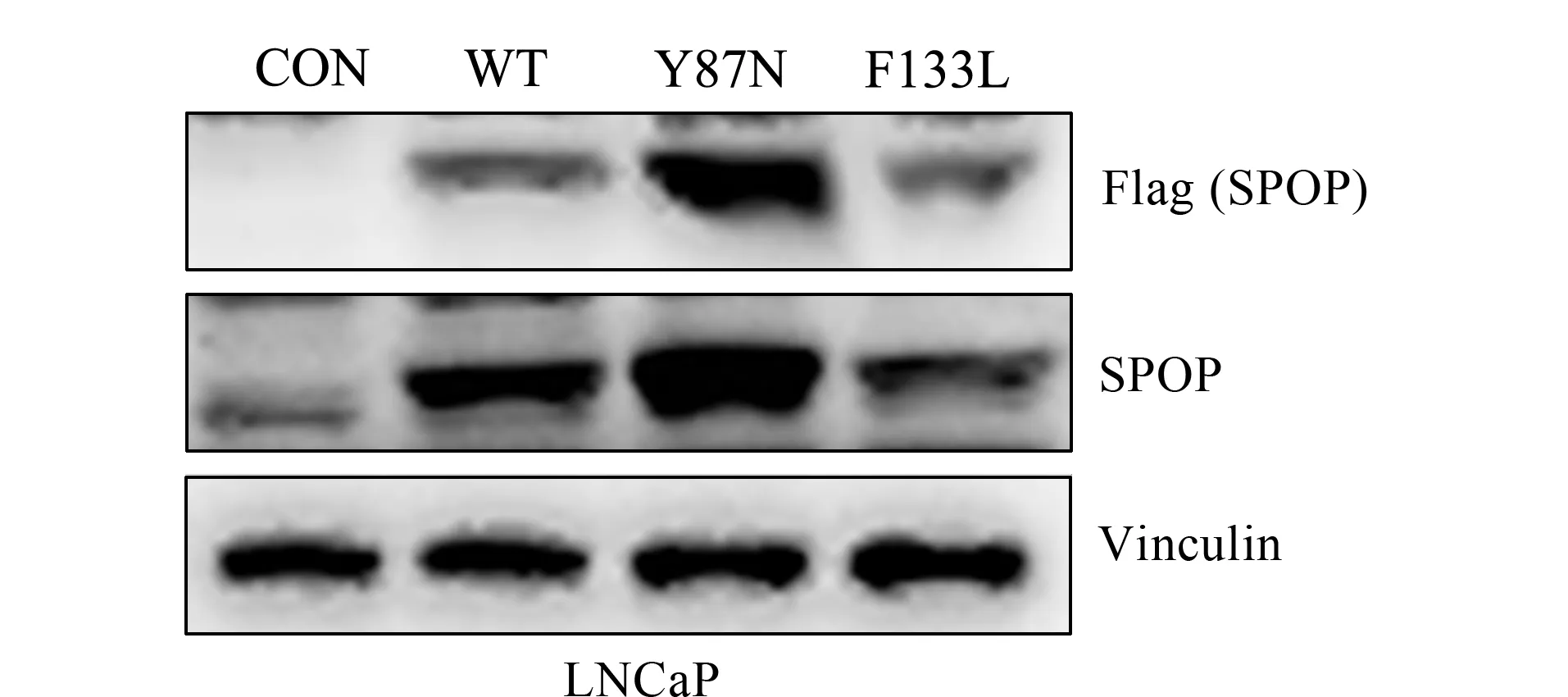
图1 Western blot分析LNCaP对照组(LNCaP CON)、LNCaP散斑型BTB/POZ蛋白(SPOP)野生型过表达(SPOP_WT)、LNCaP SPOP Y87N突变体过表达(SPOP_Y87N)和F133L突变体过表达(SPOP_F133L)细胞 Fig.1 Western blot analysis of LNCaP control cells(LNCaP CON),speckle type BTB/POZ protein(SPOP)_WT over expressed LNCaP(SPOP_WT)cells,SPOP_Y87N mutation over expressed LNCaP(SPOP_Y87N)cells,and SPOP_F133L mutation over expressed LNCaP(SPOP_F133L)cells Vinculin was used as a loading control.CON:LNCaP CON;WT:SPOP_WT;Y87N:SPOP_Y87N;F133L:SPOP_F133L.
分析LNCaP CON、SPOP_WT、SPOP_Y87N和SPOP_F133L 4种细胞代谢组学变化情况,发现多种代谢物(如氨基酸和有机酸等)在转入SPOP_WT及SPOP突变体质粒后发生了变化(见图2)。PLS-DA分析(见图3)发现,代表解释能力的模型解释的X变量变化分数R2X=0.512,范围≤1;模型解释的Y变量变化分数R2Y=0.616,范围≤1;代表模型预测能力的Q2=0.475,范围≤1。说明该模型具有较好的解释和预测能力。其中,SPOP_Y87N、SPOP_F133L与SPOP_WT分组明显。所有代谢物在主成分1上VIP值的变化见图4,共有36种代谢物的VIP值大于1。通过MetaboAnalyst 3.0软件进行代谢通路分析,结果显示氨酰基-tRNA生物合成、氮代谢、TCA循环以及多种氨基酸代谢通路发生明显变化(见图5a)。
接下来,对这36种代谢物进一步通过单因素方差分析,结合Tukey’s Multiple Comparison事后检验的方式进行比较,通过韦恩图可以看出共有2种代谢物在SPOP_WT、SPOP_Y87N、SPOP_F133L与LNCaP CON细胞的比较中均有显著性差异(见图5b)。通过柱状图分析(见图6)发现,天冬氨酸的量在SPOP_WT细胞中显著降低,在SPOP_Y87N和SPOP_F133L细胞中显著上升。天冬酰胺的量在SPOP_WT细胞中显著降低。另外,TCA循环中间代谢产物柠檬酸、富马酸和苹果酸的量也在SPOP_WT细胞中显著降低。由此可以推测SPOP突变可促进TCA循环。
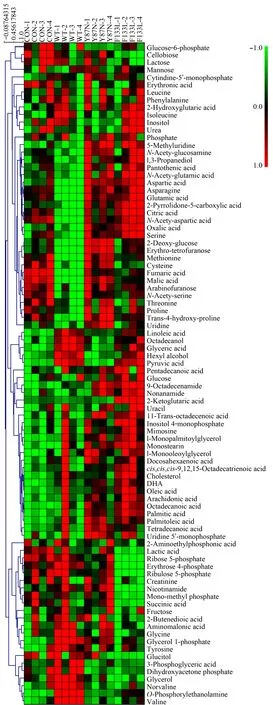
图2 热图分析LNCaP CON、SPOP_WT、SPOP_Y87N和SPOP_F133L细胞发生的代谢物变化(n=4)Fig.2 Heatmap visualization of the changes in allmetabolites of LNCaP CON,SPOP_WT,SPOP_Y87N,and SPOP_F133L cells(n=4) DHA:docosahexenoic acid.
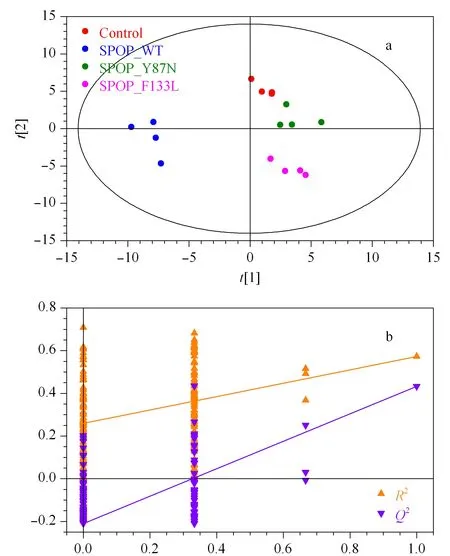
图3 偏最小二乘法判别分析(PLS-DA)LNCaP CON、SPOP_WT、SPOP_Y87N和SPOP_F133L细胞Fig.3 Partial least squares-discrimination analysis(PLS-DA)of LNCaP CON,SPOP_WT,SPOP_Y87N,and SPOP_F133L cells a.PLS-DA score plot of LNCaP CON,SPOP_WT,SPOP_Y87N,and SPOP_F133L cells.b.PLS-DA validation plot of LNCaP CON,SPOP_WT,SPOP_Y87N,and SPOP_F133L cells.Q2 indicates predictive ability and R2 indicates explanation ability.The intercepts of Q2 and R2 are -0.214 and 0.258,respectively.
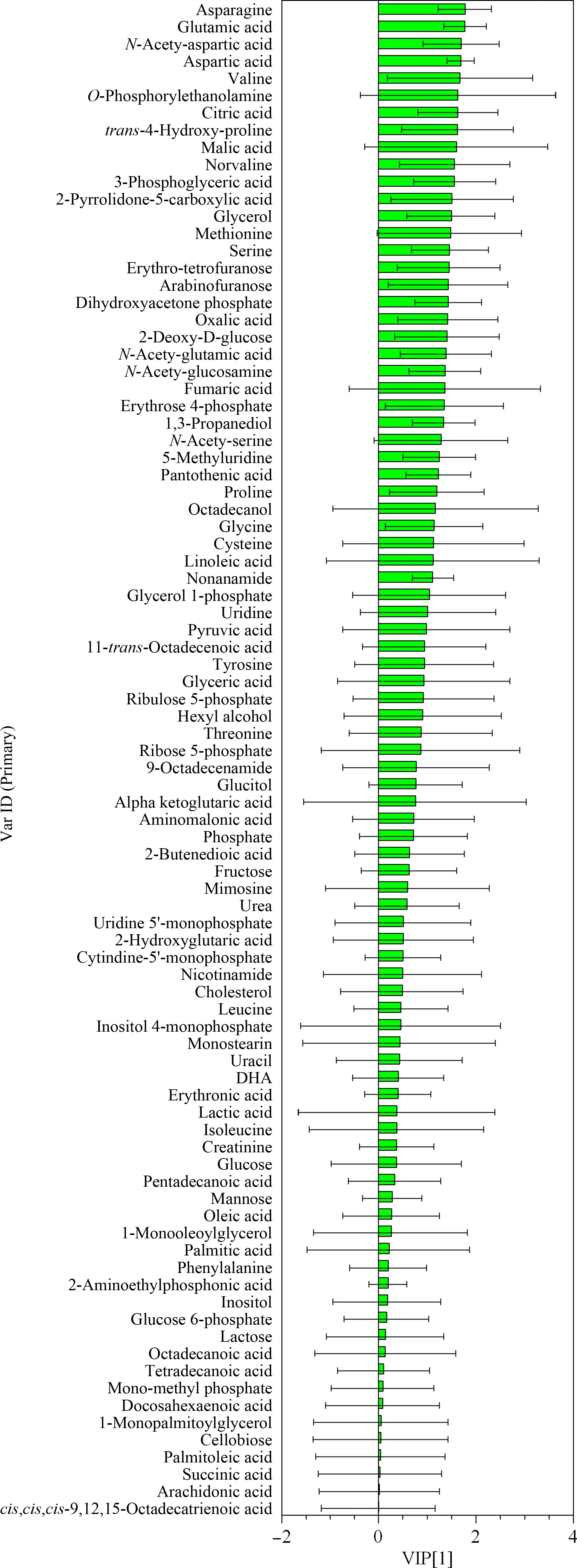
图4 变量重要性投影值分布图Fig.4 Distribution plot of variable importance for the projection(VIP)value

图5 SPOP突变对LNCaP细胞中代谢通路的影响Fig.5 Effects of SPOP mutation on the metabolic pathways in LNCaP cells a.MetaboAnalyst analysis of metabolic pathways by 36 altered metabolites (VIP value>1).b.Venn diagram of differential metabolites in SPOP_WT,SPOP_Y87N and SPOP_F133L cells by one-way analysis of variance (ANOVA).

图6 LNCaP CON、SPOP_WT、SPOP_Y87N和SPOP_F133L细胞中天冬氨酸、天冬酰胺、富马酸、苹果酸和柠檬酸的变化(n=4)Fig.6 Changes in aspartic acid,asparagine,fumaricacid,malic acid and citric acid in LNCaP CON,SPOP_WT,SPOP_ Y87N,and SPOP_F133L cells(n=4) * p<0.05;** p<0.01;*** p<0.001.Data were expressed as mean±SD.
2.2 蛋白质组学分析SPOP突变调控的生物大分子
通过蛋白质组学发现,相比SPOP_WT细胞,SPOP_Y87N和SPOP_F133L细胞中分别有1 352和2 014个蛋白质表达发生变化,其中909个蛋白质在两组比较中都具有显著性差异(p<0.01,见图7)。通过KOBAS 3.0软件对909个差异蛋白质进行通路分析,发现碳代谢、脂肪酸代谢、tRNA生物合成、脂肪酸降解、糖酵解/糖异生、氧化磷酸化、丙酮酸代谢、TCA循环以及磷酸戊糖途径等代谢通路发生明显变化(见图7)。
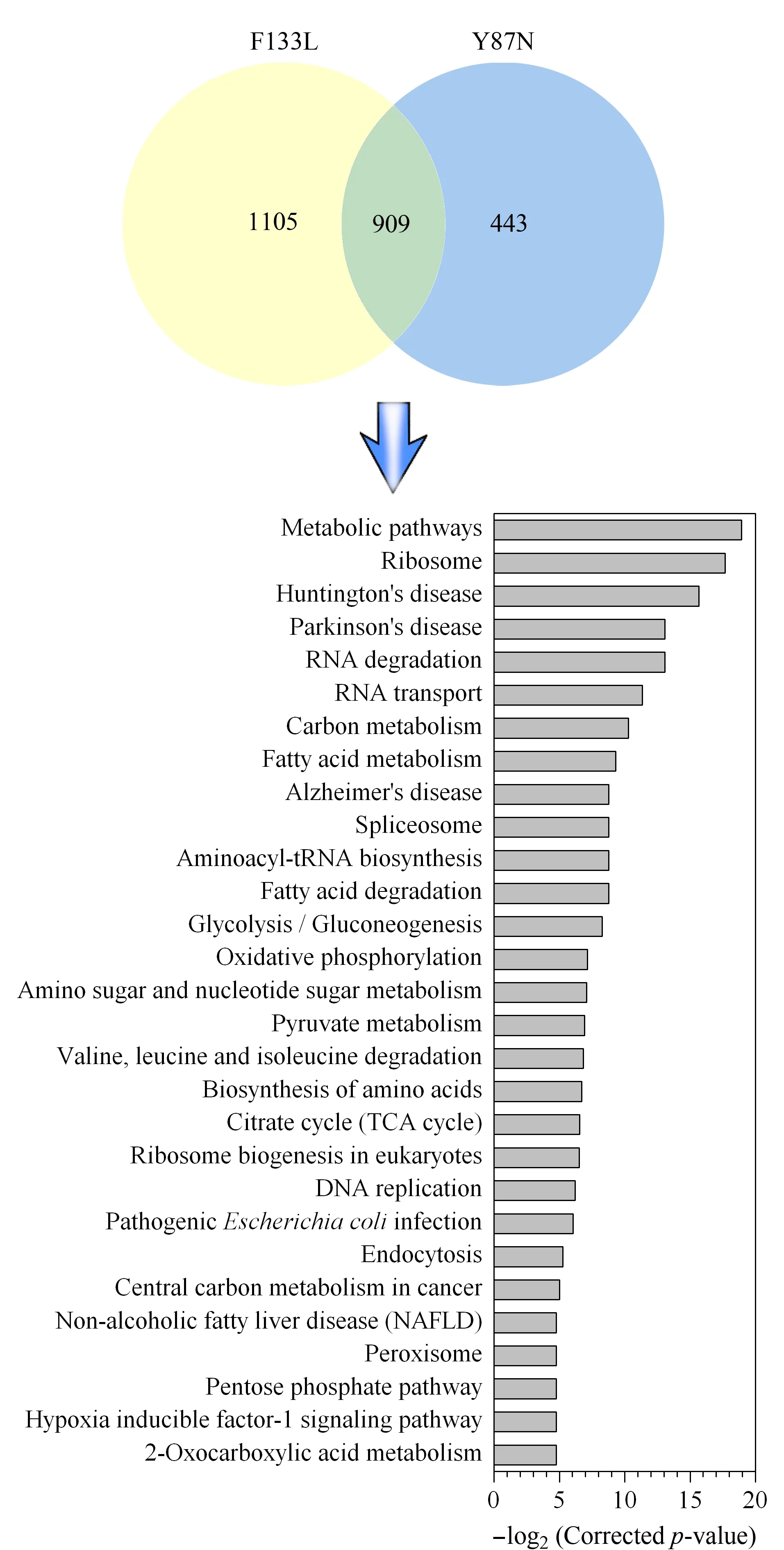
图7 蛋白质组学分析SPOP_WT、SPOP_Y87N和SPOP_F133L细胞系(n=3)Fig.7 Proteomics analysis of SPOP_WT,SPOP_Y87N,and SPOP_F133L cells(n=3) Venn diagram of differential proteins in LNCaP SPOP_Y87N and SPOP_F133L cells (up).KOBAS pathway analysis results of the 909 differential proteins (bottom).
接下来,统计了代谢组学和蛋白质组学通路富集分析后共同发生变化的通路。发现氨酰基-tRNA生物合成和TCA循环在两种组学分析中均发生变化(见图8a)。进一步对碳代谢相关通路进行代谢物和蛋白质整合分析。其中,糖酵解通路相关蛋白质HK1、GPI、PFKP、PGK1、ENO1、PKM、DLAT、PDHB表达量在SPOP_Y87N和SPOP_F133L细胞中显著增加,ALDOA表达量显著降低(见图8b)。TCA循环中ME2、MDH2、ACO2、IDH1、IDH2、IDH3G、GLUD1表达量显著增加,而SUCLG1表达量显著降低(图8b)。另外,缬氨酸、亮氨酸及异亮氨酸代谢通路中的BCAT2、BCKDHB、ACADSB及PCCB表达量也在SPOP_Y87N和SPOP_F133L细胞中显著增加(见图8b)。缬氨酸、亮氨酸和异亮氨酸降解后可以通过生成甲基丙二酰辅酶A,然后转变为琥铂酰辅酶A进入TCA循环进行回补。代谢组学结果表明,缬氨酸的量在SPOP_Y87N和SPOP_F133L细胞中降低,推测其可能降解进入TCA循环进行回补(见图8b)。

图8 整合代谢组学和蛋白质组学分析代谢通路发生的变化Fig.8 Analysis of the altered metabolic pathways by integration of metabolomics and proteomics a.Venn diagram of the changed metabolic pathways in metabolomics and proteomics analysis.b.Changes in metabolites and proteins in carbon metabolic pathway.Green,black,blue and red indicated undetected,unchanged,down-regulated and up-regulated metabolites or proteins in LNCaP SPOP_Y87N,and LNCaP SPOP_F133L cells compared to LNCaP SPOP_WT cells,respectively.Italics indicate proteins.HK1:hexokinase 1;GPI:glucose-6-phosphate isomerase;PFKP:phosphofructokinase,platelet;PGK1:phosphoglycerate kinase 1;ENO1:enolase 1;ALDOA:fructose-bisphosphate aldolase;PGLS:6-phosphogluconolactonase;PGD:phosphogluconate dehydrogenase;PKM:pyruvate kinase M1/2;DLAT:dihydrolipoamide S-acetyltransferase;PDHB:pyruvate dehydrogenase E1 beta subunit;SUCLG1:succinate-CoA ligase alpha subunit;ME2:malic enzyme 2;MDH2:malate dehydrogenase 2;ACO2:aconitase 2;IDH1:isocitrate dehydrogenase (NADP(+))1,cytosolic;IDH2:isocitrate dehydrogenase (NADP(+))2,mitochondrial;IDH3G:isocitrate dehydrogenase 3 (NAD(+))gamma;GLUD1:glutamate dehydrogenase 1;BCAT2:branched chain amino acid transaminase 2;BCKDHB:branched chain keto acid dehydrogenase E1 subunit beta;ACADSB:acyl-CoA dehydrogenase short/branched chain;PCCB:propionyl-CoA carboxylase subunit beta.
2.3 验证SPOP调控的代谢通路
利用CRISPR/Cas9基因编辑技术构建了3种SPOP敲除的前列腺癌Du145细胞系,其中sgSPOP1和sgSPOP3序列可有效地降低SPOP蛋白的表达量(见图9a)。因此,对Du145 sgControl、sgSPOP1、sgSPOP3细胞进行了代谢组学分析。敲除SPOP后,代谢轮廓发生了明显的变化,SPOP敲除后的样品可以和未敲除的样品得到很好的区分(见图9b)。分别有24和22个差异代谢物量在sgSPOP1和sgSPOP3细胞中显著性增加(见图9c)。其中,乳酸、2-酮戊二酸、柠檬酸、富马酸、苹果酸、丙氨酸、天冬酰胺和O-磷酸-苏氨酸8种代谢物在Du145 sgSPOP1和sgSPOP3细胞中含量均增加(见图9d)。其中,柠檬酸、富马酸、苹果酸和天冬酰胺的变化趋势与LNCaP细胞中结果一致。因此,证明了SPOP可引起这些代谢物变化。
2.4 SPOP突变调控代谢通路的机理推测
转录和代谢组学分析发现人前列腺癌中TCA循环激活[20]。其中,富马酸和苹果酸与Gleason得分、肿瘤分期以及多种基因的表达相关[20]。并且,根据本课题组[12]在人前列腺癌组织中对SPOP突变的研究发现,富马酸和苹果酸在SPOP突变的癌组织中含量显著增加。细胞代谢组学结果验证了人组织中的结果。在SPOP突变型LNCaP细胞以及SPOP敲除Du145细胞中富马酸及苹果酸含量显著增加。证明,SPOP突变与前列腺癌中富马酸和苹果酸量的增加相关。并且,已知富马酸是一种癌代谢物[21]。因此,SPOP突变可通过累积富马酸,促进前列腺癌发展。
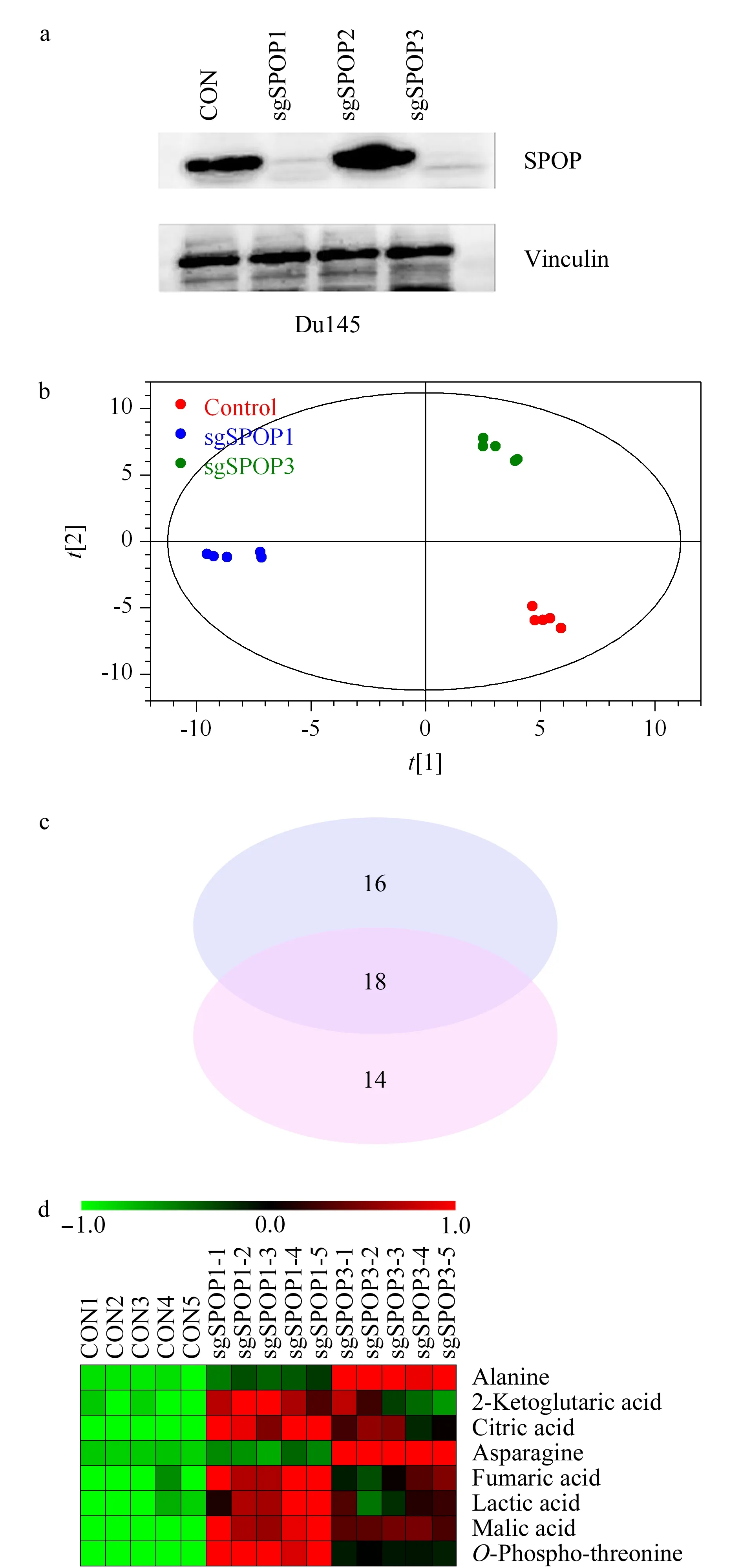
图9 Du145 SPOP敲除细胞系验证代谢变化Fig.9 Validation of metabolite alterations in Du145 SPOP knock-out cells a.Western blot analysis of SPOP expression in Du145 sgControl,sgSPOP1,sgSPOP2,and sgSPOP3 cells,wherein vinculin was used as a loading control.b.PLS-DA score plot of Du145 SPOP knock-out cells.c.Venn diagram analysis of increased metabolites in sgSPOP1 and sgSPOP3 cells.(p<0.05 and fold change>1.5).d.Heatmap visualization of commonly increased metabolites in sgSPOP1 and sgSPOP3 cells (n=5).
另外,在乳腺癌中天冬酰胺合成酶的表达量被发现与癌症的恶性程度相关。饮食中增加天冬酰胺可促进乳腺癌恶性发展[22]。发现在SPOP_WT细胞中,天冬酰胺的量降低;在SPOP敲除的Du145细胞中,天冬酰胺的量增加。因此,SPOP突变可能通过增加天冬酰胺的量来促进前列腺癌的恶性发展。
根据“瓦博格效应”,肿瘤细胞倾向于利用有氧糖酵解进行供能[23]。在前列腺癌中,糖酵解过程加强被认为和肿瘤进展及预后相关[24]。本试验发现在SPOP_Y87N和SPOP_F133L细胞中多种糖酵解相关的酶(如HK1和PFKP)含量增加,并且在Du145 SPOP敲除的细胞中,乳酸含量增加。因此,SPOP突变可能通过增加糖酵解过程促进前列腺癌发展。
3 结论
本研究通过基于GC-MS的细胞代谢组学分析了前列腺癌高频突变蛋白SPOP对代谢物的影响。研究结果表明,在LNCaP细胞中过表达SPOP可减少富马酸、苹果酸、柠檬酸和天冬酰胺的量。同时,通过蛋白质组学分析发现糖酵解和TCA循环中多种代谢酶含量在SPOP_Y87N和SPOP_F133L细胞中都增加。因此,可推测SPOP突变可以通过上调TCA循环来促进肿瘤发展。在Du145细胞中,验证了富马酸、苹果酸、柠檬酸和天冬酰胺在SPOP敲除后含量增加,再次证明了SPOP对这些代谢物具有调控作用。
