金属-有机骨架MIL-101(Cr)掺杂聚合物整体柱的制备及其用于酚类化合物的在线固相萃取
2019-07-30杨成雄杨雪清严秀平
杨成雄,杨雪清,严秀平
(1.南开大学化学学院,分析科学研究中心,天津 300071;2.江南大学食品学院,分析食品安全学研究所,江苏 无锡 214122)
有机聚合物整体柱具有可原位制备、高通透性和易功能化等优点[1,2],目前已成功用于快速液相色谱法[3]、毛细管电色谱法[4]和固相萃取法(SPE)[5]。有机聚合物整体柱作为吸附剂具有柱压小、传质快和易制备等特点,在SPE领域具有良好的应用前景[6,7]。然而,传统的有机聚合物整体柱仍存在孔隙率和比表面积小的缺陷[8,9]。在有机聚合物整体柱中掺杂高比表面积的多孔材料是有效弥补这一缺陷的方法。为此,人们已将碳纳米管[10]、富勒烯衍生物[11]和金属纳米颗粒[12]等多孔材料掺杂于有机聚合物整体柱中,以提高有机聚合物整体柱的萃取效率。
金属-有机骨架(MOFs)是一类以金属离子或金属簇为配位中心,与含氧或氮的有机配体通过配位作用形成的多功能多孔材料[13,14]。MOFs具有比表面积大、孔道规则有序、结构可修饰、热稳定性好等优点,目前在分析化学领域展现出了良好的应用前景[15,16]。同时,MOFs也可作为新颖吸附剂用于固相萃取[16-19]。相对于应用较多的离线固相萃取,基于MOFs的在线固相萃取的研究较少[20,21],其根本原因是由于MOFs较小的粒径和不规则的形貌导致的高柱压,大大限制了其在线固相萃取的应用。将MOFs和聚合物整体柱相结合,制备MOFs掺杂聚合物整体柱是有效解决上述问题和拓宽MOFs在线固相萃取应用的方法之一[22-25]。
酚类化合物广泛存在于自然界,是化学工业的基本原料,大量用于制造酚醛树脂、高分子材料、离子交换树脂、合成纤维、染料、药物、炸药等[26]。酚类化合物为原生质毒物,可侵入人体的细胞原浆,使细胞失去活性,直至引起脊髓刺激,导致全身中毒[26]。由于酚类化合物具有强毒性和持久性的特点,美国环境保护署将其列为优先控制污染物[27]。同时,欧盟也规定饮用水中总酚含量不能超过0.5 μg/L和单个酚含量不能超过0.1 μg/L[28]。为了保障人类免受酚类污染物的威胁和困扰,必须对环境中的酚类化合物进行监测和控制[29]。然而,酚类化合物在环境中的浓度较低,直接测定非常困难。因此,开发有效富集和测定水中酚类化合物的方法具有重要意义。
本文建立了原位制备MOF MIL-101(Cr)掺杂聚合物整体柱的方法,并采用在线SPE-HPLC检测水中酚类化合物。MIL-101(Cr)由铬(Ⅲ)和对苯二甲酸构成,具有比表面积大、孔体积和孔窗大、热和化学稳定性好等优点,有望用于酚类化合物的固相萃取[30]。本文详细考察了样品溶液pH值、上样时间、上样速度和解吸时间对萃取酚类化合物的影响。最终,该方法成功用于实际水样中酚类化合物的检测。
1 实验部分
1.1 仪器、试剂与材料
高效液相色谱仪由Waters 600泵和2996光电二极管阵列检测器(PDA)组成(美国Waters公司);FIA-3100流动注射仪(北京吉天仪器有限公司);Tygon泵管(1.52 mm i.d.);不锈钢柱管(5 cm×4.6 mm)。
4-硝基苯酚(4-NP)、3-甲基苯酚(3-MP)、2-硝基苯酚(2-NP)和2,4-二氯苯酚(2,4-DCP)(结构式见图1),以及九水硝酸铬、对苯二甲酸、40%(质量分数)氢氟酸、甲基丙烯酸缩水甘油酯(GMA)、乙二醇二甲基丙烯酸酯(EDMA)、环己醇、1-十二醇、偶氮二异丁腈(AIBN)、乙酸均购自上海阿拉丁试剂有限公司;甲醇、乙醇、N,N-二甲基甲酰胺(DMF)和乙腈购自天津康科德试剂有限公司;HCl和NaOH购自天津试剂六厂;超纯水购自天津娃哈哈食品有限公司。其他试剂为国产分析纯。

图1 4种酚类化合物的化学结构式Fig.1 Chemical structures of the four phenols 4-NP:4-nitrophenol;3-MP:3-methylphenol;2-NP:2-nitrophenol;2,4-DCP:2,4-dichlorophenol.
用甲醇配制酚类化合物的标准储备液(1 g/L),并于-4 ℃暗处保存,使用前用超纯水逐级稀释至所需浓度。实际湖水样品采自本地,以0.45 μm纤维素微孔滤膜过滤后存储于干净的玻璃瓶中备用,使用前用NaOH调节pH值至10.0。
1.2 MIL-101(Cr)的合成
MIL-101(Cr)参照文献[30]方法合成。将800 mg九水硝酸铬、332 mg对苯二甲酸、9.6 mL水和0.1 mL 40.0%(质量分数)氢氟酸依次加至30 mL聚四氟乙烯反应釜内胆中。搅拌均匀,用不锈钢套密封,放入220 ℃的烘箱反应8 h。冷却至室温后,以10 000 r/min离心8 min,然后收集绿色固体,依次用DMF和乙醇回流4 h,充分去除未反应的对苯二甲酸和杂质,然后在60 ℃下真空干燥,最终得浅绿色MIL-101(Cr)粉末。
1.3 原位合成MIL-101(Cr)掺杂聚合物整体柱
在5 mL离心管中依次加入10 mg MIL-101(Cr)粉末、400 μL GMA、300 μL EDMA、1 000 μL环己醇和300 μL 1-十二醇溶剂,超声0.5 h,使其分散均匀并脱去气泡。然后再加入10 mg AIBN引发剂,超声5 min,将此反应液缓慢加至两端连接有胶皮管的不锈钢柱管内(其中一端封口)。待反应液加满后,两端密封,置于70 ℃水浴中反应24 h。冷却至室温后,取下两端胶皮管,切去多余整体柱,封口即得MIL-101(Cr)掺杂聚合物整体柱。将MIL-101(Cr)掺杂聚合物整体柱连接HPLC六通阀,用甲醇冲洗,除去致孔剂环己醇和1-十二醇以及未反应的单体EDMA和GMA,用流动相平衡MIL-101(Cr)掺杂聚合物整体柱2 h至基线平稳。

图2 MIL-101(Cr)和MIL-101(Cr)掺杂聚合物整体柱的表征Fig.2 Characterization of MIL-101(Cr)and MIL-101(Cr)incorporated polymer monolith a.X-ray diffraction patterns of simulated MIL-101(Cr),synthesized MIL-101(Cr),and MIL-101(Cr)incorporated polymer monolith;b.thermogravimetric analysis curve of the synthesized MIL-101(Cr);c.scanning electronic microscopy (SEM)images of the MIL-101(Cr)incorporated polymer monolith;d.IR spectra of poly(glycidyl methacrylate(GMA)-co-ethylene glycol dimethacrylate(EDMA))monolith,MIL-101(Cr),and MIL-101(Cr)incorporated polymer monolith.
1.4 在线固相萃取
在线SPE-HPLC联用富集水中酚类化合物的流程如下。首先,将MIL-101(Cr)掺杂聚合物整体柱连接至HPLC六通阀的1,4位,取代原有定量环。然后,将HPLC进样阀切换至“Load”位,用FIA-3100流动注射泵将样品溶液泵入MIL-101(Cr)掺杂聚合物整体柱中进行富集(上样流速0.4 mL/min,上样时间5.0 min)。接着将进样阀由“Load”位切换至“Inject”位,用流动相反向冲洗固相萃取柱2 min,以解吸所富集的酚类化合物,使其进入C18色谱柱进行分离。最后,再将HPLC进样阀转换至“Load”位进行下一次的样品富集。
1.5 色谱条件
C18色谱柱(25 cm×4.6 mm,天津倍思乐色谱技术开发中心);流动相为乙腈-水(60∶40,v/v)(含1%(v/v)乙酸);流速为1.0 mL/min;检测波长为280 nm。
2 结果与讨论
2.1 表征
用X-射线晶体衍射(XRD)、热重分析(TGA)、扫描电镜(SEM)和红外光谱(IR)表征所合成的MIL-101(Cr)和MIL-101(Cr)掺杂聚合物整体柱(见图2)。
MIL-101(Cr)的XRD谱图与模拟的MIL-101(Cr)谱图吻合(见图2a),表明MIL-101(Cr)已成功合成。MIL-101(Cr)掺杂聚合物整体柱的XRD谱图中出现了MIL-101(Cr)的特征峰,证明MIL-101(Cr)成功掺杂在聚合物整体柱中。TGA结果表明,MIL-101(Cr)能在320 ℃下稳定,具有良好的热稳定性(见图2b)。SEM结果表明,MIL-101(Cr)掺杂聚合物整体柱具有相互交联的整体柱骨架和多孔结构(见图2c)。MIL-101(Cr)掺杂聚合物整体柱的IR谱图中,在1 623、1 402和748 cm-1处出现了MIL-101的特征峰,再次证明MIL-101(Cr)已成功掺杂(见图2d)。
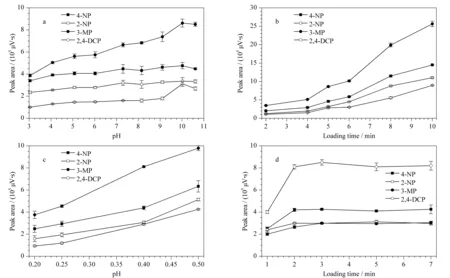
图3 (a)样品溶液pH、(b)上样时间、(c)上样流速和(d)解吸时间对在线固相萃取酚类化合物的影响(n=3)Fig.3 Effects of(a)sample solvent pH values,(b)loading time,(c)loading flow rates,and(d)desorption time on the on-line SPE of phenols(n=3)Mass concentrations of 4-NP,3-MP,2-NP and 2,4-DCP were 200,100,300 and 300 μg/L,respectively.
2.2 萃取条件的考察
实验考察了样品溶液pH、上样流速、上样时间和解吸时间对在线固相萃取酚类化合物的影响(见图3)。
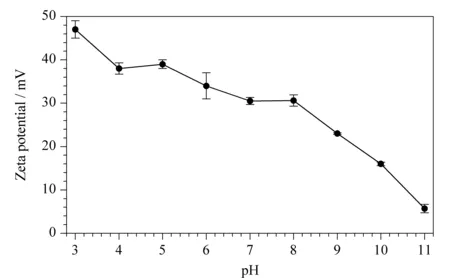
图4 MIL-101(Cr)在不同pH下的Zeta电势(n=3)Fig.4 Zeta potentials of MIL-101(Cr)under different pH(n=3)
固定上样流速(0.4 mL/min)和上样时间(5.0 min),考察样品溶液pH值(3.0~11.0)对在线固相萃取酚类化合物的影响(见图3a)。当pH值为3.0~10.0时,酚类化合物的色谱峰面积随pH值的升高而增加;当pH值为10.0时,4-NP、3-MP、2-NP和2,4-DCP的色谱峰面积最大。而当pH值>10.0时,酚类化合物的色谱峰面积有所减少。4-NP、3-MP、2-NP和2,4-DCP的pKa值分别为7.2、10.1、7.2和7.8。当pH>pKa时,4-NP、2-NP和2,4-DCP因酚羟基解离而带负电,而MIL-101(Cr)在pH值3.0~11.0范围内均带正电(见图4),带负电的4-NP、2-NP和2,4-DCP能较好地富集于带正电的MIL-101(Cr)上,表明酚类化合物与MIL-101(Cr)掺杂聚合物整体柱之间可能存在静电相互作用。同时,MIL-101(Cr)掺杂聚合物整体柱在pH=10.0时对中性的3-MP(pKa≈pH)也有较好的富集效果,说明静电相互作用并非是MIL-101(Cr)掺杂聚合物整体柱萃取酚类化合物的唯一作用机理。酚类化合物上的苯环与MIL-101(Cr)配体上苯环之间的π-π相互作用,以及酚类化合物上的酚羟基与MIL-101(Cr)上的对苯二甲酸酯配体之间的氢键相互作用在MIL-101(Cr)掺杂聚合物整体柱高效萃取酚类化合物中也起着重要作用。
固定上样流速为0.4 mL/min,考察上样时间对在线固相萃取酚类化合物的影响(见图3b)。当上样时间为2~10 min时,酚类化合物的峰面积随着上样时间的增加而逐渐增加,说明MIL-101(Cr)掺杂聚合物整体柱对酚类化合物的富集均未达到饱和状态。为了实现酚类化合物的快速富集和检测,实验选择上样时间为5 min。
固定上样时间为5 min,考察上样流速对在线固相萃取酚类化合物的影响(见图3c)。当上样流速为0.2~0.5 mL/min时,MIL-101(Cr)掺杂聚合物整体柱对酚类化合物的萃取效率随着上样流速的增加而成线性增加。综合考虑上样速度和稳定性,最终选择上样流速为0.4 mL/min。
考察了解吸时间(1~7 min)对酚类化合物解吸附的影响(见图3d)。结果表明,2 min即可将富集于MIL-101(Cr)掺杂聚合物整体柱的酚类化合物解吸完全,故选为实验所用。
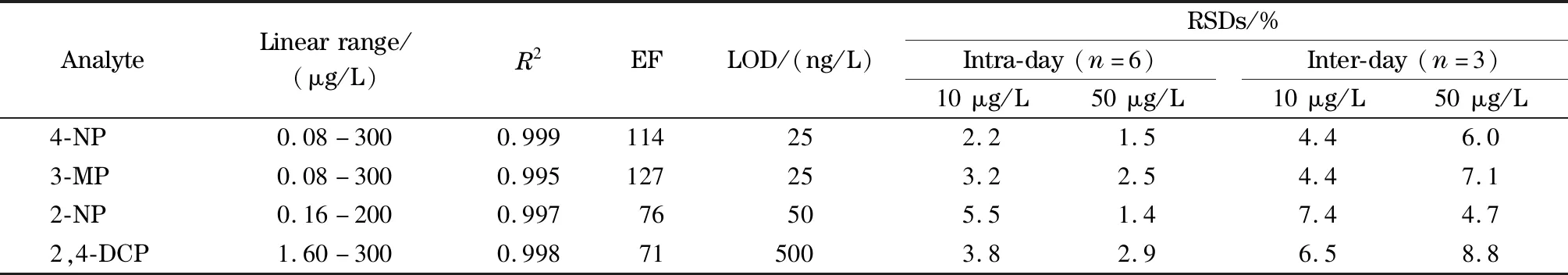
表1 酚类化合物的线性范围、相关系数(R2)、富集因子、检出限和精密度Table1 Linear ranges,correlation coefficients(R2),enhancement factors(EFs),LODs and precisions of the phenols

图5 MIL-101(Cr)掺杂聚合物整体柱和未掺杂MIL-101 (Cr)的聚GMA-co-EDMA整体柱萃取酚类化合物的效果对比(n=3)Fig.5 Comparison of the extraction performance ofMIL-101(Cr)incorporated monolithic column to poly(GMA-co-EDMA)monolithic column for on-line SPE of phenols(n=3)
2.3 空白聚合物整体柱对比
为了证明MIL-101(Cr)在MIL-101(Cr)掺杂聚合物整体柱中的作用,实验对比了未掺杂MIL-101(Cr)的聚GMA-co-EDMA整体柱和MIL-101(Cr)掺杂聚合物整体柱对酚类化合物的萃取效果(见图5)。MIL-101(Cr)掺杂聚合物整体柱对酚类化合物的萃取效果明显优于未掺杂MIL-101(Cr)的聚GMA-co-EDMA整体柱,表明MIL-101(Cr)对提高酚类化合物的萃取效率起着关键作用。
2.4 线性范围、精密度、检出限和富集因子
配制了一系列不同浓度的酚类化合物标准溶液,在最佳萃取条件下,采用MIL-101(Cr)掺杂聚合物整体柱进行萃取,以酚类化合物的色谱峰面积(y)对酚类化合物的质量浓度(x,μg/L)作图。结果表明,MIL-101(Cr)掺杂聚合物整体柱在线SPE结合HPLC检测4-NP、3-MP、2-NP和2,4-DCP的线性范围为0.08~300 μg/L;检出限(LOD,S/N=3)为25~500 ng/L(见表1)。
考察了MIL-101(Cr)掺杂聚合物整体柱在线固相萃取结合HPLC检测酚类化合物的稳定性,其日内(n=6)和日间(n=3)的相对标准偏差分别为1.4%~5.5%和4.2%~11.0%。
通过对比萃取前后酚类化合物的色谱峰面积,计算MIL-101(Cr)掺杂聚合物整体柱对酚类化合物的富集因子(EF),结果在71~127之间,表明MIL-101(Cr)掺杂聚合物整体柱对酚类化合物有较好的富集效果。相比于文献[31-36]报道的固相萃取酚类化合物的方法,该方法具有更低的检出限(见表2)。
2.5 实际水样分析
将MIL-101(Cr)掺杂聚合物整体柱用于在线固相萃取,并结合HPLC检测当地湖水样品中的酚类化合物,验证该方法的可行性和实际样品分析能力。图6为不同加标浓度下MIL-101(Cr)掺杂聚合物整体柱在线固相萃取结合HPLC检测实际水样中酚类化合物的色谱图。结果显示,实际湖水样品中均未检出酚类化合物(见表3)。通过实际样品加标回收试验考察该方法的可行性,结果表明,实际水样中酚类化合物的加标回收率(10 μg/L)为78.6%~107.1%,满足实际样品分析要求。

表2 本文方法与其他文献方法的对比Table2 Comparison of the developed method with other reported methods
MSPE:magnetic solid phase extraction;SBSE:stir bar sorptive extraction;PDA:photo-diode array.

图6 (a)空白水样和(b)加标水样(10 μg/L)的色谱图Fig.6 Chromatograms of(a)a blank water sample and(b)a spiked water sample(10 μg/L)

表3 实际水样中酚类化合物的加标回收率(n=3)Table3 Spiked recoveries of the phenols in real water samples(n=3)
nd:not detected.
3 结论
采用原位聚合法制备了MIL-101(Cr)掺杂聚合物整体柱,成功用于在线SPE-HPLC检测水中酚类化合物。该方法线性好,精密度好,检出限低,为水中酚类化合物的富集和检测提供了有效方法。结果表明,制备MOFs掺杂整体柱是拓宽MOFs在线固相萃取的有效途径。
