分离自传统自然发酵食品中降胆固醇乳酸菌的筛选与评价
2019-07-30张羽竹杨靖鹏樊明涛魏新元
李 尧 张羽竹 张 利 杨靖鹏 王 菁 樊明涛 魏新元
(西北农林科技大学食品科学与工程学院 陕西杨凌712100)
维持体内胆固醇平衡对于身体健康至关重要, 体内胆固醇的平衡源于机体有序而复杂的合成、代谢、吸收和消除[1-2]。 人类的高胆固醇血症已被证明是引起动脉粥样硬化, 导致心脑血管疾病的主要原因[3]。 高胆固醇与许多代谢综合症相关,包括肥胖、高血脂、高血糖和高血压等。 为了保证健康,目前,对降低血糖、血清胆固醇和甘油三酯水平的研究颇多[4-5],药物防治和控制饮食是最主要的两种途径。 然而,使用药物治疗费用大,受到个人经济制约,而且药物存在副作用[6]。控制饮食,低脂、 低胆固醇及低糖食品可以达到一定的降低效果,然而此类食品相对很少,也存在价格偏高的问题,难以长期维持,而且其功效性也会随着时间逐渐降低[7]。 新的饮食方法便渐渐产生,包括在食品中添加或增加可溶性纤维[8]、大豆蛋白[9]、植物固醇类[10]、益生菌和益生元[11]等。
益生菌是对宿主有益的一定数量的微生物[12-13]。近年来益生菌的研究和应用越来越多[14-16]。乳酸菌(lactic acid bacteria)普遍被认为是安全的益生菌,人体和动物体的肠道内大量存在。研究表明足够数量的乳酸菌具有降低血清胆固醇水平的效果,既能平衡体内合成的胆固醇量,也能降低食源性胆固醇量[17]。 将具有降胆固醇性能的乳酸菌应用于饮食是一种不错的选择, 乳酸菌不仅能起到降低胆固醇的功效, 而且还有维持肠道微生态平衡的作用[18]。 影响乳酸菌降胆固醇的因素很多,包括温度,菌株数量和种类,pH,时间,益生元等[19-20]。目前, 关于益生菌降胆固醇的机制主要通过益生菌细胞同化作用,细胞壁的吸附,共沉淀,共沉淀与同化的结合作用[21-22],并最终随着益生菌排出体外,从而降低肠道环境中胆固醇存在量,减少人和动物对饮食摄入的胆固醇的吸收[14]。
本研究采用操作相对简单的硫酸铁铵测定胆固醇含量法。 从本实验室分离自传统食品的大量乳酸菌菌株中筛选降胆固醇效果较好者, 然后利用更精确的测定胆固醇含量的邻苯二甲醛法,确定乳酸菌菌株的降解胆固醇活性, 分析这些优良菌株的耐胆盐特性、生长特性、产酸特性,研究了降胆固醇的能力与不同生长时期的关系, 评估这些菌株的耐酸特性及在模拟胃肠道环境中的稳定性等。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种 融合魏斯氏菌(Weissella confusa),4 株,分别编号WS1~WS4;短乳杆菌(Lactobacillus brevis),4 株,分别编号LB1~LB4;食窦魏斯氏菌(Weissella cibaria),5 株,分别编号CW1~CW5;植物乳杆菌(Lactobacillus plantarum),17 株,分别编号LP1~LP17,共30 株乳酸菌菌株,均分离自传统发酵食品,本实验室保藏。
1.1.2 培养基 MRS (Man Rogosa and Sharp Medium, MRS)培养基(1 000 mL):蛋白胨10 g,牛肉膏5 g,酵母浸粉4 g,磷酸氢二钾2 g,柠檬酸三铵2 g,乙酸钠5 g,葡萄糖20 g,吐温-80 1 mL,硫酸镁0.2 g,硫酸锰0.05 g,自然pH,121 ℃高压灭菌15 min。
改良MRS:MRS 培养基中加入1%的碳酸钙,混匀。
MRS-CHOL(胆固醇MRS 培养基):MRS 培养基中, 含0.2%巯基乙酸钠,0.2%胆盐,100 μg/mL的胆固醇。
1.1.3 主要试剂 胆固醇(≥95%),分析纯,购自Sigma-Aldrich;邻苯二甲醛,分析纯,购自Solarbio;胃蛋白酶,优级纯,购自Solarbio。
胆固醇储存液,50 mg 胆固醇溶于无水乙醇中,定容至50 mL,质量浓度1 mg/mL。
硫酸铁铵显色剂: 溶解4.463 g 硫酸铁铵于100 mL 85%的磷酸中,即为储备液。 吸取该储备液10 mL,用浓硫酸定容至100 mL,即为显色剂[23]。
邻苯二甲醛显色剂(现用现配):50 mg 邻苯二甲醛溶于100 mL 冰乙酸即可[12]。
1.2 试验方法
1.2.1 乳酸菌活化、 复壮与驯化 取冷冻保藏的乳酸菌菌种菌液100 μL 加入5 mL MRS 培养液中,37 ℃静置培养24 h,用接种环取培养液在改良MRS 平板上进行划线分离,37 ℃静置培养24 h后,从平板上挑取菌落大,溶钙圈明显的单菌落继续在改良MRS 平板上划线分离,37 ℃培养24 h,按照此方法连续划线分离3 次, 最终获得的溶钙圈明显的大单菌落转接到斜面上培养后保藏备用[24]。
按照上述活化复壮的方法将菌株接种于含有0.1%胆盐的MRS 培养基进行驯化并转接到斜面上培养后保藏备用。
1.2.2 胆固醇标准曲线的绘制
1.2.2.1 硫酸铁铵法 取质量浓度为1 mg/mL 的胆固醇储存液0,0.1,0.2,0.3,0.4,0.5 mL 分别加入10 mL 干净试管中, 依次加入无水乙醇1,0.9,0.8,0.7,0.6,0.5 mL,最后依次缓慢加入2 mL 配好的硫酸铁铵试剂, 混匀, 待管冷却至室温后,560 nm 波长下比色[24]。 以胆固醇浓度为横坐标,吸光值为纵坐标,作标准曲线。
1.2.2.2 邻苯二甲醛法 取质量浓度为1 mg/mL的胆固醇储存液0,0.1,0.2,0.3,0.4,0.5 mL 分别于10 mL 干净试管中,60 ℃水浴, 待乙醇挥发干净,加2 mL 现配的邻苯二甲醛显色剂,振荡均匀后,室温静置10 min,将1 mL 浓硫酸缓慢加入,混匀,静置20 min,560 nm 波长下比色[12]。 以胆固醇浓度为横坐标,吸光值为纵坐标,作标准曲线。
1.2.3 降胆固醇乳酸菌的初筛 根据对硫酸铁铵法和邻苯二甲醛法的比较, 在分析本实验室分离的30 株乳酸菌的降胆固醇能力,初步筛选优良的降胆固醇乳酸菌菌株试验中, 本研究选择采用操作较为简单快捷的硫酸铁铵法测定胆固醇含量。
将活化的对数生长后期的乳酸菌等量分别接种等体积的含胆固醇的MRS 培养基中进行培养,培养到稳定期,培养液浊度大致相同。将乳酸菌培养液离心(5 000 g,10 min)的上清液2 mL 至干净试管中,加无水乙醇至10 mL,充分摇匀,4 500 g离心10 min, 取上清液1 mL 至新的干净试管,再加入2 mL 硫酸铁铵显色液,充分混合,待冷却后于560 nm 处测定吸光值[24-25]。 以未接种乳酸菌的胆固醇MRS 培养基为对照测定其中的胆固醇总量。上清中检测出来的胆固醇含量越低,说明胆固醇降低效率越大,乳酸菌降胆固醇的能力越强。
胆固醇降低率=A-B/A×100%
其中:A——未接种乳酸菌的胆固醇MRS 培养基中胆固醇含量;B——试验菌株发酵后上清液中胆固醇含量。
1.2.4 胆盐耐受性能分析 通过分析乳酸菌在含胆盐的培养基中的生长情况来判断其胆盐耐受性能。在液体MRS 培养基中加入0.1%,0.2%,0.3%,0.4%,0.5%(W/V)的胆盐,以不含胆盐的MRS 培养基作为对照[26-27]。活化扩大培养后的优选乳酸菌菌株按2%(V/V)的接种量加入到含不同胆盐浓度的MRS 培养基中, 每个试验3 次重复,37 ℃培养24 h 后摇匀, 测定不同菌株在不同浓度胆盐里生长的浑浊度(吸光度OD600)来分析其耐受水平。
胆盐耐受力(%)=含胆盐的培养基的OD 值/空白培养基的OD 值×100%
1.2.5 初筛降胆固醇能力较强菌株的降胆固醇效力分析 胆固醇降低效力表示单位菌体量对胆固醇的降低量。 乳酸菌降胆固醇效力的分析采用邻苯二甲醛法Ying Huang1[28]。将优选菌株活化扩大培养后,按照2%(V/V)的接种量分别接种于等体积的含或者不含0.2%胆盐的MRS-CHOL 培养液中,于37 ℃培养20 h,测定培养物在600 nm 的吸光度值,并以此样品5 000 g,离心10 min 收集上清液; 接着取1 mL 上清液加入干洁的试管中,再加入2 mL 33%的KOH,3 mL 的无水乙醇,充分摇匀后37 ℃水浴加热15 min 后,冷却至25 ℃;再向管中加5 mL 正己烷,1 mL 无菌水, 漩涡振荡2 min,待相分离后,取3 mL 正己烷层(上层)放入干净玻璃试管,氮吹仪干燥后,向试管加入4 mL 的邻苯二甲醛显色液 (现配现用), 室温静置10 min, 缓慢注入浓硫酸2 mL, 充分混合并静置20 min 后于560 nm 处测定吸光值[20,28-29],每个处理3次重复。 吸光值越高,说明其中含胆固醇量越大。分别以未接种乳酸菌的含或不含胆盐的MRSCHOL 培养基为对照测定其中的胆固醇总量。 未接菌的MRS-CHOL 中的胆固醇的量减去各菌株对应上清液中胆固醇的量, 即为菌体降低胆固醇的量[30],然后以此除以乳酸菌的生长量,即可得乳酸菌的胆固醇降低效力。 计算公式如下:
胆固醇降低效力(μg/u)=胆固醇降低量(μg)/乳酸菌生长量(u)
乳酸菌生长量(u)定义为测定乳酸菌降低效力的培养液的1 单位浊度值(即1 OD600)表示。
1.2.6 生长曲线和产酸曲线的测定 将优良菌株活化扩大培养后, 以2%的接种量接种于MRS 液体培养基中, 于37 ℃静置培养, 每隔2 h 定时取样,用测定发酵液在600 nm 处吸光值,3 次重复,然后绘制生长曲线和产酸曲线。
1.2.7 接种不同生长阶段乳酸菌对降胆固醇的影响 将优良菌株活化扩大培养后,按照2%的接种量接种于MRS 液体培养基中,于37 ℃静置培养,分别取菌株生长10 h 和20 h 时得培养液按2%体积比接种于MRS-CHOL 培养基中,37 ℃静置培养24 h,按照1.2.5 节测定优选菌株发酵液中胆固醇含量,重复3 次。
1.2.8 耐酸性能 调节MRS 培养液pH 值来分析乳酸菌的耐酸能力。用0.1 N 的HCl 调节MRS 培养液的pH 分别为2.5,3.5,4.5,以自然pH 的MRS培养液作为对照[31]。优选菌株在37 ℃培养至OD600为1 左右后按2%(体积分数)接种量接种于不同pH 的MRS 培养液中,分别测定培养0,2,4,6 h 时培养液中乳酸菌的细胞浓度。 存活细胞数按照稀释平板计数法, 涂布于固体MRS 平板上,37 ℃培养24 ~48 h, 计算菌落形成单位CFU(Colony Forming Unit),3 次重复[32]。
1.2.9 乳酸菌耐受模拟胃肠道环境测试 乳酸菌对人工胃液[33]的耐受性参考Soundharrajan Ilavenil[34]。 人工胃液是将过滤除菌的胃蛋白酶(终质量浓度为3 g/L)溶解在灭菌的0.5% NaCl 溶液中,并用0.1 mol/L 的HCl 调节pH 到2.0,2.5 和3.0[35]。活化的优选菌株按2%接种量转接5 mL 新鲜的MRS 培养基中,37 ℃静置培养至OD600约1.0。6 000 g 离心15 min 收集菌体, 用0.1%的蛋白胨水清洗一次,加入5 mL 人工胃液,重悬菌体后37℃静置培养,按照稀释平板计数法(同1.2.8 节)分别测定0,1,2,3,4 h 时培养物中的存活细胞数,重复3 次。
1.2.10 数据分析 用Excel,SPSS 等软件进行显著性分析。
2 结果与分析
2.1 硫酸铁铵法和邻苯二甲醛法测定胆固醇方法的比较及胆固醇标准曲线的绘制
通过硫酸铁铵法和邻苯二甲醛法对胆固醇含量进行测定,并绘制了标准曲线(数据未提供)。在一定的检测范围内, 两种方法的检测OD 值与胆固醇含量之间都显示了良好的线性关系。 硫酸铁铵法的标准曲线为y=0.5476x+0.0167, 决定系数为0.9789。 采用此法测得培养基中胆固醇的添加回收率为92.67%;邻苯二甲醛法所获得标准曲线为y=1.2823x+0.0048,决定系数为0.9982,此法测得培养基中胆固醇的添加回收率可达到99.92%。比较两种测定方法, 硫酸铁铵法较邻苯二甲醛法稳定性和精确度略低,但其操作相对简单,没有危险性,便于用来测定大批量数据,因此在初筛优良菌株时采用此法。而邻苯二甲醛法稳定性更好,精确度更高, 但该方法不足之处在于试验中要进行皂化、提取、真空抽干后才能进行显色,操作繁琐,耗时长,而且其中用到了浓硫酸,具有一定的危险性,不适于大批量样本的测定,因此在菌株初筛之后,需要更为精准数据分析时采用。
2.2 降胆固醇乳酸菌的筛选
硫酸铁法被用于从对30 株(其中融合魏斯氏菌(Weissella confusa),4 株,分别编号WS1~WS4;短乳杆菌 (Lactobacillus brevis),4 株, 分别编号LB1~LB4;食窦魏斯氏菌(Weissella cibaria),5 株,分别编号CW1~CW5; 植物乳杆菌(Lactobacillus plantarum),17 株,分别编号LP1~LP17)从自然发酵食品中分离的乳酸菌中筛选具有降胆固醇能力菌株的筛选,各菌株的将胆固醇效果如表1。
从表1 可以看出, 不同的菌株降胆固醇的能力不同,即使是同种的不同菌株之间也存在差异。其中6 株菌的胆固醇降低率大于20%, 它们分别是WS1、LP2、LP3、LP4、LP5 和LP6,其降胆固醇效率分别达到34.06%,34.85%,30.61%,21.03%,28.73%和37.15%,6 株菌胆固醇降低率依次为LP6>LP2>WS1>LP3>LP5>LP4,此6 株菌被选取进行进一步的其他性能和功能的分析和评价。
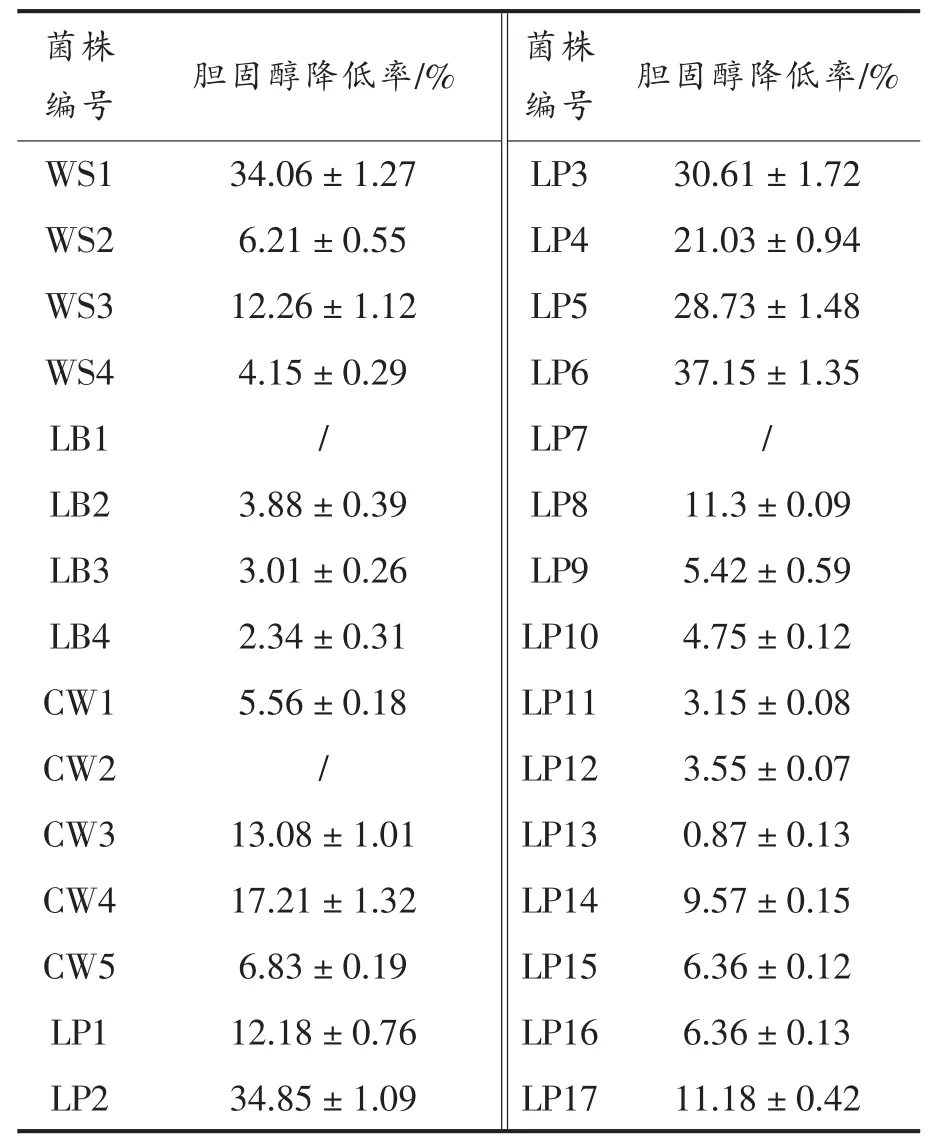
表1 30 菌株乳酸菌降胆固醇能力的分析Table 1 The analysis of cholesterol-lowering ability of 30 lactic acid bacteria
2.3 6 株降胆固醇能力较强菌株的耐胆盐能力分析
人体肠道胆盐浓度大概在0.03%~0.3%之间,当乳酸菌随食物进入胃肠道后会面临胆盐的作用,为此,本研究对筛选出来的降胆固醇效果较好菌株进行了耐胆盐分析,如表2。

表2 6 株乳酸菌菌株的耐胆盐性能分析Table 2 The analysis of bile salt resistance of the 6 lactic acid bacteria
从表2 可以看出6 株乳酸菌对不同的胆盐浓度,表现出不同的耐受性,胆盐浓度越高,耐受性越差, 不同的菌株对相同的胆盐浓度, 也呈现差异。在0.1%的胆盐浓度下,6 株菌生长性能都还可以, 其中WS1 最好, 耐受力为85.56%, 其次是LP6,耐受力为56.65%,而其他4 株菌耐受力依次为LP4 36.65%;LP2 32.77%;LP5 32.47%;LP3 32.01%。 当胆盐浓度达到0.2%和0.3%时,24h 后各菌株依然能够存活。随着胆盐浓度升高,菌株生长情况越来越差, 表明其收到胆盐的抑制越来越明显。 试验结果表明,菌株均能适应0.2%和0.3%胆盐浓度的环境,24 h 后菌株仍有存活,结合人体肠道内的胆盐水平,0.2%的胆盐浓度被用于后期的降胆固醇能力及其他特性检测中。
2.4 6 株乳酸菌在含或不含胆盐情况下降胆固醇效率和效力的分析
为了进一步分析体内胆盐对乳酸菌降胆固醇的影响, 根据普遍模拟的肠道内0.2%的胆盐浓度,本研究对6 株乳酸菌在含0.2%和不含胆盐的胆固醇MRS 培养基中降胆固醇的效率和效力进行了分析,结果如图1 所示。

图1 6 株乳酸菌在含0.2%和不含胆盐培养基中的降胆固醇能力分析Fig.1 Analysis of cholesterol-lowering of 6 strains with or without 0.2% bile salt
结果显示,在含0.2%胆盐的培养基中,各菌株降胆固醇的效率和效力都明显高于不含胆盐的培养基。不同菌株的降胆固醇效率不同,在不含胆固醇的培养基中, 降胆固醇效率从高到低依次为LP6、LP2、WS1、LP3、LP5 和LP4;而在含胆盐的培养基中, 降胆固醇效率从高到低依次为LP6、WS1、LP2、LP3、LP5 和LP4。 不同菌株的降胆固醇效力也具有差异,在不含胆固醇的培养基中,降胆固醇效力从高到低依次为WS1、LP2、LP5、LP6、LP3 和LP4;而在含胆盐的培养基中,降胆固醇效力从高到低依次为WS1、LP6、LP2、LP3、LP4 和LP5。 在含胆盐的培养基中,菌株降胆固醇效力的提升效果高于降胆固醇效率的提升效果, 间接反映了0.2%的胆盐一方面对试验乳酸菌株具有一定的抑制作用, 另一方面胆盐还可以促进乳酸菌的降胆固醇能力。
将乳酸菌在含0.2%胆盐的培养基中的降胆固醇效率和效力进行综合分析,结果如图2。

图2 0.2%胆盐条件下6 株菌的降胆固醇效率和效力分析Fig.2 Efficiency and efficacy analysis of the 6 strains lowering cholesterol
由图2 可以看出,在含0.2%的胆盐的培养基中,无论是胆固醇降低效率还是胆固醇降低效力,WS1、LP6、LP2 和LP3 都比LP4 和LP5 要高,因此,本论文选择WS1、LP6、LP2 和LP3 这4 株菌进一步进行其他生长特性和生理功能的分析。
2.5 复筛的4 株优良乳酸菌菌株生长曲线和产酸曲线的测定
为了进一步分析4 株复筛的优良乳酸菌的生长特性和生理功能, 本论文对它们的生长曲线和产酸曲线进行了分析,如图3 所示。

图3 4 菌乳酸菌菌株的生长曲线和产酸曲线Fig.3 Growth curves and acid-producing curves of 4 strains lactic acid bacteria
从图3 可以看出,4 株优良菌株WS1,LP2,LP3,LP6 的生长曲线基本相似,4 h 乳酸菌进入对数生长期,同时大量产酸,pH 值有较大幅度降低,到18 h 之后开始进入稳定期,此后的生长曲线和pH 值曲线皆趋于平缓,直到24 h 左右。 这不仅为后面菌株耐酸性的研究中pH 的设置提供了依据, 也为后期分析不同的母种选择时间对降胆固醇的影响提供了参考。
2.6 种子液的选取时机对降胆固醇的影响
为了分析从种子液中选取母种转接时机对菌株降胆固醇能力的影响, 本研究分别选取了发酵液生长到10 h(对数期)和20 h 时(稳定期)的培养物作为种子转接到胆固醇MRS 培养液中,然后测定培养24 h 时菌株的降胆固醇效果,如图4。
优选菌株在不同生长阶段转接的母种, 经过相同时间的培养后,由图4 可以看出,它们对胆固醇的降低效率和降低效力各有不同。 但无论是降低效率还是降低效力, 转接来自4 株菌对数期的种子液(10 h)均比来自稳定期的种子液(24 h)的要高, 而且对数生长期的种子液表现的降低效力明显高于稳定期的种子液所对应的降低效力,而两者之间的胆固醇降低效率差别并不明显, 尽管对数期的胆固醇降低率略高于非对数期。

图4 不同生长期的种子液对菌株降胆固醇能力Fig.4 Cholesterol-lowering abilities of seed solution from different growth stage of the 4 strains
2.7 4 株优良菌株的耐酸特性
本研究对复筛后的4 株优良菌株在不同pH条件下(自然pH、pH 2.5、pH 3.5 和pH 4.5)的存活力进行了分析, 菌株存活力通过测定0,2,4 和6 h 时的CFU/mL 来显示,如图5。
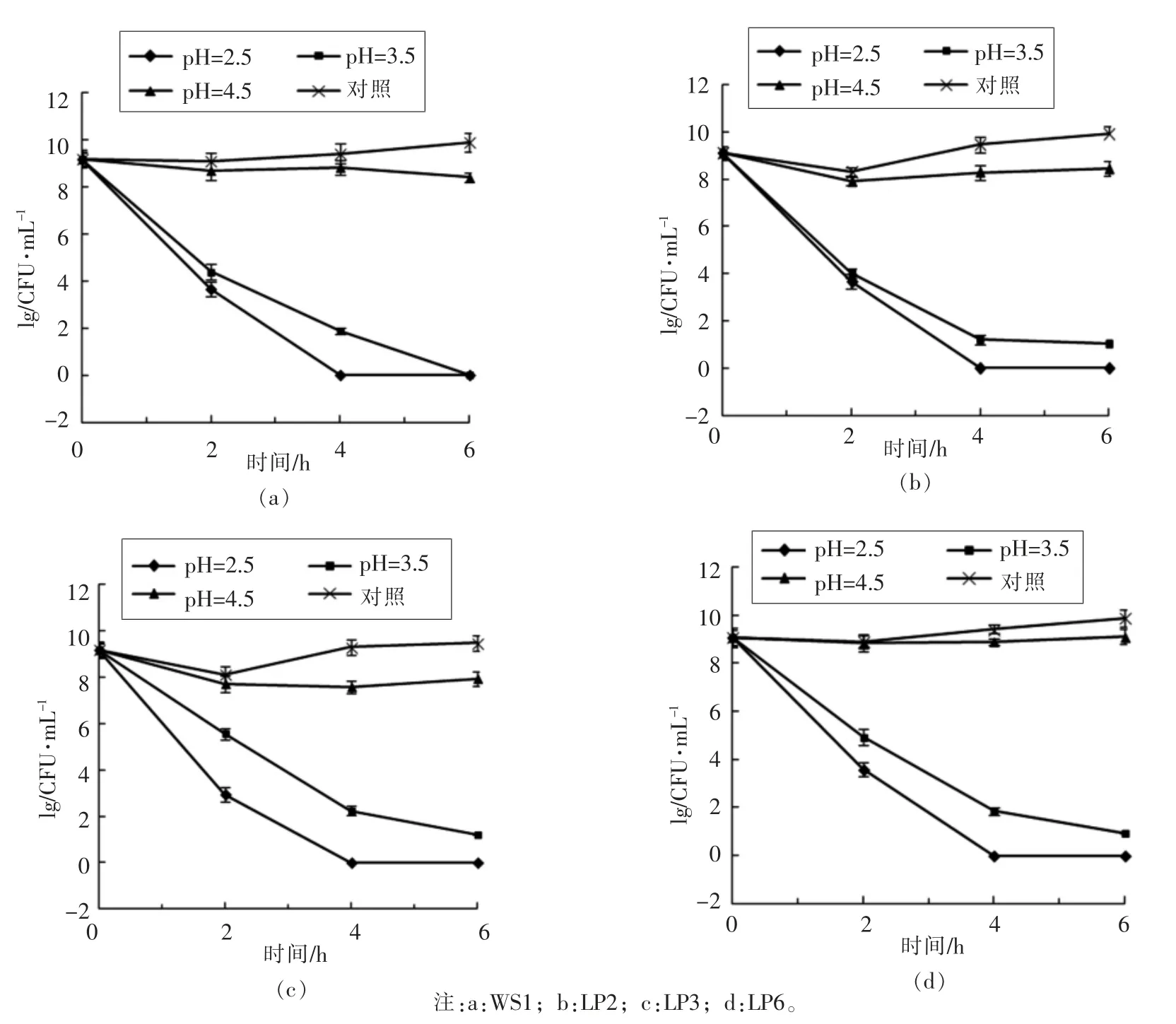
图5 4 株菌在不同pH 值下的存活力Fig.5 The viability of the 4 strains under different pH
4 株复筛菌株在不同pH 的培养基中,在不同的培养时段,其存活力不同。 pH 2.5 时,培养到2 h 时,4 株菌的存活力降低速度非常快, 几乎降低105倍,2 h 后略微平缓,但是到4 h 时,菌数降为0,所取培养液无菌落形成。 pH 3.5 时,培养到2 h时,4 株菌的降低速度都较pH 2.5 的速度慢,大概降低103~104倍,随着培养时间延长,培养液中活细胞数继续减少,到6 h 时,各菌株检测不到活菌。 而对于pH 4.5 和自然pH 条件下,菌体在2 h时,菌株存活力略有降低,到4 h 和6 h 时,菌株存活力又开始慢慢上升,但pH 4.5 的总是低于自然pH 的存活力。 结果说明,pH 低于3.5 时,4 株菌的生长会受到较为强烈的抑制。 而高于4.5 时,菌株可以较好地存活。
2.8 4 株复筛菌株在模拟胃肠道的存活率分析
人体胃部的pH 一般为2.7 左右,肠道为5.5,而食物在胃里滞留时间为3 h 左右。 因此,如果菌株能够顺利通过胃部进入肠道, 它们将会比较容易存活并发挥益生菌的功能。在此,本研究进一步对菌株在模拟胃肠道环境(人工胃酸)下,在不同时间的存活力进行了分析, 对人工胃酸作用的分析分别设定了pH 2、pH 2.5 和pH 3 下在0,1,2,3 和4 h 时的处理条件,如图6。
图6 显示, 在3 种pH 条件下,4 株菌的数量都在减少,pH 越低, 降低速度越快, 对于1 010 CFU/mL 左右的初接种量,在4 h 时,各菌株依然有102~108的细胞存活。 pH 3 条件下的存活力高于pH 2.5 的,pH 2.5 的又高于pH 2 的,高pH 值条件下,4 菌株存活率明显增强。 试验结果表明,4菌株在人工胃酸中, 在3~4 h 均具有一定的耐受性。

图6 4 菌株在人工胃酸中的存活力Fig.6 The survival of 4 strains in simulated gastric acid
3 结论
大量的研究发现, 许多乳酸菌具有降胆固醇功能,包括罗伊氏乳杆菌、植物乳杆菌、嗜酸乳杆菌、粪肠球菌及长双歧杆菌等[36]。在本研究中,4 种菌的30 个菌株被用于检测其降胆固醇能力,结果显示, 不同的菌种, 甚至同一菌种的不同菌株之间,其降胆固醇效率及效力存在差异,这可能与菌株本身的特性有关,具体的原因尚不清楚,有待进一步研究。本研究中最终筛选出了2 种菌,融合魏斯氏菌(Weissella confusa)和植物乳杆菌(Lactobacillus plantarum)中4 个菌株具有良好的降胆固醇功能,其中融合魏斯氏菌为首次报道。
本研究中, 测定胆固醇含量分别采用硫酸铁铵法和邻苯二甲醛法,通过数据分析来看,尽管邻苯二甲醛法所测得数据偏小, 但是大体的趋势和硫酸铁铵法所得数据在趋势上保持一致,因此,在待测样品较多,或者需要耗时缩短时,可以采用硫酸铁铵法,如果需要更为精确和准确的数据,还是建议采用邻苯二甲醛法。
当培养基中含有胆盐时, 乳酸菌的存活力下降,0.1%的胆盐情况下, 乳酸菌的耐受性尚可,但是当胆盐浓度高于0.2%时,乳酸菌的耐受性急剧降低。 在0.2%胆盐存在情况下,尽管存活力下降了, 但是其降胆固醇效率和效力都提高了, 如图1,这说明胆盐对乳酸菌降胆固醇具有促进作用。4株优选乳酸菌的生长特性和产酸特性显示它们稳定性很好,耐酸性的分析表明,当pH 4.5 时,菌株的稳定性和常规pH 时的一致, 随着pH 值降低,它们的耐受性越来越差。 对耐人工胃酸的结果表明,乳酸菌在其中的耐受性似乎要强于在调节pH的培养基中的耐受性。尽管如此,但是乳酸菌在人工胃酸中的存活力下降还是比较明显。因此,如何保证乳酸菌能顺利地通过胃部已经成为当前研究的热点。
降胆固醇乳酸菌若要用于人体健康的维护,其必须具有良好的耐酸,耐胆盐特征,这样才能保证它们顺利通过胃和十二指肠, 以一定的有效数量进入到肠道中, 为人体提供有效的健康支撑作用。 当前人们已经在添加益生元[37]、适当介质或者选择合适的包被材料[38]、载体材料来提高乳酸菌的存活力方面进行了大量的研究[39],研究的成果也被逐渐用于生产实践中。
本研究表明, 所筛选的4 株乳酸菌在体外具有胆固醇降低能力,并具有一定的耐酸性、耐胆盐特性,这为今后的应用准备了合适的应用菌株,也为研究乳酸菌降胆固醇机制打下了基础并准备了研究材料。
