灵芝结构多糖水解物促进细胞免疫的功能研究
2019-07-30余钰骢姚菊明应铁进
余钰骢 姚菊明* 应铁进
(1 浙江理工大学 杭州310018 2 浙江大学食品科学与营养系 杭州310058)
植物多糖具有广泛的生物活性,如抗肿瘤,抗炎,抗凝血,抗病毒,抗辐射,降血糖和调节血脂[1]。灵芝多糖是一种植物多糖, 对癌症和炎症具有最强的抵抗力,可增强免疫功能。增强人体免疫功能是灵芝水溶性多糖的主要机制之一。 对于多糖的抗肿瘤活性,通常可以激活免疫系统。 因此,大量细胞因子被分泌并间接抑制。 促进体外脾细胞的增殖,增强DNA 聚合酶α 的活性,促进白细胞介素(IL)的分泌,实现其免疫功能。 抑制免疫功能间接抑制肿瘤细胞的生长和增殖, 甚至杀死肿瘤细胞[2]。 研究表明,一些灵芝多糖可以通过调节机体的免疫力,刺激免疫细胞成熟,分化和增殖,并使免疫状态从低到正常恢复。肿瘤细胞受到抑制,从而间接发挥其抗肿瘤作用[3]。
通过前期的研究, 发现灵芝结构多糖水解物的提取温度为131 ℃,水解时间为4 h 6 min,酸浓度为0.1 mol/L, 可以得到抗氧化性和得率都较好的多糖成分[4]。 分离纯化后,得到两种多糖单体组分GLSP1 和GLSP2[5]。目前还没有关于灵芝结构多糖水解产物免疫活性的报道。 本研究从灵芝结构多糖水解物中分离纯化出两种多糖单体进行细胞免疫测定,并选择两种典型的脾细胞和巨噬细胞免疫功能模型。 探讨灵芝多糖的抗肿瘤和免疫功能。 测定的参数包括GLSP1 和GLSP2 对小鼠脾细胞的增殖率,GLSP 对腹腔巨噬细胞活性和存活率的影响, 以及对小鼠细胞产生NO 的含量的测定。 TNF-α 的影响,以及对LPS 诱导过的PM 的活性抑制作用。
1 材料与方法
1.1 原料
试验材料为赤灵芝, 位于浙江龙泉市灵芝基地。
1.2 试剂
胎牛血清,购自四季青生物工程材料有限公司; 刀豆蛋白ConA, 购自sigma 公司(C5275);MTT,购自碧云天生物(ST316);0.2 μmol/L 孔径滤膜,购自millipore 公司;脂多糖LPS,sigma 公司产品(Cat.L2880-10 mg,Lot.011M4001V);一氧化氮检测试剂盒, 购自Biyuntian Biological(Cat.S0021);中性红试剂,购自天津凯通化学试剂有限公司(20100710);TNF-α Elisa 试剂盒,购自联科生物技术有限公司(Cat EK2821,Lot 128230633)。
1.3 仪器与设备
320R 台式冷冻离心机, 德国Hettich;FE20 pH 计, 梅特勒-托利多 (上海)有限公司;UV-1750UV-Vis 分光光度计,Shimadzu Corporation,Japan;MIR-254 恒温试验箱,日本三洋电器集团;AF30AS 制冰机, 意大利斯科茨曼;HH-2 数显恒温水浴,浙江省嘉兴市君思仪器设备厂;BSA223S电子分析天平,赛多利斯科学仪器(北京)有限公司;3111 细胞培养箱,Thermo 公司;680 酶标仪,Bio-Rad 公司。
1.4 试验动物
清洁级Balb/c 小鼠,8~10 周龄, 购自上海西普尔贝凯实验动物有限公司, 动物许可证号:SCXK(沪)2008-0016。
2 试验方法
2.1 两种多糖单体的制备
从灵芝结构中分离纯化多糖后制备两种多糖单体[4-5]。
2.2 脾细胞制备
通过颈脱位处死小鼠,用75%的酒精消毒,并将脾脏置于含有PBS 的培养皿中。用5 mL 注射塞研磨,混合并通过200 目无菌双尼龙筛过滤。合并滤液,1 500 r/min×5 min;弃上清,摇匀,加入少量破碎的红色裂解液, 用PBS 中和,1 500 r/min×5min;弃去上清液,用含有10%FBS 的1 640 培养基轻轻移液,重悬沉淀[6]。
2.3 脾细胞的增殖试验
2.3.1 灵芝结构多糖GLSP1 和GLSP2 的配制ConA 组:5 μg/mLConA;
GLP1,GLP2 均为各自稀释成8,40,200,1 000,5 000 μg/mL;
GLP1,GLP2 均为各自稀释成8,40,200,1 000,5 000 μg/mL 同时含5 μg/mL ConA
2.3.2 试验操作 伴刀豆球蛋白A(Con A),也称伴刀豆球蛋白,伴刀豆球蛋白,它是一种植物血凝素,具有很强的促有丝分裂作用,对促进淋巴细胞转化反应有很好的效果。 常规制备小鼠脾细胞悬液,以刀豆素为阳性对照,MTT 法观察试验样品对脾细胞增殖的影响[7]。
调整小鼠脾细胞为1.5×109个/mL,100 μL/孔种板于96 孔中。 建立空白组,正常对照组,ConA组和化合物1 和2 的单一给药组 (浓度8,40,200,1 000,5 000 μg/mL)、 化合物1 和2 联合ConA 组 (8,40,200,1 000,5 000 μg/mL 同时含5 μg/mL ConA),于37 ℃,5% CO2培养箱中培养4 h后,每孔加入MTT(1 mg/mL)100 μL 继续培养4 h。平板1 500 r/min×5 min,用移液管小心吸出上清液。
增殖指数=(OD样品-OD空白)/(OD对照-OD空白)
2.4 小鼠腹腔巨噬细胞(PM)的获取
放血后通过颈脱位处死BALB/c 小鼠(降低血细胞干扰),并在75%酒精中浸泡2~3 min。腹腔注射6~8 mL 冰冷的无菌PBS 缓冲液(含肝素10 U/mL,10%胎牛血清),置于腹部1~2 min 后,静置5 min,在无菌条件下打开腹腔,并将腹膜液吸移到离心管中。 以1 000 r/min 的速度离心5 min,弃去上清液,收集巨噬细胞,用上述PBS 缓冲液洗涤细胞2 次。用含有10%胎牛血清的1640 培养基调节细胞密度。合并后,计数细胞,调节至2×106/mL,并以每孔100 μL 和24 孔板中的1 mL 接种于96 孔板中。 在37 ℃下培养5%CO2后,用PBS 洗涤差异处理的细胞12 h,得到贴壁细胞,得到纯化的腹膜巨噬细胞。 供试验用[8]。
2.5 MTT 法测定试验化合物对小鼠腹腔巨噬细胞的药物毒性
GLSP1 和GLSP2 均为各自稀释成1.6,8,40,200,1 000 μg/mL。 它们均用含有2%胎牛血清的1640 培养基制备, 并通过0.22 μmol/L 过滤器过滤。
调整小鼠腹腔巨噬细胞至2×106个/mL,100 μL/孔种板于96 孔板中。设定空白对照组,正常对照组和化合物1 和2 的单一给药组(浓度1.6,8,40,200,1 000 μg/mL),于37 ℃,5% CO2培养箱中培养20 h 后, 每孔加入100 μL MTT (1 mg/mL)4 h,用移液管小心吸出上清液。 每孔加入150 μL酸化异丙醇,在570 nm 处测量OD 值以计算细胞存活率[9]。
细胞活力%=(OD样品-OD空白)/(OD对照-OD空白)×100%
2.6 采用MTT 法检测GLSP 对小鼠LPS 刺激的腹腔巨噬细胞增殖的影响
设置对照组,LPS 组及LPS+GLSP 组。 在LPS+GLSP 组加入GLSP 预孵4 h 后,再在LPS 组和LPS+GLSP 组分别加入LPS 刺激, GLSP1 和GLSP2 的浓度梯度分别设置为1.6,8,40,200,1 000 μg/mL,终质量浓度10 mg/L。培养至48 h 时使用相同方法检测[9]。
增殖抑制率(PI)=[1-(ODLPS-ODGLSP-LSP)/(ODLPS-OD对照)]×100%
2.7 试验药物对小鼠腹腔巨噬细胞产生NO 的
影响及LPS 诱导的NO 释放抑制
2.7.1 试验药物刺激小鼠腹腔巨噬细胞产生NO将1 mL/孔接种在24 孔板上, 并将细胞差异连接12 h,并将差异粘附后的细胞用于测试。建立空白对照组, 正常对照组和化合物1 和2 的单一给药组(浓度为1.6,8,40,200,1 000 μg/mL); 孵育24 h 后,1 500 r/min×10 min 板离心,吸取各孔上清50 μL 转入96 孔板中, 按顺序添加Griess I 试剂和GriessII 试剂50 μL,并根据试剂盒说明制作标准曲线。 在550 nm 条件下检测吸光度[10]。
2.7.2 GLSP 对LPS 诱导的PM 的NO 释放的抑制作用 将腹膜液细胞浓度调节至2×106个细胞/mL,并将1 mL/孔接种在24 孔板上。 将细胞与差异物连接12 h,测试差异粘附后的细胞。空白对照组,正常对照组,化合物1 和2 与LPS 组合(浓度1.6,8,40,200,1 000 μg/mL 同时含 5 μg/mL LPS);孵育24 h 后,1 500 r/min×10 min 板离心,吸取各孔上清50 μL 转入96 孔板中, 依次添加Griess I 试剂和GriessII 50 μL, 并根据试剂盒的说明制作标准曲线。在550 nm 条件下检测吸光度[11]。
2.8 试验化合物对小鼠腹腔巨噬细胞吞噬作用的影响
将腹膜液细胞的浓度调节至2×106个细胞/mL,并将1 mL/孔接种在24 孔板上。 将细胞与差异物连接12 h,测试差异粘附后的细胞。建立空白对照组,正常对照组和单独的测试组1 和2(浓度为1.6,8,40,200,1 000 μg/mL); 温育24 h 后,弃去上清液,向各孔中加入0.75 g/L 中性红试剂500 μL。在37 ℃,5% CO2培养箱中孵育30 min 后,弃去上清液并用PBS 小心冲洗3 次。加入500 μL 醋酸与乙醇混合液 (1 mol/L 醋酸∶无水乙醇=1∶1),孵育2 h,540 nm 检测吸光度[9]。
2.9 试验化合物对腹膜巨噬细胞上清液和LPS共培养物中TNF-α 的影响
将腹膜液细胞的浓度调节至2×106/mL, 并将1 mL/孔接种到24 孔板中。 将细胞与差异物连接12 h,测试差异粘附后的细胞。 空白对照组,正常对照组,模型组(LPS100 ng/mL),试验药物1 和2给药组 (浓度1.6,8,40,200,1 000 μg/mL 同时含100 μg/mL LPS);给药24 h 后,1 500 r/min×10 min板离心,收集上清,Elisa 检测TNF-α。 步骤参考试剂说明书:将50 μL 样品稀释剂,上清液和检测抗体在室温下孵育3 h, 并以300 μL/孔×6 次洗涤板。将细胞与100 μL 辣根过氧化物酶一起在每个孔中孵育45 min。 添加终止溶液, 在450 nm 和570 nm 处进行双波长检测[9]。
3 数据处理
在3 个平行试验中测量指标, 并且通过ANOVA(例如DPS 7.05 和Origin 7.5)分析数据,用于方差分析,显着性分析和相关性分析。
4 结果与分析
4.1 GLSP1 和GLSP2 对小鼠脾细胞体外增殖的作用
从表1 可以看出,随着浓度的增加,GLSP1 和GLSP2 可以在一定程度上促进脾细胞的增殖。 当剂量小于200 μg/mL 时, 增殖指数与结构多糖浓度呈正相关,2 的作用更明显。各浓度组GLSP2 的增殖指数均高于GLSP1,但从表1 可以看出,分别处理灵芝多糖时,分别处理脾细胞。脾细胞的增殖远低于用ConA 处理的组(5 μg/mL);当组合施用时,与单独施用时相比,测试化合物1 和2 在一定程度上刺激脾细胞的增殖。随浓度增加而增加,呈剂量-效应关系,但低于ConA 处理组(5 μg/mL),该试验的结果表明GLSP1 和GLSP2 均具有促进脾细胞增殖的作用,但与ConA 没有协同作用。
4.2 MTT 法检测小鼠腹腔巨噬细胞的药物毒性
在测试GLSP1 和GLSP2 对小鼠腹膜巨噬细胞水平的影响时, 有必要确定这两个样品是否对BALB/c 小鼠中的腹膜巨噬细胞有毒。 通过MTT测定法测试GLSP1 和GLSP2 在质量浓度为8,40,200,1 000 μg/mL 时对小鼠腹腔巨噬细胞存活的影响。从表2 中可以看出,在5 个浓度梯度试验中,GLSP1 和GLSP2 都不会对细胞产生药物毒性。可以看出,GLP 对小鼠腹膜巨噬细胞的活性没有影响, 并且所用剂量的毒性不影响从随后的试验中获得的结论(表2)。
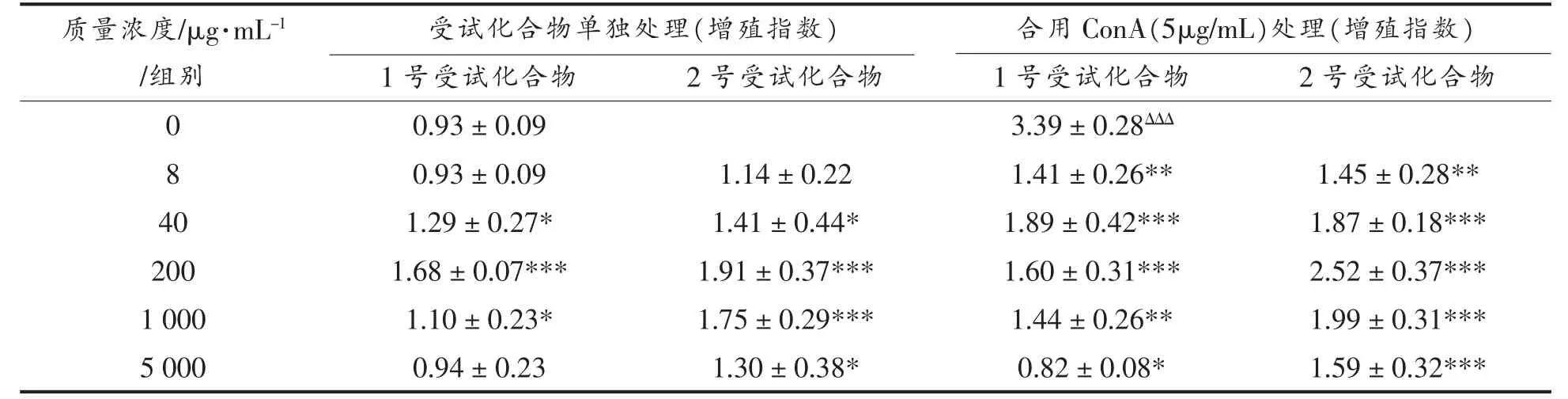
表1 GLSP 对脾细胞单独作用及与刀豆蛋白共同作用对脾细胞增殖指数的影响Table 1 Effect of GLSP1, GLSP2 on proliferation of spleen cells induced by ConA
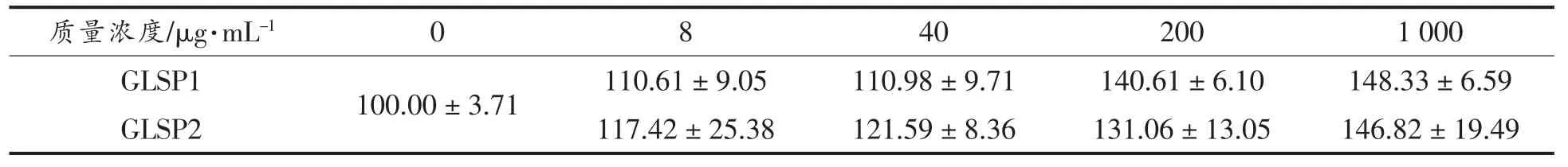
表2 受试药物对BALB/c 小鼠腹腔巨噬细胞毒性作用 (存活率%)Table 2 Effect of GLSP1, GLSP2 on survival rate of PM(%)
4.3 GLSP 对LPS 刺激的PM 增殖的影响
同样用MTT 法检测各浓度GLSP 对LPS 刺激后48h 时细胞增殖的抑制率(PI),结果显示(图1), 质量浓度为1.6 ~200 μg/mL 的GLSP1 和GLSP2 均能抑制LPS 诱导的小鼠腹腔巨噬细胞的增殖,并且呈剂量依赖性,其中40~200 μg/mL 的GLSP 的抑制作用已经达到了较高的水平,而且由图1 可以看出,GLSP2 相比于GLSP1 而言,对PM的增殖有着更强的抑制作用。 用MTT 法测定LPS刺激后48 h 细胞增殖的抑制率(PI)。 质量浓度为1.6~200 μg/mL 的GLSP1 和GLSP2 抑制LPS 诱导的小鼠腹腔巨噬细胞的增殖。 并且以剂量依赖性方式,40~200 μg/mL 的GLSP 抑制达到高水平。此外,从图1 中可以看出,GLSP2 对PM 增殖的抑制作用强于GLSP1。
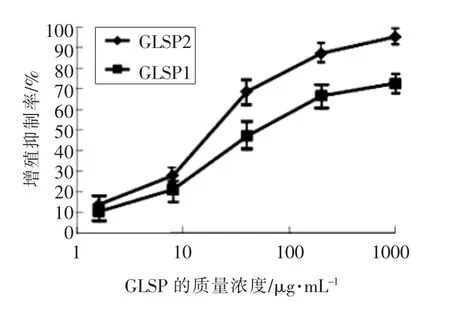
图1 GLSP 浓度对LPS 诱导的巨噬细胞增殖抑制率的影响Fig.1 Effect of GLSP to the cell habitation of PM
全身巨噬细胞具有多种异质表型, 在组织稳态,先天免疫和适应性免疫中发挥复杂作用,特别是在宿主防御感染和损伤方面起着重要作用。 由LPS 激活的巨噬细胞是由细胞介导的免疫应答产生的效应细胞, 具有增强的微生物和肿瘤杀伤能力,并分泌高水平的促炎细胞因子和介质。由于细胞外信号调节激酶1/2(ERK-1/2)的激活在巨噬细胞增殖中起关键作用, 其对巨噬细胞增殖的抑制作用可归因于其对 ERK-1/2 活化的抑制作用[12]。
4.4 试验药物对小鼠腹腔巨噬细胞产生NO 的影响及LPS 诱导NO 释放的抑制作用
4.4.1 GLSP 刺激小鼠腹腔巨噬细胞产生NO 表3 中的结果表明GLSP1 和GLSP2 可以在小鼠腹膜巨噬细胞中诱导NO 产生, 表明GLSP1 和GLSP2 后小鼠腹膜巨噬细胞的活性增强。 其中,GLSP1 对小鼠腹腔巨噬细胞的激活作用强于GLSP2。 而且GLSP1 和GLSP2 都随着用量的增加对小鼠腹腔PM 的NO 生成量增加成正相关,说明均具有剂量依赖性,有着明显的量效关系。

表3 受试药物刺激小鼠腹腔巨噬细胞NO 的生成量(μmol/L)Table 3 Effect of GLSP1, GLSP2 on NO level of PM
4.4.2 抑制LPS 诱导的LPS 释放PM LPS 是PM中炎症介质的重要刺激因子。 它可以在短时间内刺激巨噬细胞产生NO, 而GLSP1 和GLSP2 可以抑制LPS 诱导的PM 释放NO。通过减少释放炎症介质和细胞因子, 吞噬作用和激活特异性免疫的活化巨噬细胞群的数量, 达到防止免疫应答过度的目的。 根据表4 的结果,2 号样品比1 号样品强。 存在剂量-效应关系并且是剂量依赖性的。 较高浓度的GLSP 抑制LPS 诱导的NO 释放。

表4 受试药物对LPS 诱导的PM 的NO 释放的抑制作用(μmol/L)Table 4 Effect of GLSP1, GLSP2 on NO level of PM after stimulation by LPS
如图2 所示, 静息巨噬细胞仅产生少量NO,并且巨噬细胞在LPS 刺激24 h 后合成了大量NO。其质量浓度从(0.82±0.14)μg/mL 显著上升至(8.07±0.42)μg/mL(P<0.01);终质量浓度为200~1 000 μg/mL 的GLSP2 可显著抑制LPS 诱导的NO 产生。 GLSP1 还可以抑制NO 的产生,但效果不如GLSP2 明显。

图2 不同剂量GLSP 对LPS 诱导的PM 产生NO 的影响Fig.2 Effect of GLSP1, GLSP2 on NO level of PM after stimulation by LPS
NO 是细胞和细胞之间的信使分子,具有极其重要的生理作用。 据报道, 灵芝多糖可以抑制THP-1 巨噬细胞中诱导型NO 合酶(iNOS)mRNA的表达,抑制NO 的合成。 需要进一步研究GLED在灵芝结构中的作用机理, 可以作为下一步的线索和思路[14]。
4.5 灵芝结构多糖对小鼠腹腔巨噬细胞吞噬功能的影响
中性红染料试验用于检测GLSP1 和GLSP2对小鼠腹腔巨噬细胞吞噬作用的影响。结果表明,GLSP1 和GLSP2 对小鼠腹膜PM 的直接作用可以促进巨噬细胞吞噬中性红的能力。 然而, 随着GLSP 浓度的增加,其对小鼠腹腔巨噬细胞的吞噬功能的剂量依赖性效应降低, 并且测试样品2 的效果强于测试样品1 的效果。

表5 受试药物对小鼠腹腔巨噬细胞吞噬功能的影响(OD=540nm)Table 5 Effect of GLSP1, GLSP2 to Phagocytosis of mouse macrophages (OD=540 nm)
吞噬作用是吞噬细胞如巨噬细胞消除外源病原微生物和内源性衰老和死细胞的重要手段。LPS刺激可以增强单核细胞-巨噬细胞的吞噬能力,但也可能导致吞噬细胞的过度活化,导致炎性疾病。在这项研究中, 中性红染料方法被用来评估巨噬细胞的吞噬作用。 此外,GLSP2 的吞噬作用强于GLSP1,GLSP1 可以保护炎症灶的正常组织[15]。 然而,GLSP 下调巨噬细胞吞噬能力的具体机制还有待进一步研究。
4.6 灵芝结构多糖对腹腔巨噬细胞与LPS 共培养上清液TNF-α 的影响
4.6.1 GLSP 直接作用腹腔巨噬细胞对TNF-α 的影响 从表6 中可以看出, 具有不同浓度梯度的GLSP 可以促进腹膜巨噬细胞产生TNF-α。这表明GLSP 有激活产生这种炎症因子的细胞的作用。GLSP1 对PM 产生TNF-α 的影响:随着GLSP1 浓度的增加,TNF-α 的量也增加, 但40 μg/mL 后的效果趋于平缓。 GLSP2 对巨噬细胞的作用也是相同的。

表6 受试化合物对腹腔巨噬细胞上清液TNF-α 的影响 (x±s,n=3)(ng/L)Table 6 Effect of GLSP1, GLSP2 on TNF-α level of PM in mice (x±s,n=3)(ng/L)

表7 受试化合物对腹腔巨噬细胞与LPS 共培养上清液TNF-α 的影响 (x±s,n=3)(ng/L)Table 7 Effect of GLSP1, GLSP2 on TNF-α level of PM after stimulation by LPS (x±s,n=3)(ng/L)
4.6.2 GLSP 对LPS 诱导的PM 的TNF-α 释放的抑制作用 从图3 中可以看出,GLSP2 可显著抑制LPS 诱导的TNF-α 细胞因子的合成, 而不影响细胞活力。 因此,GLSP2 可有效改善BALB/c 小鼠腹腔巨噬细胞LPS 的诱导。 然而,基本上没有剂量依赖性和剂量-效应关系。 GLSP1 对LPS 诱导的TNF-α 细胞因子的合成没有抑制作用。
在PM 释放的许多细胞因子中,TNF-α 作为早期促炎细胞因子引起了很多关注。 直接介导组织炎症损伤,促进其他细胞因子的释放,并介导炎症反应的链扩增作用。 越来越多的研究表明,在炎症反应中,TNF-α 刺激介导补体瀑布效应的其他细胞因子的产生。 激活中性粒细胞,淋巴细胞,巨噬细胞,刺激PM 产生过氧化物,诱导其他细胞因子的释放。是一种极为关键的炎症启动因子[16]。在该试验中, 可以看出GLSP2 对LPS 诱导的PM 产生的TNF-α 的量的抑制具有显著影响。

图3 不同剂量GLS P 对LPS 诱导的PM产生TNF-α 的影响Fig.3 Effect of GLSP1, GLSP2 on TNF-α level of PM after stimulation by LPS
5 结论
灵芝结构多糖GLSP1 和GLSP2 作为一种新型天然药物单体, 可以抑制LPS 诱导的巨噬细胞增殖。 它减弱了其吞噬功能并下调LPS 激活的巨噬细胞产生的NO 和TNF-α 的水平。 特别是GLSP2 的功能更加显著, 其对巨噬细胞的重要行为和功能的调节充分证明了其作为调节先天免疫应答的药物的潜力。 它可能成为肿瘤、感染、自身免疫疾病和免疫缺陷疾病等疾病的辅助治疗。 它的作用和涉及的具体分子机制是错综复杂的, 灵芝结构多糖具体的构效关系尚待更深入的研究和探讨。
