NKA-9大孔树脂对绿豆皮黄酮的纯化研究
2019-07-30姬青华马丽苹樊金玲朱文学关宁宁薛依涵
罗 磊 姬青华 马丽苹 樊金玲 朱文学 关宁宁 薛依涵
(河南科技大学食品与生物工程学院 河南省食品原料工程技术研究中心 河南洛阳471023)
绿豆(Phaseolus radiatus L.)又名青小豆,为豆科草本植物绿豆的种子[1]。 绿豆皮,中医称为绿豆衣,占绿豆总质量的7%~10%。研究表明绿豆皮中含有丰富的黄酮类化合物、鞣质、皂甙生物碱、强心甙、蒽醌类化合物等成分[2],其中黄酮类化合物占50%左右。 黄酮类化合物具有抗氧化、 抗肿瘤、清热解毒、止泻利尿、止咳平喘、防治心血管疾病以及抗菌消炎等保健功效[3-6]。 绿豆的保健功效主要来源于绿豆皮[7-8]。 绿豆皮作为绿豆淀粉和绿豆芽加工副产物,营养价值一直未得到重视,大多作为废弃物用于生产饲料,造成资源的极大浪费。
近年来, 国外有关绿豆皮的研究主要是提取物对人体机能的改善。 例如:Lee S 等[9]研究了绿豆皮提取物黄酮对巨噬细胞的抗炎作用。 国内关于绿豆皮的研究主要在提取方面, 如朱文学等[10]研究了绿豆皮黄酮超声辅助提取工艺。 大孔吸附树脂是一种稳定性好、 不溶于酸碱的有机高分子聚合物,具有选择性好、吸附量大、吸附速度快、解吸容易、再生方便等特点[11-12],适于黄酮类物质的分离纯化,然而,涉及绿豆皮黄酮提取物的吸附特性和纯化方法研究较少, 未用高效液相色谱分析纯化前、后绿豆皮黄酮。本文采用静态吸附法研究NKA-9 大孔树脂对绿豆皮黄酮提取液的吸附动力学和吸附等温线,并优化NKA-9 纯化绿豆皮黄酮的最佳工艺条件。 采用高效液相色谱分析纯化前、后绿豆皮黄酮的成分变化,并在此基础上进行抗氧化分析。这些研究对科学利用绿豆皮资源,提高绿豆产品的附加值有重要意义。
1 材料与方法
1.1 材料与试剂
绿豆皮: 采购于洛阳市新农村蔬菜食品有限公司。 去除绿豆皮中的杂质,于45 ℃恒温干燥箱中干燥至质量恒定,粉碎过80 目筛;NKA-9、AB-8、D101 和DM301 大孔吸附树脂: 购于沧州宝恩吸附材料科技有限公司。
试验试剂:芦丁(CAS 号:153-18-4),上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH), 伊卡生物技术有限公司; 无水乙醇、醋酸、醋酸钠、三氯化铝、氢氧化钠等均为国产分析纯。
1.2 仪器与设备
HC-1000Y 型高速粉碎机, 北京市永光明医疗仪器厂;FA1004 型电子分析天平, 美国双杰兄弟集团有限公司;WD900B 型微波炉,顺德市格兰仕微波炉电器有限公司;UV2400 紫外-可见分光光度计, 上海舜宇恒平科学仪器有限公司; 湘仪TDZ5-WS 型离心机, 上海圣科仪器设备有限公司;HL-2D 型恒流泵, 上海圣科仪器设备有限公司;THZ-82 气浴恒温振荡器,金坛市鸿科仪器厂;Re-52A 旋转蒸发器,上海亚荣生化仪器厂;BSZ-100 型自动收集器,上海圣科仪器设备有限公司;Φ1.6×60 cm 玻璃层析柱,上海沪西分析仪器厂有限公司;Agilent 1260 型高效液相色谱仪, 美国安捷伦公司。
1.3 试验内容与方法
1.3.1 树脂的预处理 根据参考文献[13]并作适当修改,称取一定量的4 种树脂,用2 倍体积无水乙醇浸泡24 h 后,用蒸馏水洗至无醇味,然后用2倍体积的4% HCl 溶液浸泡5 h,用蒸馏水洗至中性; 再用2 倍体积的4% NaOH 溶液浸泡5 h,蒸馏水洗至中性后浸泡,备用。
1.3.2 样液的制备 将16.00 g 绿豆皮粉末和320 mL 体积分数为70%的乙醇混合均匀后,在功率为540 W 的条件下微波提取80 s,提取液4 800 r/min离心10 min, 在40 ℃下旋蒸至无醇味, 再加入4倍体积无水乙醇去除蛋白质和多糖, 经过滤、离心、浓缩之后定容至80 mL,备用。
1.3.3 标准曲线的绘制及样液中黄酮含量的测定
采用醋酸-醋酸钠-三氯化铝显色法[10],对样品进行全波长扫描, 确定最大吸收峰在270 nm,以芦丁为标准品, 得到线性回归方程为:y=25.405x+0.1285,其中x 为黄酮质量浓度(mg/mL),y 为吸光度,相关系数R2=0.9963。
移液管取黄酮提取液0.4 mL 于10 mL 具塞刻度试管中,以醋酸-醋酸钠-三氯化铝显色法,在270 nm 测吸光度并利用回归方程,按下面公式计算得到绿豆皮黄酮提取液中总黄酮的含量。
式中:C——提取液黄酮的质量浓度,mg/mL;V——提取液体积,mL;N——稀释倍数;W——原料质量,g。
1.3.4 静态吸附动力学试验[14]称取NKA-9、AB-8、D101 和DM301 树脂各1.00 g, 分别置于100 mL 具塞锥形瓶中, 加入30 mL 质量浓度为0.46 mg/mL 的绿豆皮黄酮溶液,于恒温振荡器(25 ℃,120 r/min)振荡吸附12 h,每隔一定时间吸取上清液测吸光度,计算吸附率,根据所得数据绘制大孔树脂的静态吸附动力学曲线。 分别采用准一级动力学(5)和准二级动力学模型(6)对吸附动力学曲线进行拟合[15]。 筛选出吸附速率最快的树脂。
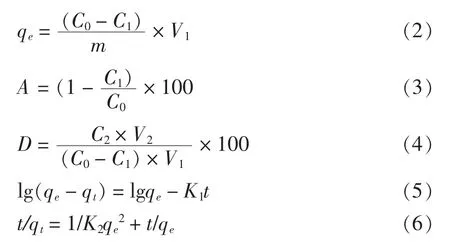
式中:A——吸附率,%;D——解吸率,%;C0——吸附前黄酮质量浓度,mg/mL;C1——吸附后黄酮质量浓度,mg/mL;C2——解吸后黄酮质量浓度,mg/mL;V1——样品液体体积,mL;V2——解吸液体积,mL;m——大孔吸附树脂的质量,g;qe——单位质量树脂的平衡吸附量,mg/g;t——吸附时间,min;qt——t 时刻树脂的吸附量,mg/g;K1—— 一级速率方程常数,g/(mg·min);K2——准二级速率方程常数,g/(mg·min)。
1.3.5 吸附等温线模型称取选定树脂1.00 g,分别装入100 mL 具塞锥形瓶中,加入不同浓度的绿豆皮黄酮粗提液30 mL,于不同温度(25,35,45℃)振荡(120 r/min)8 h,过滤,测定吸附饱和时溶液中黄酮的平衡吸附量, 得到不同温度下的吸附等温线, 并用吸附热力学模型对其进行线性拟合[16]。
吸附等温方程可以定量说明恒温状态下,树脂对不同起始浓度的黄酮化合物溶液的吸附情况[17]。 本文采用最常见的Langmuir 吸附等温方程(7)和Freundlich 吸附等温方程(8)对吸附等温线进行拟合,以描述其吸附机制[18-19]。


式中:Ce——溶液平衡质量浓度,mg/mL;Qe——平衡吸附量,mg/g;Qm——饱和吸附量,mg/g;KL——Langmuir 方程常数, 可以评价吸附量的大小,mL/mg;KF——Freundlich 方程常数,mL/mg;n——Freundlich 方程常数, 可以描述等温线变化趋势。
1.3.6 大孔树脂的动态吸附试验
1.3.6.1 上样流速和上样体积的选择 将预处理好的NKA-9 树脂装入1.6 cm×60 cm 的玻璃层析柱中,柱床体积(1 BV)为80 mL,将质量浓度为0.4 mg/mL 的黄酮提取液以1,2,3 BV/h 的流速匀速上柱,流出液每10 mL 收集一管,当流出液黄酮的质量浓度达到上样液黄酮质量浓度的十分之一,认为黄酮已达到泄漏点[20],停止上样,测定流出液黄酮的质量浓度, 绘制出绿豆皮黄酮的泄漏曲线,找出泄漏点,得到最佳的上样流速和上样体积。
1.3.6.2 上样液pH 的选择 为考察上样液pH 对动态吸附的影响,配制质量浓度为0.4 mg/mL 的绿豆皮黄酮提取液, 将绿豆皮黄酮提取液的pH 分别调至1,2,3,4,5,6,7 七个水平,以2 BV/h 的流速通过层析柱,收集流出液,测定吸光度,计算吸附率。
1.3.6.3 上样黄酮质量浓度对树脂吸附的影响采用湿法装柱, 配制绿豆皮黄酮的质量浓度分别为0.2,0.3,0.4,0.5,0.6,0.7 mg/mL,以2 BV/h 的流速上样, 每10 mL 收集一管流出液, 测定黄酮含量,计算吸附率,根据泄露曲线得到最佳上样液黄酮的质量浓度。
1.3.7 大孔树脂的动态解吸试验
1.3.7.1 解吸液体积分数的选择 按照动态的最佳吸附条件对已吸附好的树脂进行装柱, 分别用体积分数为40%,50%,60%,70%,80%,90%的乙醇溶液进行洗脱,控制洗脱流速2 BV/h,收集流出液,测定吸光度,计算黄酮的解吸率,考察洗脱液体积分数对洗脱效果的影响。
1.3.7.2 洗脱液pH 的选择 按照动态的最佳吸附条件对已吸附好的树脂进行装柱, 将70%乙醇的pH 分别调至1,2,3,4,5,6,7, 以2 BV/h 的流速进行洗脱,收集流出液,测定吸光度,计算解吸率,考察洗脱液pH 对洗脱效果的影响。
1.3.7.3 洗脱流速和洗脱体积的选择 在动态最佳吸附条件下,考察不同洗脱流速对NKA-9 大孔树脂洗脱效果的影响。 将70%乙醇溶液的pH 调至3,分别以1,2,3,4,5 BV/h 的速度进行洗脱,洗脱液分步收集,每10 mL 收集一管,测定每管中解吸液黄酮的质量浓度,计算相应的解吸率。以流出液体积为横坐标, 流出液黄酮的质量浓度为纵坐标,绘制在不同洗脱速率条件下的洗脱曲线,确定出最佳的洗脱流速和洗脱体积。
1.3.8 黄酮纯度和回收率的测定 取绿豆皮黄酮粗提液和经NKA-9 树脂纯化后的黄酮洗脱液,于50 ℃减压浓缩至无醇味,真空冷冻干燥,得到粗黄酮和纯化后黄酮的冻干粉, 按下式计算黄酮的纯度和回收率。

式中:P——黄酮的纯度,%;Q——黄酮的回收率,%;C1——纯化前黄酮质量浓度,mg/mL;V1——纯化前黄酮总体积,mL;C2——纯化后黄酮质量浓度,mg/mL;V2——纯化后黄酮总体积,mL;m——冻干后样品质量,mg。
1.3.9 纯化前后绿豆皮黄酮液相色谱图的对比标准品的制备: 精密称取牡荆素和异牡荆素标准品,用甲醇溶解并定容至10 mL,制得质量浓度分别为210 μg/mL 和220 μg/mL 的混合对照品溶液[21]。
供试液的制备:称取16.00 g 绿豆皮粉末分为两组,其中一组按照1.3.2 节的方法制备,另一组提取液按照大孔树脂动态吸附和解吸的最佳条件进行绿豆皮黄酮的纯化, 纯化后的样液经减压浓缩至20 mL 而成。
高效液相色谱法的工作条件:色谱柱:Agilent ZORBAX SB-C18反相色谱柱; 流速:0.6 mL/min;检测波长:268,335 nm; 柱温:25 ℃; 进样量:10 μL;检测器:DVD 检测器;流动相:A 为甲醇,B 为1%磷酸盐缓冲液; 梯度洗脱:0~15 min,25%A,75%B;15~20 min,100%A,0%B; 后运行时间:5 min。
1.3.10 绿豆皮黄酮纯化前后抗氧化活性研究
1.3.1 0.1 清除DPPH 自由基 根据参考文献[22-23]作部分修改,即将不同质量浓度的绿豆皮黄酮和VC 阳性对照溶液各2 mL 与2 mL DPPH (10-4mol/L,95%乙醇)溶液混匀后,避光反应20 min,于波长517 nm 处测定吸光度Ai;2 mL 空白样品(蒸馏水)与2 mL DPPH 溶液混匀,避光反应20 min后测定吸光值为Ac,将2 mL 不同质量浓度的样品溶液和VC 阳性对照溶液与2 mL 95%乙醇混匀后测定吸光度值为Aj, 按下式计算DPPH 自由基清除率。
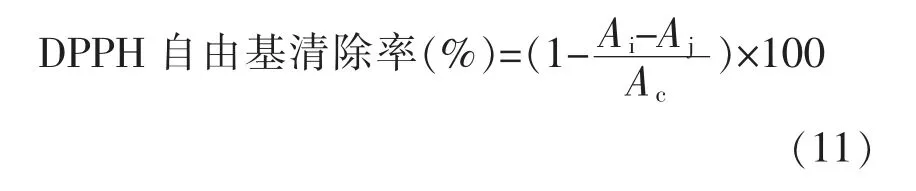
1.3.1 0.2 清除·OH 自由基 根据参考文献[24],采用水杨酸法对绿豆皮黄酮进行·OH 自由基清除试验。
2 结果与分析
2.1 吸附动力学
2.1.1 吸附动力学曲线 吸附过程的动力学主要研究吸附过程的速率,吸附速率控制固-液界面上吸附质的滞留时间[25]。在25 ℃条件下,分别测定了不同吸附时间NKA-9、AB-8、D101 和DM301 型树脂对绿豆皮黄酮的吸附量, 画出静态吸附动力学曲线,如图1,由图1 可以看出,NKA-9、AB-8、D101 和DM301 型树脂对绿豆皮黄酮的吸附均为快速平衡型, 在150 min 之前单位吸附量随时间增加变化较大,之后基本保持不变,表明在试验条件下吸附达到平衡,其中,NKA-9、AB-8、D101 和DM301 型树脂的平衡吸附量分别达到10.363,8.893,9.732,8.487 mg/g。
2.1.2 吸附动力学模型 准一级动力学和准二级动力学模型的拟合参数见表1,从表中可以看出,4 种树脂的准二级动力学模型的线性相关度要明显高于准一级动力学, 准二级动力学所得平衡时树脂的吸附量要显著高于准一级动力学方程。 在4 种树脂中,NKA-9 树脂最终平衡吸附量与试验值较为接近, 说明准二级动力学更适用于描述NKA-9 树脂对绿豆皮黄酮的吸附过程。以t/qt对t作图,见图2,求得直线方程为准二级速率方程,由表观吸附速率常数K 可知,NKA-9 树脂吸附速率要高于其他3 种树脂, 这与图1 的试验结果相吻合。 因此,选择吸附速率较高的NKA-9 树脂进行以后的试验。
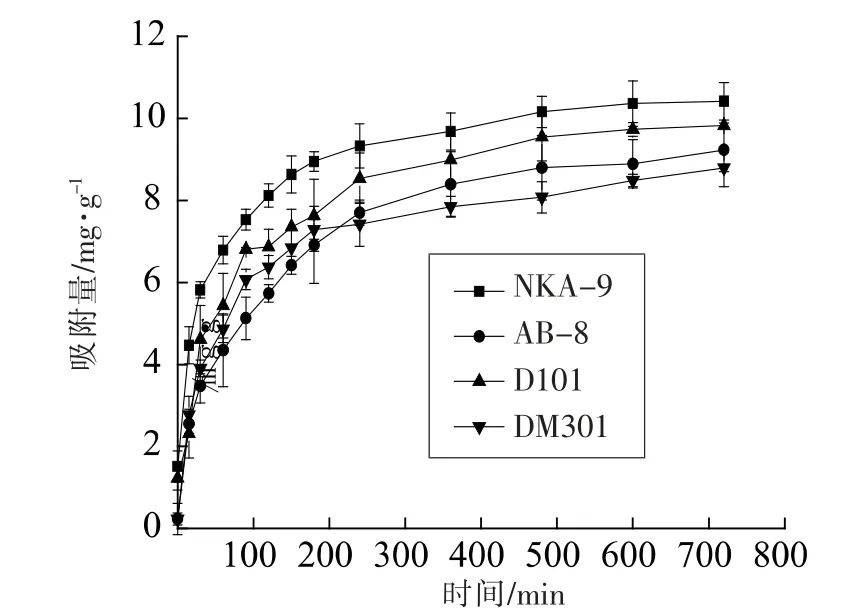
图1 吸附动力学曲线Fig.1 Static adsorption kinetics curves

图2 准二级吸附动力曲线Fig.2 Pseudo-second adsorption kinetic curve
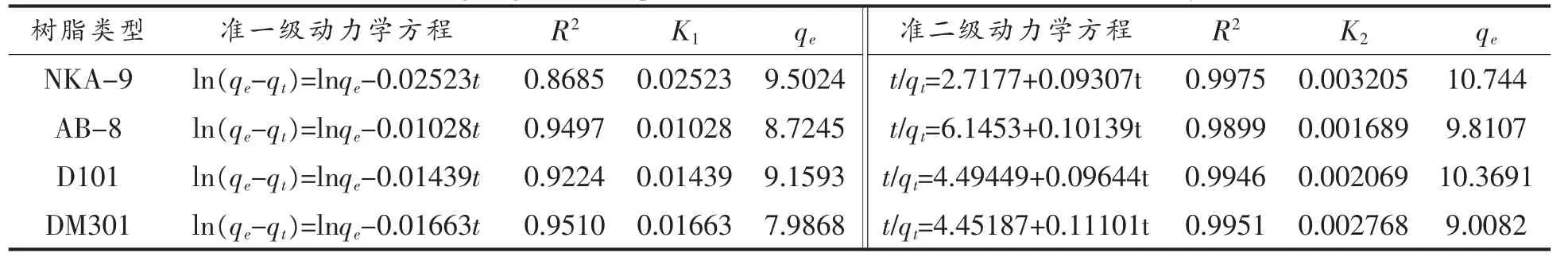
表1 动力学模型的线性拟合回归方程和相关系数Table 1 Linear fitting regression equations and correlation coefficients of the dynamics models
2.2 吸附等温线
不同温度下NKA-9 树脂对绿豆皮总黄酮的吸附等温线如图3 所示。从图中可以看出,NKA-9树脂的平衡吸附量随绿豆皮黄酮浓度的增加而增加,当质量浓度达到0.4 mg/mL 时,吸附量增加缓慢。 同时,吸附量随温度的升高而降低,这是因为树脂吸附绿豆皮黄酮的过程是自然放热的过程,温度较高时,黄酮的溶解性增加,不利于黄酮分子与树脂表面活性位点的结合, 从而导致吸附力降低,因此选择25 ℃进行试验;此外,随着绿豆皮总黄酮初始浓度的增加,吸附能力增强,但达到一定程度时增长变缓, 因而选取上样质量浓度为0.4 mg/mL。
采用Langmuir 吸附等温方程和Freundlich 吸附等温方程对吸附等温线进行拟合,分别以Ce对Ce/Qe和lnCe对lnQe作图并进行线性回归,回归方程和吸附相关参数见表2。
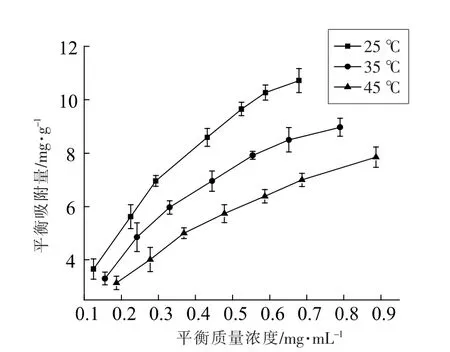
图3 不同温度下平衡吸附浓度和吸附量之间的关系Fig.3 The relationships between equilibrium adsorptionconcentrations and adsorption quantities at different temperature
由表2 可知,绿豆皮黄酮在NKA-9 树脂上的吸附基本既符合Langmuir 和Freundlich 等温吸附方程,从相关系数看,选用Langmuir 模型描述更佳。 在Langmuir 模型中,对于一定量的树脂,随着温度的升高,饱和吸附量Qm下降,可能是因为树脂吸附绿豆皮黄酮类物质过程是自发性放热的吸附过程且较高温度会抑制黄酮分子与树脂表面活性位点的结合[26]。 在Freundlich 模型中,特征常数n 均大于1,说明在研究范围内,NKA-9 树脂对绿豆皮黄酮的吸附为优惠吸附[27-28],经验常数KF随温度的升高而降低,说明吸附过程是放热的过程,低温有利于吸附。
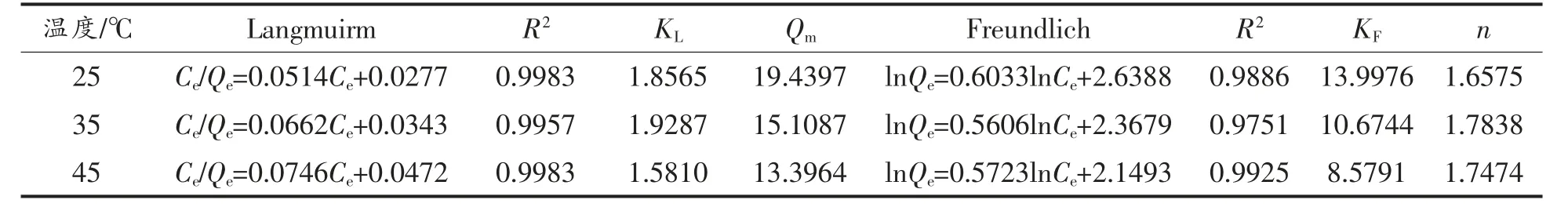
表2 不同温度下Langmuir 和Freundlich 吸附等温线模型拟合回归方程和吸附参数Table 2 Model fitting and adsorption data of Langmuir and Freundlich isotherm models
2.3 大孔树脂的动态吸附和解吸
2.3.1 上样流速和上样量对吸附效果的影响 如图4 所示,NKA-9 树脂对绿豆皮黄酮具有良好的动态吸附性能。 提取液分别以1,2,3 BV/h 的速度上样,其泄漏点分别在220(2.7 BV),170(2 BV),120 mL(1.5 BV)左右。 随着上样流速的增加,到达泄漏点时的上样量逐渐减小。 其中, 当流速在1 BV/h 时,最迟出现泄漏点,流速在3 BV/h 时,泄漏点最早,这是因为上柱速度过快,使绿豆皮黄酮与树脂接触时间较短,导致吸附率降低,上样速度过慢,黄酮与树脂充分接触,同时也会延长试验的循环周期[29]。 综合考虑,最佳上样流速为2 BV/h,此时,上样量为2 BV。
2.3.2 上样液pH 的选择 上样液pH 会影响黄酮的电离程度,改变其存在的形式和溶解度,从而影响大孔树脂对绿豆皮黄酮类化合物的吸附[30]。由图5 可知,随着上样液pH 的升高,NKA-9 树脂对绿豆皮黄酮的吸附先升高后降低。 当pH 为3时,吸附率最大,达到84.45%,当pH 大于3 时,黄酮的吸附率呈下降趋势。 这可能是因为大部分黄酮类化合物为多羟基酚类化合物,呈弱酸性,溶质在酸性条件下溶解度降低,有利于树脂的吸附[31];在碱性条件下,黄酮化合物以分子形式存在,不易与树脂发生吸附作用,此外,pH 值较小时,黄酮类物质的糖苷键水解也会影响树脂的吸附性。因此,选择上样液的pH 为3。
2.3.3 上样液质量浓度对树脂吸附的影响 由图6 可知,上样质量浓度在0.4 mg/mL 最迟出现泄漏点(2 BV),质量浓度大于0.4 mg/mL 泄漏点提前。通过计算吸附率,如图7,随着质量浓度的增加,NKA-9 树脂对绿豆皮黄酮的吸附率也随之增加,当黄酮质量浓度达到0.4 mg/mL 时,吸附率最大,达到89.22%,当质量浓度大于0.4 mg/mL 时,吸附率逐渐下降。原因可能是随着上样质量浓度增加,导致泄漏点提前, 使黄酮物质在树脂内部的扩散能力降低, 造成吸附率下降, 当上样质量浓度过高,所含杂质过多,杂质会与黄酮竞争吸附活性位点[32-33],也会造成层析柱滤膜的堵塞,从而影响吸附效果;当上样液的质量浓度较低时,吸附动力减少,降低吸附率。 因此,选择上样的质量浓度为0.4 mg/mL, 这与之前做的吸附等温线结果相一致。

图4 不同流速的吸附泄漏曲线Fig.4 Breakthrough curve at different flow rates
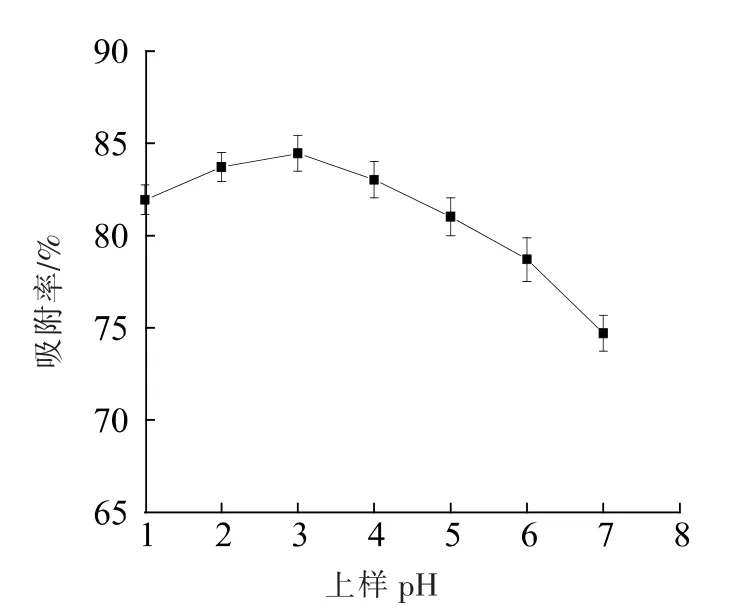
图5 上样液pH 值对吸附率的影响Fig.5 Effect of different pH values of sample solution on adsorption
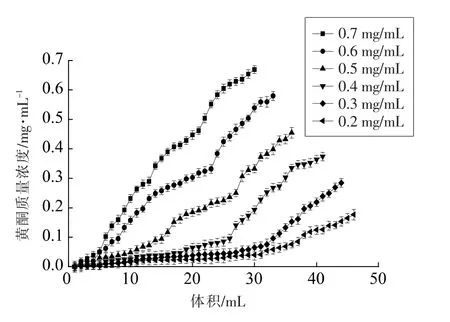
图6 不同黄酮质量浓度的吸附泄漏曲线Fig.6 Breakthrough curve at different sample concentration

图7 上样质量浓度对吸附率的影响Fig.7 Effect of sample concentration on adsorption rate of NKA-9 macroporous resin
2.3.4 乙醇体积分数对洗脱率的影响 由图8 可以看出,随着乙醇体积分数的增加,洗脱液对树脂中黄酮的解吸率逐渐增加, 当乙醇体积分数达到70%时,解吸率达到86.08%,随着乙醇体积分数的继续增加,解吸率逐渐下降。这可能是因为乙醇体积分数不同,极性大小也不同,黄酮和大孔吸附树脂之间存在一定的范德华力, 两物质的极性越相似则范德华力越大[34]。 乙醇的体积分数越大,极性越小,树脂中大量的醇溶性杂质就会越多,从而使绿豆皮黄酮的纯度下降, 而70%的乙醇可能与绿豆皮黄酮的极性相似,洗脱效果较好。 因此,选择70%的乙醇进行洗脱。
2.3.5 解吸液pH 对解吸效果的影响 由图9 可知, 绿豆皮黄酮的解吸率随pH 的增加先上升后下降。当pH 值为5 时,解吸率最高,达到84.61%,当pH 值大于5 时, 绿豆皮黄酮的解吸率下降趋势逐渐加强。 这可能是因为绿豆皮黄酮提取液呈弱酸性,弱酸性的条件有利于NKA-9 树脂对绿豆皮黄酮的解吸。 因此,选择洗脱剂的pH 值为5。
2.3.6 洗脱剂体积和洗脱流速对解吸效果的影响洗脱速率是影响树脂吸附分离特性的一个重要因素。由图10 可以看出,随着洗脱剂体积的增加,洗脱液中黄酮的质量浓度逐渐升高, 当到达一定洗脱体积之后, 洗脱得到的黄酮质量浓度逐渐下降,直到黄酮的质量浓度几乎不变,说明黄酮基本洗脱完全。 另外,随着洗脱液流速加快,洗脱带变窄,拖尾现象不明显,洗脱效果较好,洗脱液体积相对减少;流速过慢,洗脱时间增加,洗脱液的体积也相应地增加。 由图11 可知,随着洗脱流速的增加, 黄酮的解吸率逐渐增加, 当洗脱流速为2 BV/h 时,解吸率最高,达到91.26%,当流速继续增加, 解吸率逐渐下降。 因此, 选择洗脱流速为2 BV/h,此时,洗脱体积为180 mL(2.3 BV),洗脱效果最好。
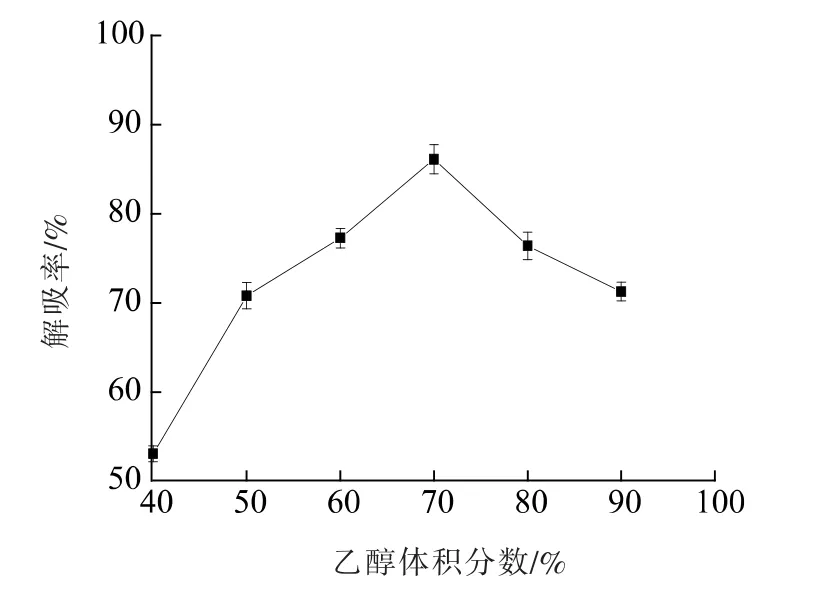
图8 乙醇体积分数对解吸率的影响Fig.8 Effect of ethanol concentration on adsorption quantity of flavonoids from mung bean hull

图10 不同洗脱速率对洗脱效果的影响Fig.10 Elution profiles of flavonoids on NKA-9 resin at different flow rates of aqueous ethanol
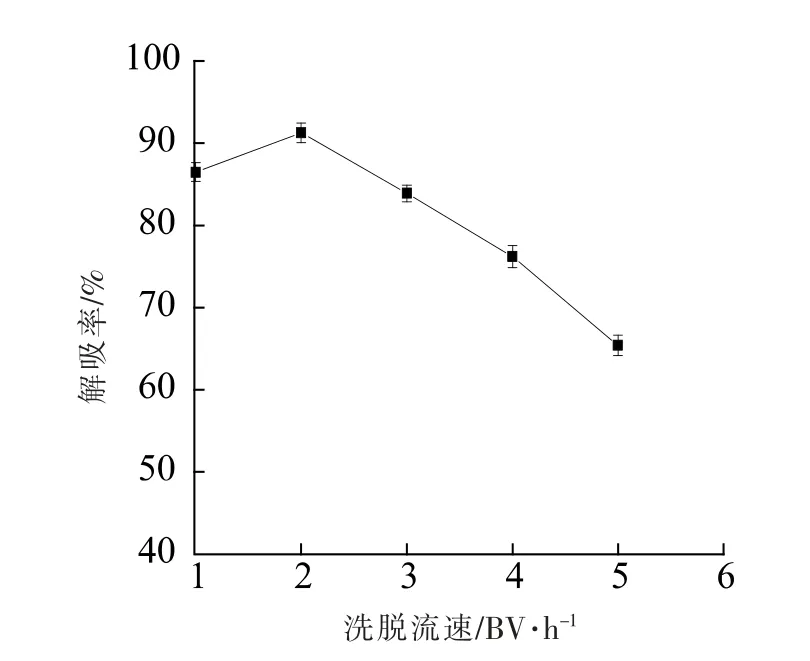
图11 洗脱速率对洗脱效果的影响Fig.11 Effect of elution rate on desorption efficiency
2.4 绿豆皮总黄酮的纯化效果
2.4.1 绿豆皮黄酮纯化前后黄酮纯度及回收率的比较 以NKA-9 树脂纯化绿豆皮黄酮的最佳工艺参数:上样液总黄酮质量浓度0.4 mg/mL、上样流速2 BV/h、上样液体积2 BV,上样液pH 3,洗脱液乙醇的体积分数70%,洗脱流速2 BV/h,洗脱液体积2.3 BV,洗脱液pH 5,纯化绿豆皮黄酮提取液,结果如表3。
2.4.2 绿豆皮黄酮纯化前后高效液相色谱图 图12 是标品的色谱图, 保留时间为13.963 min 和14.618 min 的分别是牡荆素和异牡荆素。 纯化前后的样液与标品对比, 说明绿豆皮黄酮提取液中主要的黄酮物质是牡荆素和异牡荆素。由图13 可知,等量的绿豆皮黄酮纯化前图谱在8~18 min 时响应值偏离零线较高, 可能是因为绿豆皮黄酮粗提液杂质存在引起的, 而纯化后的绿豆皮黄酮杂峰1 和2 显著减少,在8~18 min 响应值偏离零线较低,而且,纯化前后绿豆皮中牡荆素和异牡荆素的峰高无明显差异,说明经过NKA-9 树脂纯化后得到的成分纯度明显提高; 出现的峰1 的紫外光谱在310 nm 处有吸收,峰2 在230,280 和310 nm处有吸收,初步判断为鞣质或生物碱类物质。
2.5 绿豆皮总黄酮的抗氧化活性
2.5.1 清除DPPH 自由基 从图14 可知,随着绿豆皮黄酮和VC 质量浓度的增加,DPPH 自由基清除率逐渐上升。在质量浓度较低时,绿豆皮黄酮和VC 对DPPH 自由基清除作用显著,随着质量浓度增加, 清除率趋于平缓。 纯化后绿豆皮黄酮的DPPH 自由基清除率低于同一质量浓度的VC 溶液, 当质量浓度为62.5 μg/mL 时,VC 和纯化后绿豆皮黄酮DPPH 自由基清除率分别达到78.78%、65.64%。结果表明,纯化后的绿豆皮黄酮具有一定清除DPPH 自由基的能力。
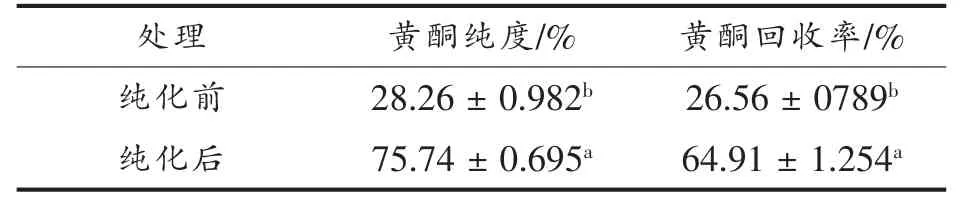
表3 NKA-9 树脂纯化绿豆皮黄酮的纯度和回收率Table 3 Recovery rate and purity of flavonoids from mung bean hull after purification with NKA-9
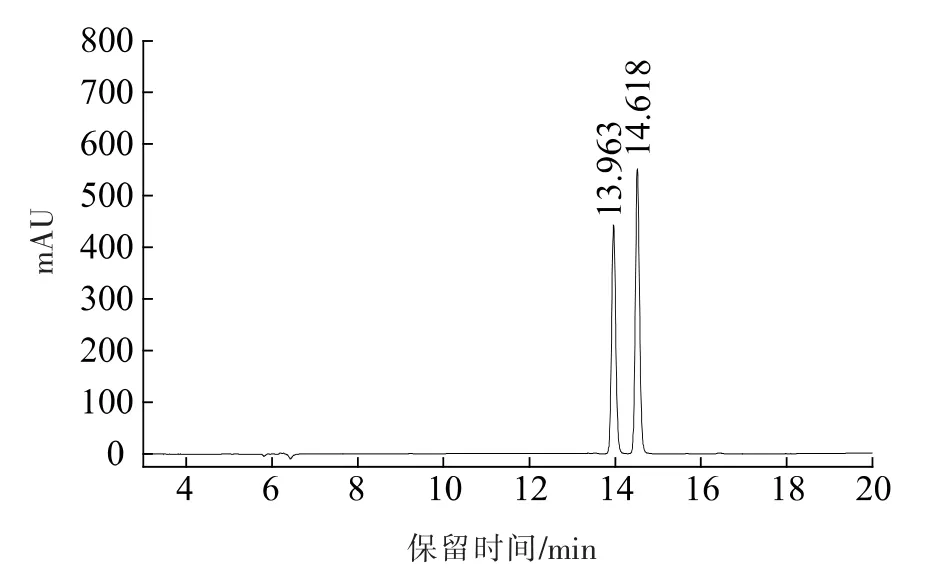
图12 标准样品的HPLCFig.12 HPLC chromatogram of standard samples
2.5.2 清除·OH 自由基 从图15 可知,绿豆皮黄酮和VC 对·OH 自由基清除能力与质量浓度呈正相关。在同一质量浓度下,绿豆皮黄酮的清除能力低于VC, 当质量浓度从0.025 mg/mL 上升到0.4 mg/mL 时,VC 的清除率从49.85%上升到97.61%,绿豆皮黄酮清除率从43.43%上升到89.55%。这说明纯化后的绿豆皮黄酮具有较好的·OH 自由基清除力。
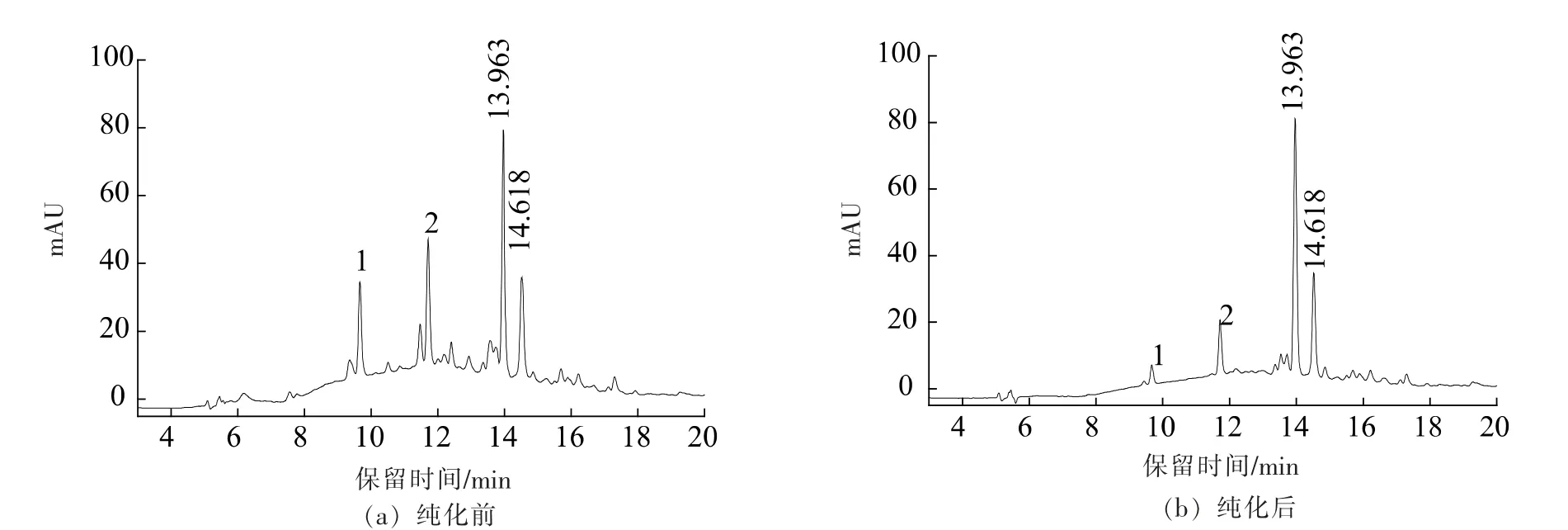
图13 绿豆皮黄酮提取液纯化前后HPLC 图Fig.13 The HPLC chromatogram of extract before and after purification of flavonoids from mung bean hull
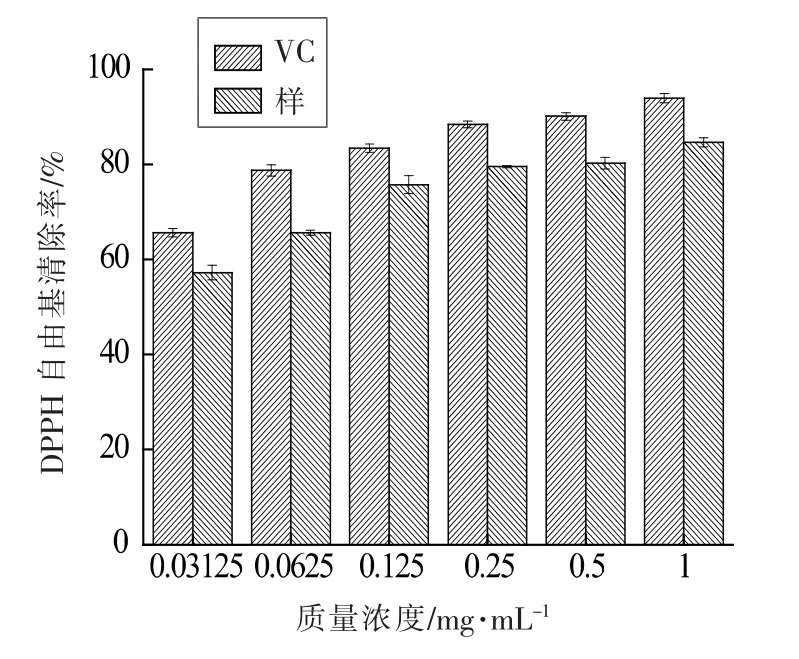
图14 绿豆皮黄酮DPPH 自由基清除效果Fig.14 DPPH radical scavenging effect of flavonoids extracted from phaseolus radiatus hull
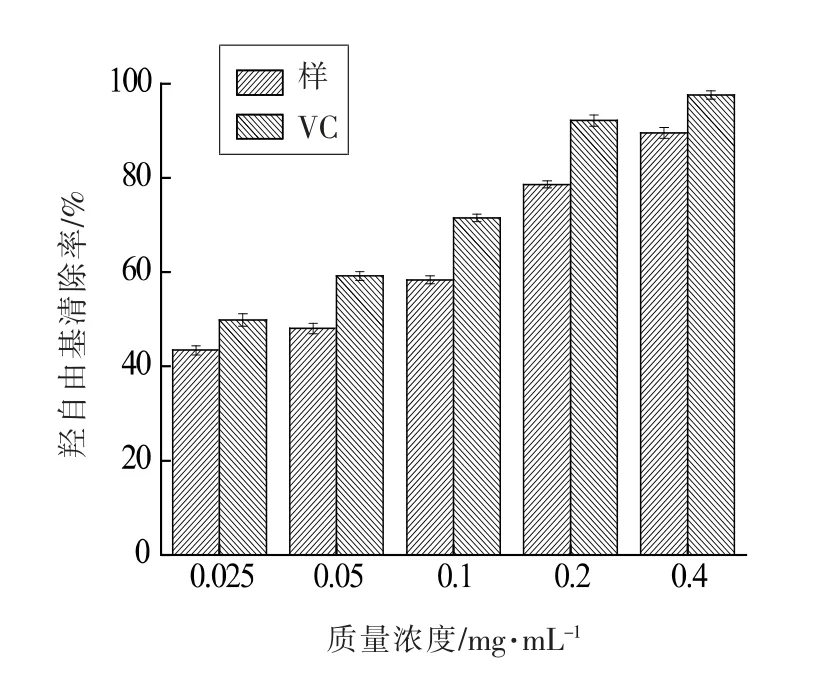
图15 绿豆皮黄酮羟自由基清除效果Fig.15 Hydroxyl radical scavenging effect of flavonoids extracted from phaseolus radiatus hull
3 结论
NKA-9 树脂吸附绿豆皮黄酮的吸附动力学可用Pseudo-second-order 模型较好地拟合(R2>0.99),其中,表观吸附速率常数为K=3.205×10-3g/(mg·min)。 Langmuir 吸附等温线能更好地描述NKA-9 树脂对绿豆皮黄酮的吸附过程(R2>0.99),根据计算结果得到该吸附过程是自然的放热的物理吸附过程。
NKA-9 树脂纯化绿豆皮黄酮物质的最佳动态吸附和解吸条件为:2 BV 质量浓度为0.4 mg/mL的绿豆皮黄酮提取物(pH 3)为上样液,上样流速2 BV/h,用2.3 BV 70%的乙醇溶液(pH 5)以2 BV/h流速洗脱,在此条件下,绿豆皮黄酮的纯度提高2.7 倍,黄酮的回收率提高2.4 倍。
高效液相色谱分析得到的绿豆皮黄酮类化合物主要为牡荆素和异牡荆素, 初步证实了其为绿豆抗氧化的主要成分, 经NKA-9 树脂纯化后,纯度显著提高,证实NKA-9 树脂对绿豆皮黄酮纯化的可行性。
对绿豆皮黄酮的抗氧化研究表明,经NKA-9大孔吸附树脂纯化后, 绿豆皮黄酮有较强的DPPH·、·OH 自由基清除能力。说明绿豆皮黄酮为潜在的抗氧化剂来源, 为后续细胞和动物试验提供一定理论基础。
