乳清组分的波动对牛乳体系及其酶凝胶特性的影响
2019-07-30赵正涛兰海静李全阳
赵正涛 兰海静 李全阳
(广西大学轻工与食品学院 南宁530004)
酪蛋白是牛奶中最重要的成分, 它主要是以酪蛋白胶束的形式均匀分布在牛奶体系中。 虽然对酪蛋白胶束的内部结构仍有争议, 但目前最被认可的模型仍为纳米团簇模型[1]。 在这个模型中,αs-和β-酪蛋白通过胶体磷酸钙连接形成内部结构,κ-酪蛋白存在于酪蛋白胶束表面,提供静电和位阻排斥作用来保证胶体稳定性[2-3]。
牛奶凝胶结构的形成是奶酪及酸乳等产品的前提条件。 要想形成凝胶,则必须要克服κ-酪蛋白固有的斥力作用。在乳制品生产过程中,两种最常见的方法是降低体系的pH 值和加入凝乳酶。凝乳酶是牛胃中发现的一种天门冬氨酸蛋白酶,它可专一性地切割乳中κ-酪蛋白的Phe105-Met106之间的肽键,释放糖巨肽到乳清中,糖巨肽带负电荷并且提供空间作用[4]。糖巨肽的解离导致酪蛋白胶束之间的斥力降低, 当85%到90%的糖巨肽被解离的时候, 酪蛋白通过疏水作用和钙离子的桥联作用结合在一起,形成凝胶结构[5-7]。
凝乳酶凝胶形成可以分为两个过程, 第1 步是糖巨肽的产生释放, 第2 步是酪蛋白胶束的聚集及凝胶结构的形成[4]。凝乳酶和酪蛋白的结合受多种因素的影响。比如,加热过程中变性的乳清蛋白会结合在酪蛋白胶束的表面, 从而降低酶的作用效果并延长凝乳时间[8]。人们还发现降低牛奶的pH 会促进凝乳酶和κ-酪蛋白的结合, 从而加速凝胶过程[9]。此外,研究表明,牛乳乳清组成有时候也能够显著影响酶凝胶结构的形成, 牛奶中添加酪蛋白酸钠会抑制酶凝胶结构的形成[10],然而这是否源自酪蛋白酸钠影响凝乳酶的活性或者酪蛋白胶束结构的解离仍不清楚。另一些情况下,采用超滤技术对牛奶进行浓缩, 增加乳清蛋白的含量并未影响酶凝胶结构的形成过程[11-12]。 除此之外,牛乳乳清的离子组成成分对凝胶过程也有着显著的影响,添加钠离子会降低糖巨肽的解离速度,凝胶结构的形成必须有充足的钙离子才能实现[13]。
酪蛋白凝胶的质量直接关系奶酪和酸乳制品的质量,深入探索其相互作用机制具有重要意义。前述研究绝大部分原料采用复原乳, 在影响作用机理方面也存在探讨的余地, 进一步深入了解乳清组分对酶凝胶结构的形成机理仍有必要。
本文首先通过浓缩技术改变乳清组成, 研究它对酪蛋白胶束特性的影响。 采用流变仪和扩散光谱相结合的方法动态分析不同样品的凝胶结构的形成过程, 阐述牛乳乳清蛋白质和离子对酶凝胶结构形成的机理,为乳品企业改善酸乳、奶酪产品的质量提供理论指导。
1 材料与方法
1.1 材料与试剂
低温巴氏奶购买于加拿大当地的沃尔玛超市,凝乳酶购买于美国丹尼斯克公司。所有的化学试剂均为分析纯。
1.2 仪器与设备
FP-528 杜马斯氮含量分析仪, 美国Leco 公司;Optima TM LE-80K 超速离心机, 美国Beckman 公司;861 高级离子色谱分析仪, 瑞士Metrohm 公司;动态光散射仪,英国Malvern 仪器公司;AR-1000 流变仪,美国TA 仪器公司;扩散光谱,加拿大圭尔夫大学食品学院。
1.3 试验方法
1.3.1 牛奶的浓缩及不同组分乳清样品的制备牛奶采用超滤膜(10ku)进行超滤并浓缩至2 倍(V/V),此过程能保留牛奶中所有的蛋白质,所分离的渗透液仅含离子相及分子质量小于10ku 的小分子物质。
为制备质量分数为1%的酪蛋白酸钠溶液,称取1g 酪蛋白酸钠并溶解在所分离的牛奶渗透液中搅拌至充分溶解。 乳清相的分离采用对牛奶进行高速离心的方法,分离条件为100 000 g,1 h。同超滤膜所得到的渗透液相比, 分离的乳清相中含大量的乳清蛋白(含量约为1%)。将准备好的不同溶液按照体积比1∶1 的比例同所得到的浓缩奶混合并充分搅拌混匀,最后得到的检测样品如下:对照组:浓缩奶+渗透液;样品1:浓缩奶+去离子水;样品2:浓缩奶+含1%酪蛋白酸钠的渗透液;样品3:浓缩奶+乳清相。
1.3.2 乳清和渗透液的分离 乳清相的分离采用超速离心法, 所分离的乳清相中的蛋白质和钙定义为可溶性蛋白质和钙。 为进一步除掉乳清中的蛋白质,乳清相用装有超滤膜(10 ku)的离心管进行离心分离得到渗透液。 渗透液中的钙被定义为可渗透钙。
1.3.3 蛋白质的测定 采用Dumas 燃烧法对牛奶中的总蛋白和可溶性蛋白质进行测定, 蛋白质转换系数为6.38。
1.3.4 钙的测定 将0.5 mL 牛奶样品或乳清相放入Pyrex 试管中,置于马弗炉中,95 ℃加热6 h,然后500 ℃加热8 h。所得到的灰分加入0.5 mL 1 mol/L 的硝酸进行溶解, 并加水稀释到100 倍,然后用离子色谱进行钙浓度测定。具体的测定条件,请参考文献[14]。
1.3.5 粒度分布和Zeta 电位的测定 不同的牛奶样品用其相应的渗透液稀释至1 000 倍, 然后用动态光散射仪和Zeta 电位仪进行测定。
1.3.6 凝乳酶凝胶 牛乳样品采用水浴锅加热并保持在30 ℃, 然后加入0.031 IMCU/mL 的凝乳酶。凝乳过程采用流变仪和扩散光谱进行研究。关于扩散光谱的原理及作用机理请参考文献[4]。
流变仪的测定采用小振幅振动流变进行(应变0.01, 频率1Hz), 凝胶点被定义为弹性模量(G′)超过黏性模量(G″)的点。此外,凝胶过程中浊度(1/l*)的变化及表观粒径的变化采用扩散光谱进行检测, 具体的测量和计算方法见参考文献[4,15]。
2 结果与分析
2.1 各样品的pH、 钙含量和蛋白质含量的测量结果
表1 的结果显示, 各样品之间pH 值无显著差异,均为6.70 左右。 对照样品同添加去离子水的样品具有相同的总蛋白质含量, 而添加了酪蛋白酸钠和乳清的样品具有较高的总蛋白质含量3.50%左右。本研究测量的对照样品的总钙含量为(1 212±52)mg/L,这同以往的报道相一致[16]。 添加乳清相和酪蛋白酸钠并未显著增加样品的总钙含量。 与之相反,添加去离子水后,样品的总钙含量显著降低到(1 082±56)mg/L,这主要是由于可渗透钙的降低而导致。
为证明推断, 进一步测量了各样品的可溶性钙和可渗透性钙含量,结果见图1。 可溶性钙的含量总是比可渗透钙的含量高, 这是由于乳清中的蛋白质分子也具有结合钙的能力。 同对照样品相比较, 添加酪蛋白酸钠和乳清的样品可溶性钙的含量较高, 但二者具有同对照样相同的可渗透钙含量。对于添加去离子水的样品而言,样品具有较低的可溶性钙和可渗透钙, 可渗透钙从(339±8)mg/L 降低到(211±3)mg/L。显而易见,可渗透钙含量的降低是导致总钙含量降低的主要原因。

表1 各样品的pH、总蛋白及总钙含量Table 1 pH, total protein and total calcium concentration for different samples
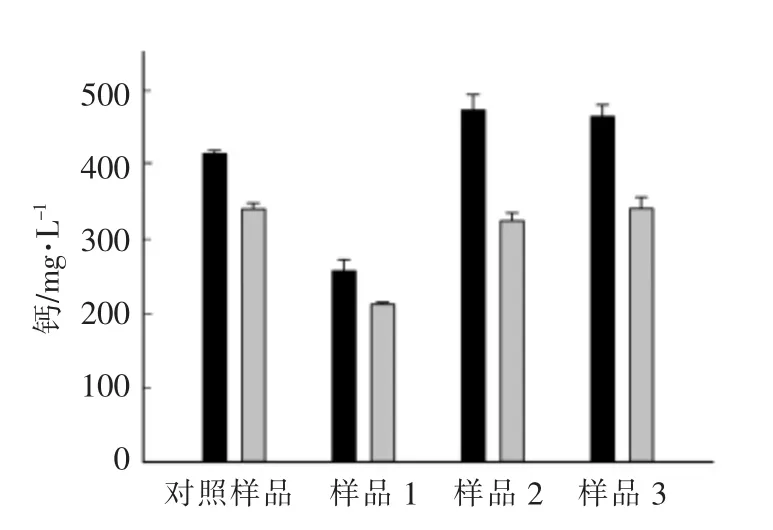
图1 各样品的可溶性钙(黑色柱形图)和可渗透钙(灰色柱形图)含量测定结果Fig.1 Soluble (black bar)and permeable (grey bar)calcium for different samples
2.2 粒度分布和Zeta 电势
牛奶中酪蛋白胶束的大小和表面电荷的多少是牛奶胶体特性的重要影响因素。 表2 的结果显示,对照样品中酪蛋白胶束的平均直径值为(163±2)mg/L。 样品2、3 的结果显示乳清相和酪蛋白酸钠的添加并没有影响酪蛋白胶束的大小。 样品1的结果说明,添加去离子水后,酪蛋白胶束的粒径显著降低到(153±1)nm。 对照样品中的酪蛋白的Zeta 电势值为(-20.4±1)mV,这与以往的研究结果相一致[4]。 添加去离子水后,酪蛋白胶束的Zeta电势值迅速增加到(-33.4±2)mV。 溶液中的离子对酪蛋白表面的负电荷具有屏蔽效果, 添加去离子水后,乳清中的离子强度显著降低,从而降低了对酪蛋白胶束表面的负电荷的屏蔽作用。 酪蛋白表面负电荷的增加增强了酪蛋白胶束间的静电排斥作用,进而导致了酪蛋白胶束结构的收缩。
图2 显示了不同样品的粒度分析图。 样品2的粒度分布图和对照样品完全重叠(看不到黑色三角形标识和曲线),因此认为添加乳清相对酪蛋白的粒度分布无影响。以往的报道显示,牛奶中添加酪蛋白酸钠会导致酪蛋白胶束结构的破坏和解离[17]。 但本研究结果显示,酪蛋白酸钠的添加并未影响酪蛋白胶束的粒度分布和表面的电荷。 这可能是由于添加量或添加方式的不同所导致。 另一方面, 去离子水的添加显著降低了酪蛋白胶束的粒度分布,峰高值向更小的粒径值方向移动。因此本研究发现, 乳清相中蛋白质的增加对酪蛋白的结构无显著影响, 而离子强度的降低能够增加酪蛋白表面的电荷并降低酪蛋白胶束的粒径。
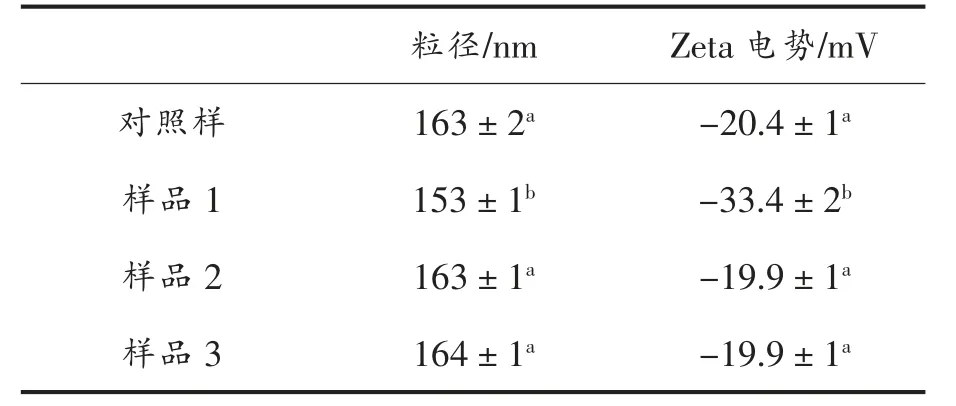
表2 各样品中酪蛋白的平均粒径和Zeta 电势测量结果Table 2 Average diameter and Zeta potential for casein micelles in different samples
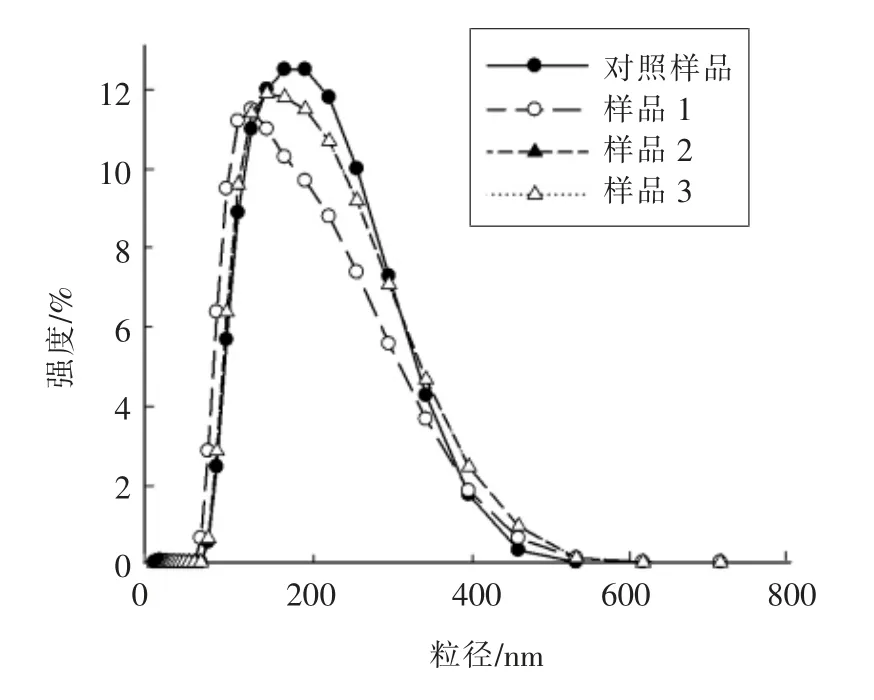
图2 不同样品的酪蛋白胶束粒度分布图Fig.2 Size distributions for casein micelles in different samples
2.3 各样品酶凝胶特性的测定结果
本研究采用流变学特性和光学特性相结合的方法对样品的凝乳酶凝胶过程进行了研究。 流变仪可以测量牛乳凝胶的过程及所形成的凝胶结构的强度。 另一方面,扩散光谱不仅能够测定凝胶结构的形成,并能对酪蛋白的平均粒径变化及酪蛋白胶束的凝集过程进行更加细微的研究,因而二者的结合能够进一步帮助我们研究乳清相中的蛋白质组成及钙含量在凝胶结构形成过程中的作用详情。
2.3.1 流变学特性 图3 为各样品在凝胶过程中弹性模量(G′)及黏性模量(G″)的变化趋势图。很显然,样品的弹性模量及黏性模量随着时间的增加而逐渐增大,黏性模量开始大于弹性模量的点被定义为凝胶点。 此外,tan δ 被定义为黏性模量和弹性模量的比值。 弹性模量的大小可以反映所形成的凝胶结构的强度大小而tan δ 值可以反映凝胶的柔韧性特性[18]。 表3 总结了凝胶形成的时间,凝胶形成45 min 后弹性模量的大小以及所形成的凝胶的tan δ 大小。 对照样品的凝胶时间为(62±3)min,添加乳清后,凝胶时间延长至(71±5)min。 此外,所形成的凝胶强度也从(12±2.0)Pa 降低到(8.5±2.2)Pa。 添加酪蛋白酸钠阻碍了凝胶结构的形成,整个测量过程中,黏性模量一直高于弹性模量。 这表明乳清中蛋白质含量的增加能够阻碍酪蛋白凝乳酶凝胶结构的形成。
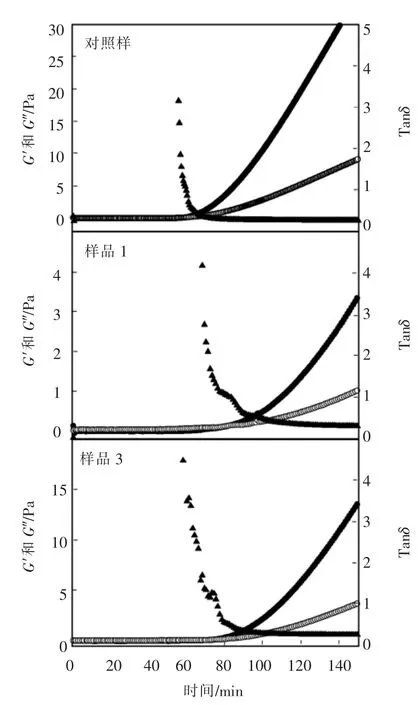
图3 不同样品在凝胶过程中的弹性模量(●)、黏性模量(○)及tan δ(▲)测定结果Fig.3 Development of elastic modulus (●), viscous modulus (○)and tanδ(▲)during rennet gelation process for different samples

表3 各样品的初始浊度值,凝胶时间,弹性模量以及tan δ 测量结果Table 3 Initial turbidity, gelation time, elastic modulus and tan δ for different samples
牛奶中添加去离子水后, 钙离子浓度的降低也显著阻碍了酪蛋白凝胶结构的形成。 凝胶时间延长到(93±8)min,所形成的凝胶强度仅为(1.5±0.4)Pa。 此外,此时的tan δ 值为0.3102±0.010,显著高于其它样品, 表明这时所形成的凝胶具有较高的柔韧性和脱水收缩作用。 这可能是由于钙离子含量的减少, 降低了酪蛋白凝胶结构的桥联作用所导致。
2.3.2 扩散光谱 图4 显示了凝胶形成过程中浊度值(A)和平均粒径(B)的变化趋势。 同对照样品和添加乳清的样品相比, 添加去离子水和酪蛋白酸钠的样品具有较高的初始浊度值(表3),这可能是由于此时样品中具有较高的蛋白质含量。 添加凝乳酶后,所有样品的浊度值(4A)随着时间的增加而逐渐增大,这个结果同以往的报道相一致。浊度值的增加可能是由两个原因所导致, 糖巨肽的释放及酪蛋白分子的聚集。同其它样品相比较,添加酪蛋白酸钠的样品的增加速度较慢。
图4B 总结了各样品在添加凝乳酶后平均粒径的变化。 在初始的20 min 内, 酪蛋白胶束的粒径轻微降低,这是由于κ-酪蛋白的分解及糖巨肽的释放所导致[4]。 随着时间的进一步延长,对照样品的粒径值以最快的速度增加, 然后是添加乳清的样品及添加去离子水的样品。 添加酪蛋白酸钠的样品的粒径值并未随着凝乳时间的延长而增加,表明无凝胶结构的形成。 报道表明,酪蛋白间的聚集主要是通过疏水作用和钙离子的桥联作用而形成[4]。 同对照样品相比较,此时的样品具有相同的钙离子含量。 这表明酪蛋白酸钠对于凝胶结构的阻碍主要是通过影响酪蛋白胶束间的疏水作用。 添加凝乳酶后,酶会水解κ-酪蛋白并释放水溶性的糖巨肽, 这会导致酪蛋白胶束表面疏水结构的暴露, 而添加的酪蛋白酸钠能够迅速与新暴露的疏水基团相结合,从而形成一层新的覆盖层,这个覆盖层则通过静电排斥作用和空间位垒作用阻碍酪蛋白胶束的凝集。此外,钙离子的含量也会显著影响凝胶结构的形成和凝胶强度。 牛乳中存在足够的钙离子(>330 mg/L)是好的凝胶结构形成的必要条件。
3 结论
本研究发现,乳清中的钙离子含量、蛋白质含量及种类都能显著影响酪蛋白胶束的酶凝集过程。 添加酪蛋白酸钠和乳清不会对酪蛋白胶束的胶体特性产生影响。 但是乳清中α-乳白蛋白、β-乳球蛋白和酪蛋白酸钠含量的增加都能显著降低酪蛋白胶束的凝集过程。同乳清中的主要蛋白质β-乳球蛋白和α-乳白蛋白相比,酪蛋白酸钠具有更强的阻碍酪蛋白胶束聚集的能力。 在酶凝胶的过程中, 糖巨肽的释放能够暴露更多的存在于酪蛋白胶束表面的疏水基团, 我们认为酪蛋白酸钠分子能通过疏水作用相结合在酪蛋白胶束表面,从而阻碍凝胶结构的形成。此外,钙离子浓度的降低也会对酪蛋白凝胶结构的形成及特性产生影响。加入去离子水后,牛奶中的钙离子含量降低了约35%,凝胶时间从62 min 显著增加到93 min 且形成的凝胶具有较低的强度(仅为1.5 Pa)。 乳清中足够含量的钙离子浓度(>330 mg/L)是获得较好凝胶结构的必要条件。显而易见,通过调节牛乳体系中乳清蛋白质的含量及钙离子的强度可有效控制体系凝胶的形成和结构特性。 本研究能够对奶酪产品的生产提供一定的理论和技术指导。

图4 不同样品在凝胶形成过程中浊度值(A)和平均粒径(B)的变化测定结果Fig.4 Development of turbidity (A)and average radius (B)during the rennet coagulation process for different samples
