DCE-MRI定量参数全域直方图鉴别诊断乳腺导管原位癌与乳腺导管原位癌伴微浸润
2019-07-30郭宏兵王成瑶崔书君
吴 朋,崔 蕾,郭宏兵,王成瑶,崔书君*
(1.河北北方学院附属第一医院医学影像部,2.乳腺外科,河北 张家口 075000)
乳腺导管原位癌伴微浸润(ductal carcinoma in situ with microinvasion, DCIS-Mi)指乳腺癌细胞突破基底膜进入邻近组织或间质,且侵犯最大直径不超过1 mm[1]。DCIS-Mi是具有转移潜能的肿瘤,若不能早期诊断与治疗,最终可能发展为浸润性导管癌[2]。动态增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)可反映血流微灌注情况,根据血流动力学参数定量分析病变新生血管变化,从而判断病变性质,可用于鉴别诊断乳腺良恶性肿瘤。临床仅根据DCE-MRI形态学难以区分乳腺导管原位癌(ductal carcinoma in situ, DCIS)与DCIS-Mi,而对二者的治疗方法截然不同[3]。全域直方图是一种基于像素分布的图像分析方法,可获得多个反映肿瘤异质性的直方图参数,观察肿瘤微环境改变情况,从而体现肿瘤的生物学特性[4-5]。本研究探讨DCE-MRI血流动力学定量参数全域直方图鉴别诊断乳腺DCIS与DCIS-Mi的价值,旨在提高诊断的准确率。
1 资料与方法
1.1 一般资料 收集2016年10月—2018年9月我院经病理证实的78例单发乳腺癌患者,均为女性,年龄41~69岁,平均(51.3±7.0)岁。纳入标准:①病理诊断为DCIS-Mi或DCIS;②既往无胸部手术史,未接受放化疗等非手术治疗;③3个月内无乳腺穿刺活检史;④常规MR平扫及DCE-MRI资料完整,图像清晰,满足测量和后处理要求;⑤肿瘤内具有直径>3 mm的实性强化成分,符合勾画ROI要求。排除标准:①妊娠期或哺乳期患者;②MR检查禁忌证。根据病理结果将其分为DCIS-Mi组(n=41)和DCIS组 (n=37)。DCIS-Mi组年龄41~69岁,平均(51.7±6.4)岁;DCIS组年龄43~66岁,平均(50.9±7.3)岁。
1.2 仪器与方法 采用Philips Ingenia 3.0T超导型MR扫描仪和四通道乳腺相控阵表面线圈,于月经后1~2周进行检查。嘱患者俯卧,使双侧乳房自然、对称悬垂于线圈内。平扫:TSE序列T1WI,TE 8 ms,TR 400 ms,层厚4 mm,无层间距,FOV 280 mm×340 mm;精确频率反转恢复(spectral presaturation attenuated inversion recovery, SPAIR)序列T2WI:TE 90 ms,TR 3 500 ms,层厚4 mm,无层间距,FOV 250 mm×340 mm。增强扫描前先扫描蒙片,后以高压注射器团注Gd-DTPA,剂量0.1 mmol/kg体质量,流率2.5 ml/s。DCE-MRI参数:轴位高分辨力各向同性容积激发多期动态增强扫描(enhanced T1 high resolution isotropic volume examination, eTHRIVE)序列脂肪抑制T1WI,最短TE,最短TR,翻转角12°,FOV 280 mm×340 mm,层厚1 mm,无间隔扫描150层,共扫描11个时相(蒙片为第1个时相),每个时相采集55 s,扫描时间9 min 20 s。
1.3 图像后处理及分析 将动态增强数据上传至EWS 2.6.3.5后处理工作站,采用Omni-Kinetics软件进行图像后处理。首先绘制时间-信号曲线;然后参考T2WI确定病变位置,选择病变增强最明显时相,于每层图像肿块实质强化最明显处沿病变边缘手动勾画ROI,尽量避开血管、脂肪、出血和坏死组织;软件自动生成肿瘤3D容积ROI。选取病灶同侧胸大肌为参照物获得动脉输入函数,采用Reference Pharmacokinetic Model模型,自动生成以下参数的直方图,即容积转运常数(Ktrans)、速率常数(Kep)及血浆容积分数(Vp),依次记录每个参数的全部直方图参数,包括平均值、中位数及10%、25%、50%、75%和90%分位数(表示为P10、P25、P50、P75、P90),测量3次取平均值。获得各参数伪彩图,红色代表高强化,蓝色代表强化较低,黄色介于两者之间,正常腺体呈均匀蓝色。由2名主治医师医师分别进行测量。
1.4 统计学分析 采用SPSS 25.0和MedCalc 15.2.2统计分析软件。符合正态分布的计量资料以±s表示,2组间比较采用两独立样本t检验;偏态分布数据以中位数(上下四分位数)表示,2组间比较采用Mann-WhitneyU检验。采用组内相关系数(interclass correlation coefficient, ICC)评价2名医师测量结果的一致性,ICC>0.75为一致性较好。以病理结果为金标准,采用多因素Logistic回归模型确定诊断DCIS-Mi最佳变量。绘制ROC曲线,评价最佳变量对DCIS-Mi的诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 MRI征象 DCIS-Mi主要表现非肿块样强化,段样分布为主,部分为区域分布,边缘不清晰,内部多呈不均匀或簇环状强化,Ktrans图显示为不均匀红色病灶,Kep、Vp图显示为以红、黄、蓝色为主的混杂色病灶(图1)。DCIS主要表现非肿块样强化,局灶或线样分布为主,边界不清,内部呈均匀或不均匀强化,Ktrans、Kep及Vp图均呈混杂色病灶(图2)。
2.2 MRI直方图参数 2名医师测量直方图各参数的一致性均较好(ICC均>0.75)。DCIS-Mi组Ktrans参数中平均值及各百分位数,Kep参数中的平均值、中位数、P50、P75、P90,Vp参数中的平均值、中位数、P25、P50及P75均高于DCIS组(P均<0.05,表1)。
2.3 最佳参数及诊断效能Logistic回归结果显示,Ktrans平均值、Ktrans-P25、Ktrans-P50、Ktrans-P75、Ktrans-P90、Kep-P50、Kep-P75、Kep-P90、Vp平均值、Vp-P75为诊断DCIS-Mi的最佳变量(表2),其诊断DCIS-Mi的ROC曲线结果见表3、图3。Logistic方程为:Logit(P)=-2.652+1.785Ktrans平均值+3.612Ktrans-P25+3.041Ktrans-P50+1.281Ktrans-P75+1.842Ktrans-P90+11.657Kep-P50+17.545Kep-P75+14.563Kep-P90+3.925 Vp平均值+14.092 Vp-P75;对上述回归模型进行似然比检查,模型具有统计学意义(χ2=21.425,P<0.001),模型数据拟合度较好(拟合优度检验χ2=1.325,P=0.970)。ROC曲线结果显示Logistic回归模型的AUC为0.968(P<0.05),其临界值、敏感度和特异度分别为2.152、0.962和0.947。

表1 DCIS-Mi组与DCIS组各直方图定量参数比较[中位数(上下四分位数)]

图1 患者56岁,DCIS-Mi A.增强T1WI示左侧乳腺非肿块样强化(图中红色代表全域勾画ROI),呈节段分布; B.Ktrans图示病灶呈不均匀红色; C、D.分别为Kep图和Vp图,病灶呈红、黄、蓝为主混杂颜色; E~G.分别为Ktrans、Kep及Vp参数直方图,呈右偏趋势,提示肿瘤区血管增生旺盛区域所占比重较高

表2 多因素Logistic回归分析结果

表3 直方图各参数鉴别诊断DCIS-Mi和DCIS效能的ROC曲线结果
3 讨论
DCIS-Mi和DCIS均为乳腺癌早期病变, DCE-MRI多表现为非肿块样强化,形态学表现多有重叠,难以进行诊断和鉴别诊断[6]。DCE-MRI定量参数Ktrans、Kep、Vp不仅能反映组织的血流灌注和血管通透性,还能反映肿瘤空间和时间上微环境改变,对诊断和鉴别诊断具有重要价值[7]。DCE-MRI定量参数全域直方图分析法是一种全容积、多参数分析法,不仅能计算肿瘤整体平均值、中位数,还可分析瘤体内多个百分位数分布情况,能在一定程度上反映肿瘤血管的分布趋势和分布状态,减少采样偏差的影响,提高测量可重复性[8]。
定量参数直方图法用于DCIS-Mi和DCIS的研究报道较少。本研究选用Reference Pharmacokinetic
Model模型,以同侧胸大肌为参照物,通过后处理软件自动生成ROI全域定量参数,并以直方图分析方法鉴别DCIS-Mi和DCIS,其优势在于胸大肌紧邻乳腺,体积大而均匀,不存在流动效应和搏动伪影[9]。本研究DCIS-Mi组Ktrans平均值及各百分位数、Kep中位数、Kep平均值、Kep-P50、Kep-P75、Kep-P90均大于DCIS组(P均<0.05),表明DCIS瘤体内血管少于DCIS-Mi,血管内皮细胞连接相对紧密,同时基底膜完整,血管保持正常通透性,对比剂灌注缓慢,导致对比剂交换受阻,故上述值均降低。DCIS-Mi不成熟新生毛细血管增多,微血管密度增加,同时血管壁较薄,血管内皮连接松散,平滑肌不完整,导致通透性增高,使对比剂从新生血管扩散到血管外细胞外间隙增快,对比剂交换增多、速度加快,而从血管外间隙重新回到血管内的速度亦加快,故上述值均增高。Li等[10]认为乳腺恶性肿瘤Ktrans、Kep高于良性肿瘤,尤以P25、P50、P75、P90更为明显。本研究发现DCIS-Mi与DCIS组间Ktrans中位数差异无统计学意义(P=0.051),可能是由于2组总体样本中位数较为接近;同时Kep-P10和Kep-P25差异亦无统计学差异(P均>0.05),可能因对比剂快速从血管外间隙回到血管腔内具有重叠性,随后DCIS出现“饱和”状态,回流缓慢。本研究DCIS-Mi组Vp中位数、平均值及P25、P50、P75均高于DCIS组,其机制为DCIS-Mi肿瘤内血管增多,对比剂灌注增多,使Vp增高。
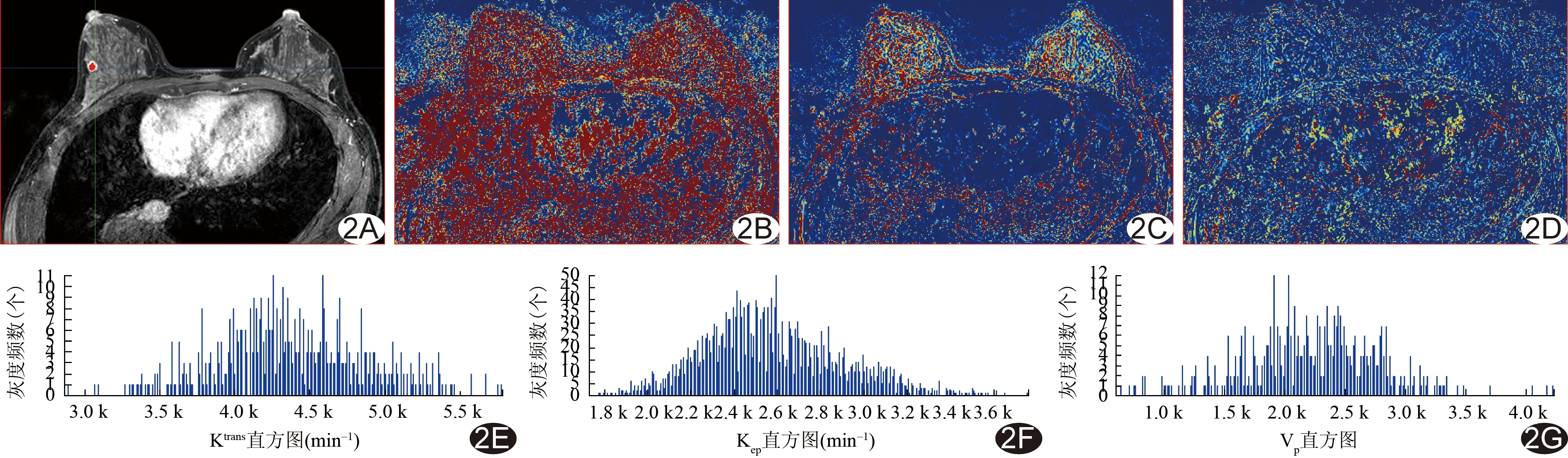
图2 患者47岁,DCIS A.增强T1WI示右侧乳腺非肿块样强化(图中红色代表全域勾画ROI),呈局灶样分布; B.Ktrans图示病灶呈均匀红色; C、D.分别为Kep图和Vp图,病灶呈红、黄、蓝为主混杂颜色; E~G.分别为Ktrans、Kep及Vp参数直方图,呈正态分布,提示肿瘤区血管生长缓慢

图3 各直方图参数的ROC曲线 A.Ktrans参数; B.Kep参数; C.Vp参数
本研究通过Logistic回归分析筛选出10个鉴别诊断DCIS-Mi的最佳变量,在Ktrans参数中,Ktrans-P75的AUC最大(0.854),提示75%像素点灰度参数值反映血流灌注和肿瘤异质性的效能优于平均值和其他百分位数值,原因是高百分位数值的大小主要取决于病灶内高渗透性的肿瘤组织成分,低百分位数值则主要取决于病灶内低渗透性的非肿瘤组织成分,而平均值反映肿瘤内的异质性的能力较差,因此DCIS-Mi和DCIS的高百分位数值差异更大,对DCIS-Mi诊断效能更高。在Kep参数中,Kep-P75和Kep-P90的AUC值、敏感度和特异度大于Kep-P50,表明75%、90%像素点的参数值诊断价值高于50%,反映DCIS-Mi肿瘤细胞生长旺盛,通透性增高,速率增高,对比剂交换增多,与肿瘤侵袭性密切相关。Vp为血浆内对比剂占整个体素的容积分数,反映每单位体积组织血管外细胞外间隙及血管的容积大小,与微血管数量、血管分布情况及通透性相关,本研究显示Vp-P75和Vp平均值的诊断价值均较高,Vp-P75的AUC值更大,表明癌组织微血管数量较多,血管分布非常不均匀,血管生成旺盛区域占整个癌组织中容积比例较高。此外,本研究确立的联合变量Logistic回归模型具有最高AUC(0.968),诊断效能明显高于单个变量,能更准确全面地反映DCIS-Mi微循环特点,包括微血管密度、血流灌注、血管通透性、血管内外对比剂交换速率及血管外细胞外间隙等。
综上所述,通过DCE-MRI全域直方图分析能更全面地反映肿瘤特征,具有客观、可量化、可重复性好、误差小的优势,对诊断及鉴别诊断乳腺DCIS-Mi和DCIS具有较高效能。
