机械应力失衡对大鼠软骨及软骨下骨的影响
2019-07-29刘静孙智路周君周桂娟钟培瑞成果王甜甜邓程远廖瑛
刘静 孙智路 周君 周桂娟 钟培瑞 成果 王甜甜 邓程远 廖瑛
【摘 要】目的:观察关节内韧带切断后的关节不稳导致的机械应力改变引起的大鼠膝骨关节炎的关节软骨及软骨下骨的病理变化,为明确机械应力失衡在骨关节炎致病中的重要作用提供依据。方法:将30只3月龄Sprague-Dawley雄性大鼠随机分为对照组和模型组,每组15只。其中模型组手术切断前后交叉韧带、内侧副韧带,术后12周,眼眶取血,颈椎脱臼法处死实验大鼠,对各组大鼠行关节软骨的组织形态学观察及Mankin评分,对软骨下骨Micro-CT及骨组织显微结构进行定量分析。采用血清酶联免疫吸附法检测白细胞介素(IL)-1、IL-6、抗酒石酸酸性磷酸酶(TRACP-5b)、骨源性碱性磷酸酶(BALP)、Ⅱ型胶原C端肽(CTX-Ⅱ)水平。结果:①模型组关节软骨层变薄,软骨表面破损,部分软骨细胞核固缩,潮线紊乱,甲苯胺蓝染色减少。模型组Mankin評分较对照组明显增高,差异有统计学意义(P < 0.01)。②与对照组比较,模型组骨体积分数、骨小梁数量、骨小梁厚度显著降低,骨小梁分离度显著增高,差异有统计学意义(P < 0.05或P < 0.01)。③模型组血清IL-1、IL-6、TRACP-5b、BALP、CTX-Ⅱ水平较对照组均显著增高,差异有统计学意义(P < 0.01)。结论:采用前后交叉韧带、内侧副韧带切断,可以成功复制膝骨关节炎模型,模拟临床膝骨关节炎的病理变化,关节不稳所致的机械应力失衡是导致创伤性骨关节炎的重要因素。
【关键词】 骨关节炎,膝;机械应力;关节不稳;软骨;软骨下骨;大鼠
【ABSTRACT】Objective:To observe the pathological changes of articular cartilage and subchondral bone in rats with knee osteoarthritis caused by mechanical stress changes due to instability of intra-articular ligament after ligament transection,and to provide evidence for clarifying the important role of mechanical stress imbalance in the pathogenesis of osteoarthritis.Methods:Thirty three-month-old Sprague-Dawley male rats were randomly divided into a control group and a model group,with 15 rats in each group.In the model group,the anterior and posterior cruciate ligaments and medial collateral ligaments were cut off.Twelve weeks after operation,orbital blood was collected and cervical dislocation was used to kill the experimental rats.Histopathological observation and Mankin score were made for articular cartilage of each group.Micro-CT of subchondral bone and quantitative analysis of bone microstructure were also made.Levels of IL-1,IL-6,TRACP-5b,BALP and CTX-Ⅱ were measured by enzyme-linked immunosorbent assay.Results:①In model group,the articular cartilage layer became thinner,the surface of cartilage was damaged,some chondrocyte nuclei were pyknosis,tidal line was disordered,and toluidine blue staining was decreased.The Mankin score of the model group was significantly higher than that of the control group(P < 0.01),the difference being statistically significant.②Compared with the control group,the bone volume fraction,trabecular number,and trabecular thickness obviously decreased and trabecular segregation decreased significantly in the model group,and the difference was statistically significant(P < 0.05 or P < 0.01).③The levels of IL-1,IL-6,TRACP-5B,BALP and CTX-Ⅱ in the model group were significantly higher than those in the control group(P < 0.01).Conclusion:By cutting the anterior and posterior cruciate ligaments and medial collateral ligaments,the model of knee osteoarthritis can be successfully reproduced and he pathological changes of clinical knee osteoarthritis can be simulated.The mechanical stress imbalance caused by joint instability is an important factor leading to traumatic osteoarthritis.
【Keywords】 osteoarthritis,knee;mechanical stress;joint instability;cartilage;subchondral bone;rats
骨关节炎(osteoarthritis,OA)是一种以关节软骨退变为核心,累及软骨下骨、滑膜、关节囊及关节周围软组织的慢性进展性骨关节疾病[1]。据统计,随着人口老龄化进程,全球OA发病率高达4%~13%[2],美国平均每年因OA而花费的医疗费用约2654亿美元[3]。目前,OA治疗效果有限,且具有高发病率、高致残率、高耗费的特点,所以研究OA的病理过程及影响因素,从机制上寻求防治方案至关重要,理想的实验动物模型的建立与选择是研究OA发病机制及防治措施的必要手段。本研究采用关节内韧带切断导致大鼠膝关节不稳,模拟OA受机械应力改变刺激,观察膝骨关节的软骨及软骨下骨的改变,阐明机械应力失衡在KOA发生发展过程中的重要作用。
1 实验材料
1.1 实验动物 3月龄雄性Sprague-Dawley大鼠30只,由南华大学实验动物中心提供,许可证号:SYXK(湘)2015-0001。饲养环境:温度22~26 ℃,湿度50%~60%,12 h间隔照明,自由饮水及进食。
1.2 实验试剂 白细胞介素(IL)-1、IL-6[艾博抗(上海)贸易有限公司,生产批号分别为ab100768、ab100772];骨源性碱性磷酸酶(BALP)、抗酒石酸酸性磷酸酶(TRACP-5b)(武汉优尔生商贸有限公司,生产批号分别为SEB091Ra、SEA902Ra);Ⅱ型胶原C端肽(CTX-Ⅱ)酶联免疫吸附(ELISA)法试剂盒(广州皓跃生物科技有限公司,生产批号7E2B2C3);光学显微镜(日本奥林巴斯公司);微型离心机(BMJ,BMJ0826);Micro-CT(广州中科恺盛医疗科技有限公司)。
2 方 法
2.1 分组与造模 适应性饲养1周后,按照随机数字表法将30只大鼠随机分为对照组和模型组,每组15只。所有大鼠采用质量分数为10%的水合氯醛以0.3 mL·(100 g)-1剂量腹腔注射麻醉,模型组采用关節内韧带切断进行动物造模:于双膝关节内侧做皮肤切口,打开关节囊,切断前后交叉韧带及内侧副韧带,彻底止血,逐层缝合,常规消毒包扎。对照组仅切开双膝关节内侧皮肤,不打开关节囊,表皮缝合。术后允许大鼠自由活动。实验过程中大鼠处置严格遵守动物福利与伦理准则和指南的相关规定。
2.2 标本采集及检测指标 术后12周,采用质量分数为10%的水合氯醛以0.3 mL·(100 g)-1剂量对所有大鼠腹腔注射麻醉。
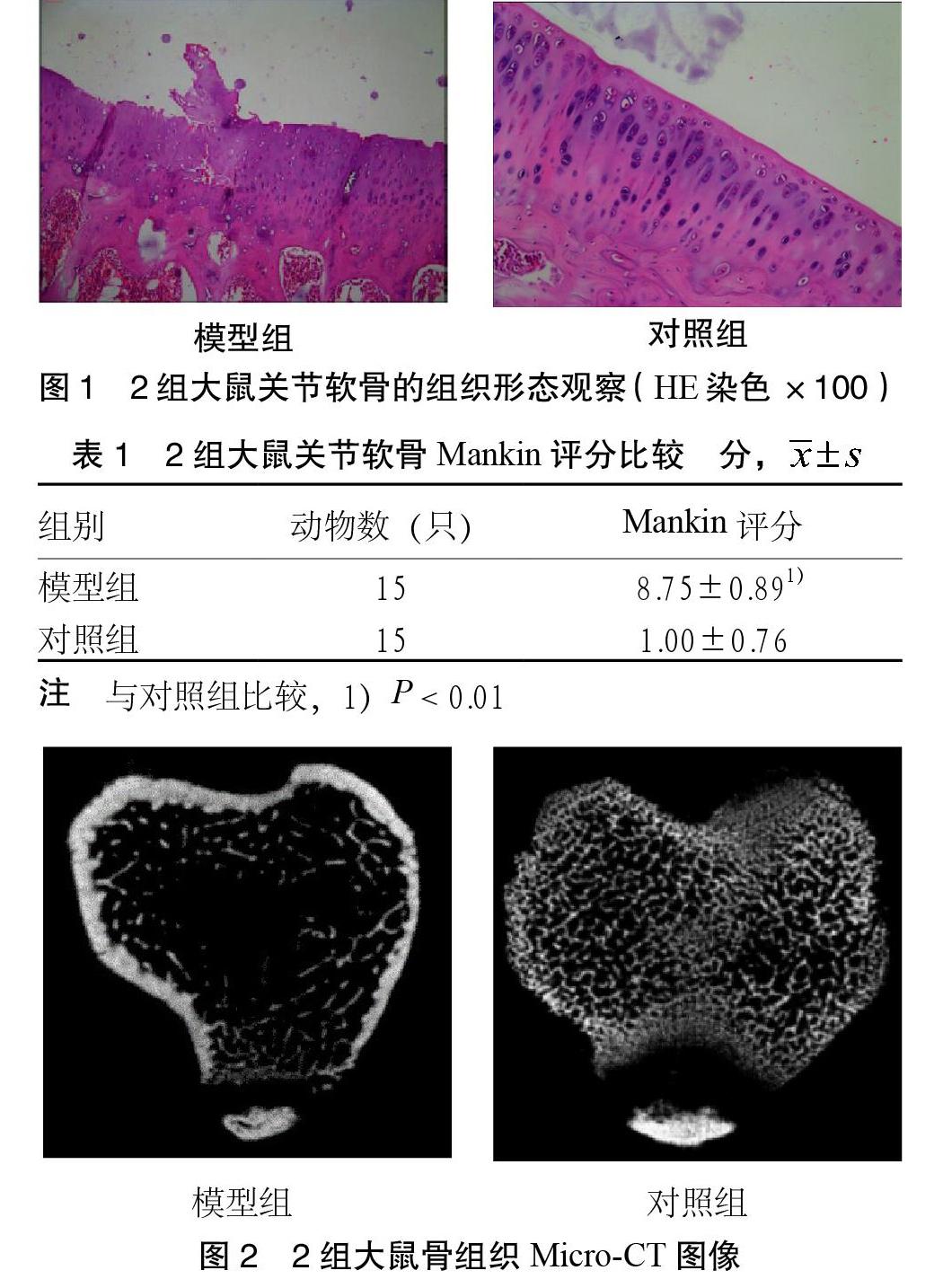
2.2.1 关节软骨组织形态学观察及Mankin评分 颈椎脱臼法处死实验大鼠,取左侧胫骨粗略观察外观,固定于质量分数为4%的多聚甲醛中,进行脱钙、脱水、浸蜡包埋、切片、HE染色,显微镜下观察各组关节软骨的组织形态改变,并进行Mankin评分。Mankin评分细则[4]如下:软骨结构(0分,正常;1分,表面不规则;2分,血管翳形成和表面不规则;3分,裂隙进入过渡层;4分,裂隙进入辐射层;5分,裂隙进入钙化层;6分,结构完全破坏)。软骨细胞(0分,正常;1分,弥漫性细胞过多;2分,局部细胞过多;3分,细胞过少)。软骨基质染色(0分,正常;1分,轻度减少;2分,中度减少;3分,重度减少;4分,未着色)。潮线完整性(0分,完整;1分,被血管破坏)。得分越高病变程度越重。观察过程均在病理学专家指导下完成。
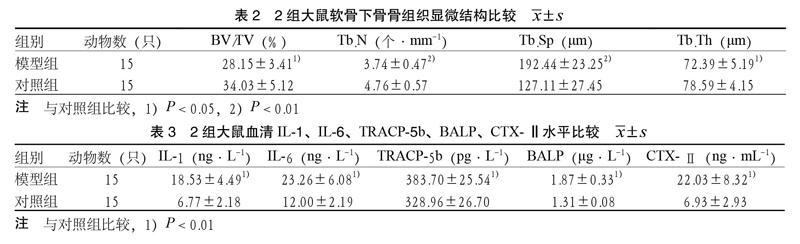
2.2.2 Micro-CT及骨组织显微结构分析 取右侧胫骨近端,置于40 g·L-1多聚甲醛中固定,后放置于Micro-CT的检测工作槽中。Micro-CT的扫描参数:旋转角保持220°,增量0.6°,分辨率为45.0 μm,曝光时间为3000 ms,每层的具体间距为16 μm。每个标本可获取约200张图像。并对软骨下骨骨组织进行定量分析,分析参数:骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)。
2.2.3 血清IL-1、IL-6、TRACP-5b、BALP、CTX-Ⅱ测定 眼眶取血,采用ELISA试剂盒,严格按照说明书操作,测定血清IL-1、IL-6、TRACP-5b、BALP、CTX-Ⅱ水平。
2.3 统计学方法 采用SPSS 18.0软件进行统计分析。计量资料以表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
3 结 果
3.1 关节软骨的组织形态学观察及Mankin评分 对照组软骨表面光整,软骨四层结构清晰可辨,软骨细胞排列有序,基质染色均匀。模型组关节软骨层变薄,软骨表面破损,部分软骨细胞核固缩,潮线紊乱。模型组Mankin评分较对照组明显增高,差异有统计学意义(P < 0.01)。见图1、表1。
3.2 Micro-CT及骨组织显微结构比较 与对照组比较,模型组BV/TV、Tb.N、Tb.Th显著降低,Tb.Sp显著增高,差异有统计学意义(P < 0.05或P < 0.01)。见图2、表2。
3.3 2组血清IL-1、IL-6、TRACP-5b、BALP、CTX-Ⅱ水平比较 模型组血清IL-1、IL-6、TRACP-5b、BALP、CTX-Ⅱ水平均较对照组显著增高,差异有统计学意义(P < 0.01)。见表3。
4 讨 论
膝骨关节炎(knee osteoarthritis,KOA)是一种慢性退行性疾病,发病机制尚未明确,其发病及进展由雌激素、衰老、炎症因子、创伤、局部生物力学异常等多种因素共同作用引起[5]。研究结果显示,软骨、软骨下骨、半月板之间的应力失衡伴随着KOA发生、发展的全程[6]。膝关节的稳定除了依赖胫股关节面的骨性构造以外,还有赖于前、后交叉韧带,内、外侧副韧带的制约以及拮抗肌的力量均衡[7]。在膝关节的力学平衡中,韧带作为力的承受和传递组织发挥重要作用。有学者发现,韧带切断后软骨损伤发生率明显增高,损伤程度随着病程延长而加重,而韧带的修复可减缓软骨的退变,并减轻软骨细胞的凋亡[8]。研究表明,膝关节内收力矩每增加1°,KOA的病情进展加快6倍[9]。一项荟萃分析显示,纠正异常生物力学的方法如韧带修复、膝关节矫形器等均可以明显降低或延缓KOA的发生和发展[10]。关节软骨在不平衡的机械应力刺激下,将力学信号转化为细胞生物学信号,促进细胞表型基因的表达、蛋白质的合成、细胞外基质的代谢等,并最终导致OA的发生[11]。OA软骨下骨压力相关基因的高表达,引起骨量的重新分配和骨结构的重新安排,证实了机械应力是OA的致病因素,并有可能成为OA的早期干预靶点[12]。
前交叉韧带切断是OA常用的造模方法,能模拟OA的病理变化过程,但对手术者解剖知识掌握要求较高。Hulth法切除内侧半月板加内侧副韧带、前交叉韧带形成膝关节不稳,从而诱发OA改变,成模效果显著;但关节结构损伤严重,且半月板切除过程中有破坏软骨可能,影响模型的可靠性和稳定性[13]。
早期诊断是治疗OA的关键,随着分子生物学的不断发展,大量研究表明,OA患者血清中的細胞因子如IL-1[14]、IL-6[15]及特异性生物标志物CTX-Ⅱ[16]、TRACP-5b、BALP[17]等可早于组织学改变,及时反映OA的病理变化,并与OA的严重程度呈正比,对OA的早期诊断及疗效评估具有重要意义。
本研究采用前后交叉韧带及内侧副韧带切断,导致关节内机械应力不均衡,同时改变了关节的力学轴线,形成软骨退变的起始环节。与对照组比较,模型组膝关节软骨HE染色显示关节软骨层变薄,软骨表面破损,部分软骨细胞核固缩,潮线紊乱,具有较高的Mankin评分。细胞外基质的代谢产物CTX-Ⅱ及炎症指标IL-1、IL-6水平明显升高,提示关节软骨出现退变、细胞外基质降解、炎症反应存在,符合OA的典型病理改变[18]。
在OA的发展过程中,早期骨吸收大于骨形成,局部骨质疏松,为代偿生物力学性能下降,软骨下骨反应性增生;随着疾病的进展,软骨下骨出现明显的软骨下骨硬化、骨赘形成[19]。本研究发现,模型组血清BALP、TRACP-5b水平明显高于对照组,而骨组织显微结构定量分析显示,模型组大鼠骨组织的BV/TV、Tb.N、Tb.Th显著降低,Tb.Sp明显增高(P < 0.01)。说明模型组Tb.N及连接密度下降,分离度增加,存在骨质疏松现象,Micro-CT图像也直观地反映出模型组软骨下骨骨小梁稀疏,排列紊乱。提示关节内韧带切断12周后实验大鼠成骨细胞、破骨细胞活性增强,骨转化加快,此时骨吸收大于骨形成,局部骨质疏松,处于OA的早期阶段。
综上所述,以前后交叉韧带及内侧副韧带切断能建立稳定的、理想的大鼠KOA模型,展现出与人OA相似的病理过程,且造模过程简单,易操作,值得进一步研究应用。
5 参考文献
[1] LIU SH,DRIBAN JB,EATON CB,et al.Objectively measured physical activity and symptoms change in knee osteoarthritis[J].Am J Med,2016,129(5):497-505.
[2] FRANK M,BWEMERO J,KALUNGA D,et al.OA60 Public health and palliative care mix;a ccpmedicine approach to reverse the overgrowing burden of non-communicable diseases in Tanzania[J].BMJ Support Palliat Care,2015,5(1):A19.
[3] YELIN E,WEINSTEIN S,KING T.The burden of musculoskeletal diseases in the United States[J].Semin Arthritis Rheum,2016,46(3):259-260.
[4] MANKIN HJ,DORFMAN H,LIPPIELLO L,et al.Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips.II.Correlation of morphology with biochemical and metabolic data[J].J Bone Joint Surg Am,1971,53(3):523-537.
[5] ADATIA A,RAINSFORD KD,KEAN WF.Osteo-
arthritis of the knee and hip.Part I:aetiology and pathogenesis as a basis for pharmacotherapy[J].J Pharm Pharmacol,2012,64(5):617-625.
[6] SAXBY DJ,LLOYD DG.Osteoarthritis year in review 2016:mechanics[J].Osteoarthritis Cartilage,2017,25(2):190-198.
[7] SHARMA L,DUNLOP DD,CAHUE S,et al.Quadriceps strength and osteoarthritis progression in malaligned and lax knees[J].Ann Intern Med,2003,138(8):613-619.
[8] NEBELUNG W,WUSCHECH H.Thirty-five years follow-up of anterior cruciate ligament-deficient in high-level athletes[J].Arthroscopy,2005,22(6):696-702.
[9] SHULL PB,LURIE KL,CUTKOSKY MR,et al.Training multi-parameter gaits to reduce the knee adduction moment with data-driven models and haptic feedback[J].J Biomech,2011,44(8):1605-1609.
[10] VAN TUNEN JA,DELL'ISOLA A,JUHL C,et al.Biomechanical factors associated with the development of tibiofemoral knee osteoarthritis:protocol for a systematic review and meta-analysis[J].BMJ Open,2016,6(6):e011066.
[11] VARADY NH,GRODZINSKY AJ.Osteoarthritis year in review 2015:mechanics[J].Osteoarthritis Cartilage,2016,24(1):27-35.
[12] 張荣凯,李国威,张大卫,等.机械应力改变致印度豪猪蛋白在早期骨关节炎软骨下骨的表达[J].中华医学杂志,2017,97(1):53-56.
[13] ZHOU X,ZHANG L,GUO X,et al.A Macaca Fascicularis Knee Osteoarthritis Model Developed by Modified Hulth Combined with Joint Scratches[J].Med Sci Monit,2018,24:3393-3404.
[14] SHEN S,GUO J,LUO Y,et al.Functional proteomics revealed IL-1β amplifies TNF downstream protein signals in human synoviocytes in a TNF-independent manner[J].Biochem Biophys Res Commun,2014,450(1):538-544.
[15] ZAFAR R,NAHID A,TARIQ MH.Advanced glycation end products induce the expression of interleukin-6 and interleukin-8 by receptor for advanced glycation end product-mediated activation of mitogen-activated protein kinases and nuclear factor-κB in human osteoarthritis chondrocytes[J].Rheumatology,2011,50(5):838-851.
[16] HUEBNER JL,WILLIAMS JM,DEBERG M,et al.
Collagen fibril disruption occurs early in primary guinea pig knee osteoarthritis[J].Osteoarthritis Cartilage,2010,18(3):397-405.
[17] SOLLAZZO V,PALMIERI A,PEZZETTI F,et al.Effects of Pulsed Electromagnetic Fields on Human Osteoblastlike Cells(MG-63):a pilot study[J].Clin Orthop Relat Res,2010,468(8):2260-2277.
[18] THOMAS S,BROWNE H,MOBASHERI A,et al.What is the evidence for a role for diet and nutrition in osteoarthritis?[J].Rheumatology (Oxford),2018,57(Suppl 4):iv61-iv74.
[19] BURR DB,GALLANT MA.Bone remodelling in osteoarthritis[J].Nat Rev Rheumatol,2012,8(11):665-673.
收稿日期:2019-01-12;修回日期:2019-04-25
