绿豆芽保鲜与细胞壁自溶机理分析
2019-07-29方良月
方良月,肖 潇,傅 亮
(暨南大学 理工学院,食品科学与工程系,广州 510632)
绿豆芽富含蛋白质、碳水化合物、矿物质及维生素等营养物质,还含有多种生物活性成分,如类黄酮和酚酸等[1-2],具有一定的解毒、抗炎、降胆固醇及利尿功能[3]。近年来,绿豆芽以口感好、价格便宜等优点,在蔬菜市场上销量呈快速上升趋势。目前,绿豆芽已从作坊式转入规模化工业生产,出现了大量日产50t~500t的工厂[4]。绿豆芽极其脆嫩,且自身代谢快,常温下贮存期极短,从出菜到销售,若处理不当就会造成腐烂变质,极大地降低产品的安全性和商品价值。研究方便、低成本及安全的绿豆芽保鲜技术是有力推动绿豆芽产业良性发展的重要基础。
目前,工业上绿豆芽保鲜主要采用冷藏法。另有研究者通过其他技术路线尝试探讨绿豆芽的保鲜技术,如罗欣等[5]通过丙酸杆菌素清洗绿豆芽,使4℃冷藏条件下绿豆芽的保鲜期较对照延长了2d。王瀚博[6]利用UV-B辐照处理发芽60h的绿豆芽,发现适当的UV-B处理可有效降低失水率,有利于绿豆芽保鲜。Sikora等[7]采用抗坏血酸溶液浸泡绿豆芽,显著降低绿豆芽中多酚氧化酶的活性,改善了贮藏过程中绿豆芽的消费品质。阿魏酸是一种天然安全的具有清除自由基及调节细胞防御机制的酚酸[8],此外还有保护心脏[9]、治疗糖尿病[10]等一系列潜在的作用,有研究发现阿魏酸与纤维素酶混合孵育时能抑制纤维素酶活性[11];乙二胺四乙酸二钠(EDTA)是金属螯合剂,可螯合酶的活性位点,使酶失活[12],Li等[13]研究猕猴桃中分离纯化的多聚半乳糖醛酸酶活性时,发现EDTA浓度高于2mmol·L-1时,该酶活受到抑制。目前,关于绿豆芽贮藏保鲜与细胞壁水解酶的关系也鲜见报道。本试验通过不同温度贮藏绿豆芽,比较贮藏过程中绿豆芽新鲜状态、理化指标的差异及下胚轴微观结构的变化,分析绿豆芽腐烂与其下胚轴细胞壁自溶的关系。在此基础上采用阿魏酸和EDTA作为酶抑制剂处理绿豆芽,探究抑制绿豆芽细胞壁水解酶活性对其保鲜的影响,以期为绿豆芽的有效保鲜提供理论基础。
1 材料与方法
1.1 试验材料
试验所用绿豆芽源于实验室豆芽机制作:挑选颗粒饱满的绿豆,蒸馏水清洗除杂后,置于ψ=1%次氯酸钠水溶液中消毒浸泡15 min,用蒸馏水反复冲洗3次后,放入蒸馏水中浸泡6 h,于豆芽机中避光发芽96 h后采收。
1.2 试验设计与处理
1.2.1 不同温度贮藏绿豆芽保鲜试验 称取每份250 g新鲜绿豆芽,装于密封保鲜袋中,分别置于4 ℃、10 ℃、20 ℃、25 ℃及30 ℃的恒温培养箱中避光贮藏(每组3个平行),每隔12 h取样测定各项生理生化指标。
1.2.2 酶抑制剂处理绿豆芽贮藏保鲜试验 根据保鲜预试验及感官评定结果进行保鲜效果的初步优化,确定阿魏酸及EDTA作为酶抑制剂处理绿豆芽的质量浓度均为0.1 g·L-1。称取250 g新鲜绿豆芽,分别置于溶解有阿魏酸、EDTA的 2 L水溶液中浸泡30 min,取出后用2 L蒸馏水清洗两遍,吸水纸吸干表面水分,以蒸馏水中进行相同处理作对照(CK),分别装入密封保鲜袋中25 ℃避光贮藏(每组3个平行),每隔12 h测定纤维素酶活性、果胶酶活性及感官评分,并观察贮藏48 h时下胚轴的微观结构。
1.3 测定指标与方法
感官评价:参照文献[14-15],由10名食品专业人员组成的评定小组,综合评价绿豆芽贮藏过程中子叶颜色、根部颜色、气味及下胚轴颜色、出水程度、软化程度等状态,评价标准如表1。
pH测定:称取2 g绿豆芽,加入5 mL蒸馏水研磨, 4 ℃、12 000 × g离心10 min,收集上清液测pH。
维生素C质量分数的测定:称取10 g绿豆芽,按照文献[16]对绿豆芽中的维生素C进行提取测定。
显微观察:随机选取绿豆芽,在下胚轴距叶 4~5 cm处进行切片,每组10个切片,用光学显微镜观察绿豆芽下胚轴横切面的微观结构并拍照。
纤维素含量的测定:参照文献[17],称取10 g绿豆芽于烧杯中,冰水浴加入60 mLφ=60% H2SO4,消化30 min后,量取20 mL消化液加水定容至100 mL,布氏漏斗过滤,收集上清液作纤维素提取液备用,取2 mL提取液,加入0.5 mLw=2%的蒽酮溶液摇匀,再沿壁加入5 mL浓硫酸(冰水浴),静置12 min后620 nm处测吸光度值。
果胶含量的测定:称取5 g绿豆芽研磨,加入6 mL 1 mol·L-1H2SO4,70 ℃水浴20 min, 12 000×g离心15 min,收集上清液,定容至50 mL,作为果胶提取液备用,参照文献[18]测定。
纤维素酶活性的测定:称取10 g绿豆芽,加入20 mL经预冷的φ=95%乙醇,冰浴研磨后,低温静置10 min,4 ℃、1 2000 × g离心20 min,弃去上清液,向沉淀中加入10 mL经预冷的φ=80%乙醇振荡,低温静置10 min,相同条件离心,向沉淀中加入5 mL经预冷的提取液,振荡后低温静置20 min,再次离心收集上清液即为酶提取液,依据文献[16]测定。
果胶酶活性的测定:采用同果胶酶相同方法提取,按照文献[16]测定。

表1 绿豆芽感官评价标准Table 1 Standard of sensory evaluation of green bean sprouts
注:感官评分 < 85,认为绿豆芽新鲜状态不可接受。
Note:Sensory score < 85, freshness of green bean sprouts was unacceptable.
1.4 数据分析
采用EXCEL 2011进行数据处理并作图,用SPSS 22.0进行差异显著性分析(以P<0.05为显著差异)及相关性分析。
2 结果与分析
2.1 不同贮藏温度对绿豆芽保鲜的影响
2.1.1 感官评价的变化 由图1可知,随着贮藏时间的延长,绿豆芽的新鲜状态(感官评分)逐渐下降。贮藏温度与绿豆芽贮藏过程中的感官评分极显著相关(P<0.01,r=- 0.555)。低温 (4 ℃、10 ℃)贮藏的绿豆芽贮藏前60 h其感官评分均 > 85,处于新鲜状态,20° C贮藏的绿豆芽储藏前36 h,感官评分 > 85,较新鲜,25 ℃贮藏的绿豆芽贮藏前24 h,感官评分 ≥ 85,新鲜状态可接受,30 ℃贮藏的绿豆芽在贮藏24 h时,其感官评分 < 85,新鲜状态不可接受。48 h时,25 ℃和30 ℃贮藏的绿豆芽表面出现明显的汁液流出,下胚轴变软,出现异味;60 h时,其组织结构已严重软腐,汁液流失严重,无法进行取样测定观察。因此,后续试验只对绿豆芽装袋后0、12、24、36、48 h进行取样测定。
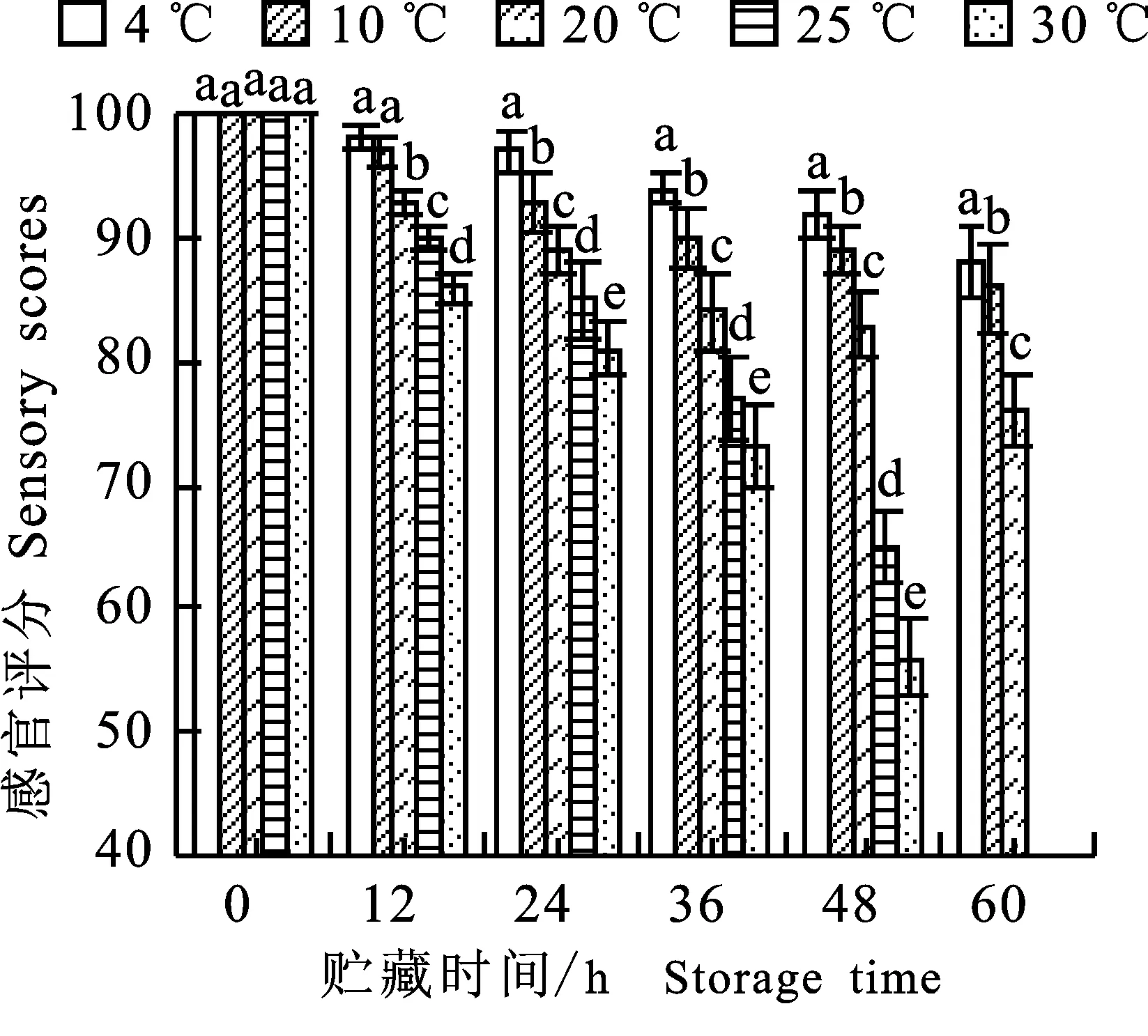
不同小写字母表示处理间差异显著(P<0.05),下同 Different lowercase letters indicate significant differences (P<0.05) under various treatments, the same below
图1 不同温度贮藏过程中绿豆芽感官评分的变化
Fig.1 Changes of sensory scores ingreen bean sprouts during storageof different temperatures
2.1.2 pH的变化 如图2所示,随着贮藏时间的延长,绿豆芽pH呈上升趋势。贮藏前12 h,各组绿豆芽较新鲜,pH上升较慢,基本呈弱酸性,24 h后,30 ℃ 贮藏的绿豆芽pH与20 ℃及25 ℃贮藏的均出现明显差异(P<0.05);贮藏温度越高,新鲜状态越差,pH上升越快。30 ℃贮藏的绿豆芽pH在48 h时达7.70,呈弱碱性,而4 ℃和10 ℃贮藏的绿豆芽pH一直保持相对稳定。pH的变化与感官评分高度相关(P<0.01,r=-0.815),反映了贮藏过程中绿豆芽品质的变化。
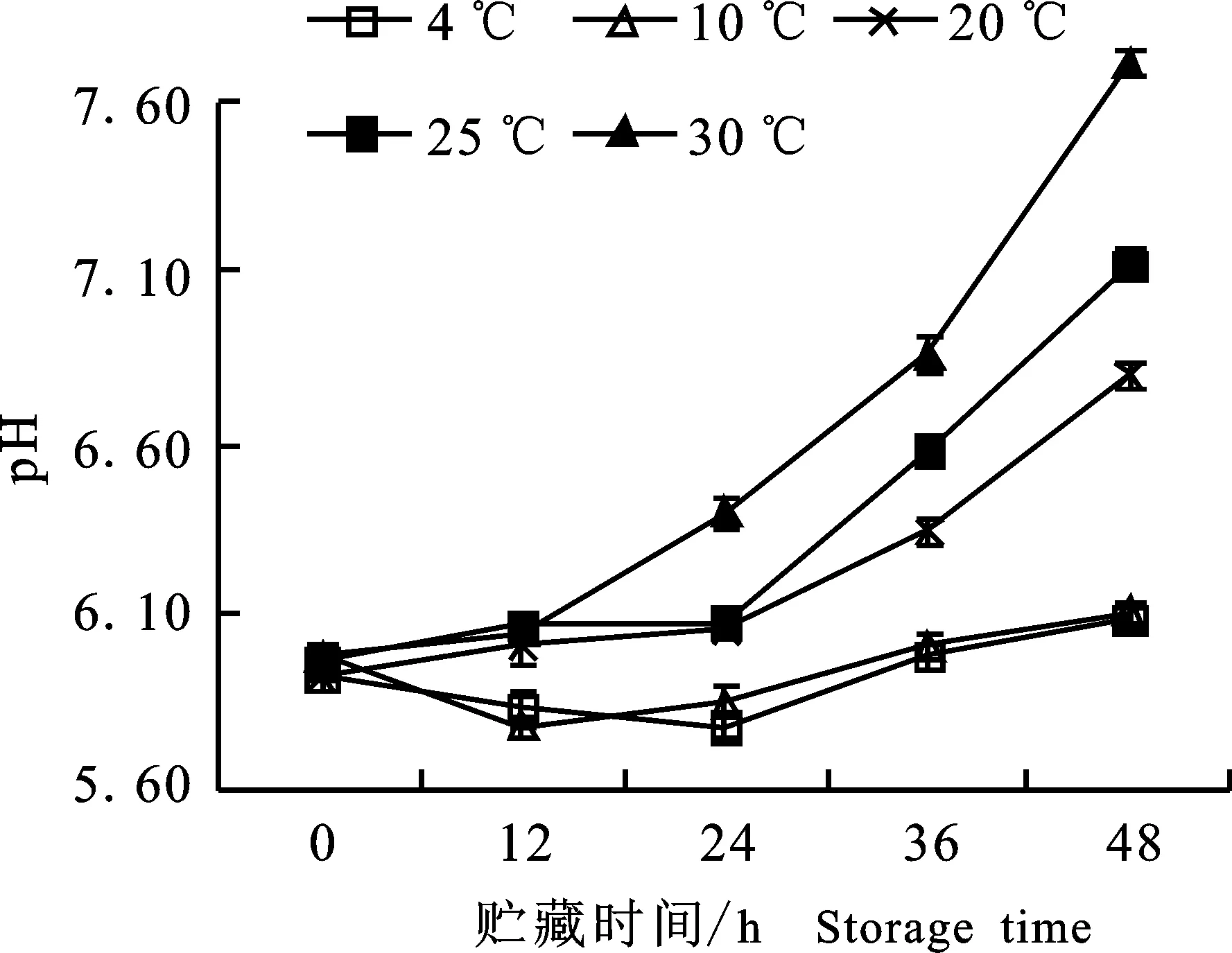
图2 不同温度贮藏过程中绿豆芽pH的变化Fig.2 Changes of pH in green bean sprouts during storage of different temperatures
2.1.3 维生素C质量分数的变化 绿豆芽贮藏过程中维生素C质量分数的变化如图3,随贮藏时间的延长,维生素C质量分数先升高后缓慢下降,前期绿豆芽较新鲜,其自身合成代谢旺盛,导致维生素C质量分数上升,后期质量分数下降是由于绿豆芽细胞成熟老化加剧,致使维生素C降解导致质量分数下降。贮藏至48 h时,4 ℃贮藏的绿豆芽维生素C质量分数较高,20 ℃及25 ℃次之,30 ℃贮藏的质量分数最低,仅为4 ℃质量分数的 54.4%,绿豆芽的新鲜状态也最差。维生素C质量分数是衡量果蔬品质的重要指标,其质量分数的变化反映了绿豆芽贮藏过程品质的变化。

图3 不同温度贮藏过程中绿豆芽维生素C质量分数的变化Fig.3 Changes of vitamin C mass fraction in green bean sprouts during storage of different temperatures
2.1.4 下胚轴结构的变化 如表2,随着贮藏时间的延长,绿豆芽新鲜状态发生变化,下胚轴出现大小不同程度的中空结构。贮藏0 h时,各组绿豆芽均较新鲜,其下胚轴横截面细胞饱满且排列紧密,贮藏12 h时20 ℃、25 ℃及30 ℃贮藏的绿豆芽下胚轴横截面出现空洞,随后空洞面积逐渐增大;贮藏至24 h时,4 ℃及10 ℃贮藏的绿豆芽下胚轴横截面出现较小面积的空洞,贮藏至48 h时,其下胚轴空洞面积略微增大。说明绿豆芽的新鲜状态与下胚轴中空结构的出现及其面积大小有关。绿豆芽下胚轴出现空洞结构,表明组织内部微观结构发生变化,细胞壁排列由紧密变疏松,导致胞间层结构改变,细胞壁破坏。
表2 不同温度贮藏过程中绿豆芽下胚轴横切面显微结构(×40)
Table 2 Microstructure of hypocotyl cross-section in green bean sprouts during storage of different temperatures(×40)

2.1.5 纤维素含量的变化 由图4可知,绿豆芽贮藏过程中纤维素含量随贮藏时间先上升后下降,前12 h,绿豆芽自身合成代谢致使纤维素含量上升,随后绿豆芽新鲜状态开始下降,下胚轴横切面出现空洞,纤维素含量也随之下降,而且贮藏温度越高,绿豆芽新鲜状态越差,纤维素含量也越低。纤维素是细胞壁的分子骨架,其含量下降,说明细胞壁结构遭到了破坏。
2.1.6 果胶质量浓度的变化 图5所示,随贮藏时间的延长,果胶质量浓度逐渐下降。贮藏12 h后,4 ℃及10 ℃贮藏的绿豆芽果胶质量浓度显著(P<0.05)高于20 ℃、 25 ℃及30 ℃贮藏组,其新鲜状态也较好,与纤维素质量浓度的变化基本保持一致。纤维素和果胶均是细胞壁的主要组成成分,两者含量的降低说明细胞壁水解,发生了自溶,解释了绿豆芽下胚轴出现空洞的现象。
2.1.7 纤维素酶活性变化 由图6知,绿豆芽纤维素酶活性随贮藏时间呈上升趋势。20 ℃、 25 ℃及30 ℃贮藏的绿豆芽纤维素酶活前期上升缓慢,36 h后酶活急剧上升,且贮藏温度越高,酶活性上升越快;低温(4 ℃)贮藏的绿豆芽纤维素酶活性一直处于较低水平。纤维素酶活性的变化与纤维素含量的变化高度相关(P<0.01,r= -0.524)。纤维素酶是导致细胞壁中纤维素水解和质地软化的重要原因,酶活性升高时会加速纤维素的水解,导致纤维素含量下降,致使细胞壁结构松散,从而使绿豆芽下胚轴出现中空结构。

图4 不同温度贮藏过程中绿豆芽纤维素含量的变化Fig.4 Changes of cellulose content in green bean sprouts during storage of different temperatures
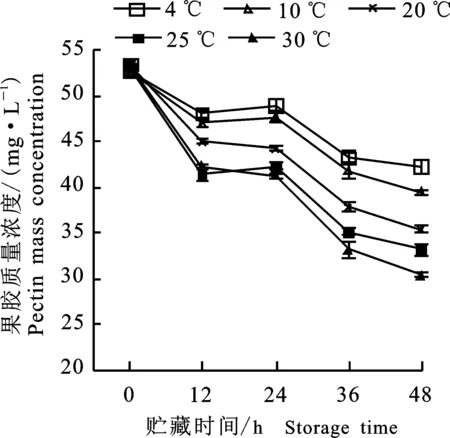
图5 不同温度贮藏过程中绿豆芽果胶质量浓度的变化Fig.5 Changes of pectin mass concentration in green bean sprouts during storage of different temperatures
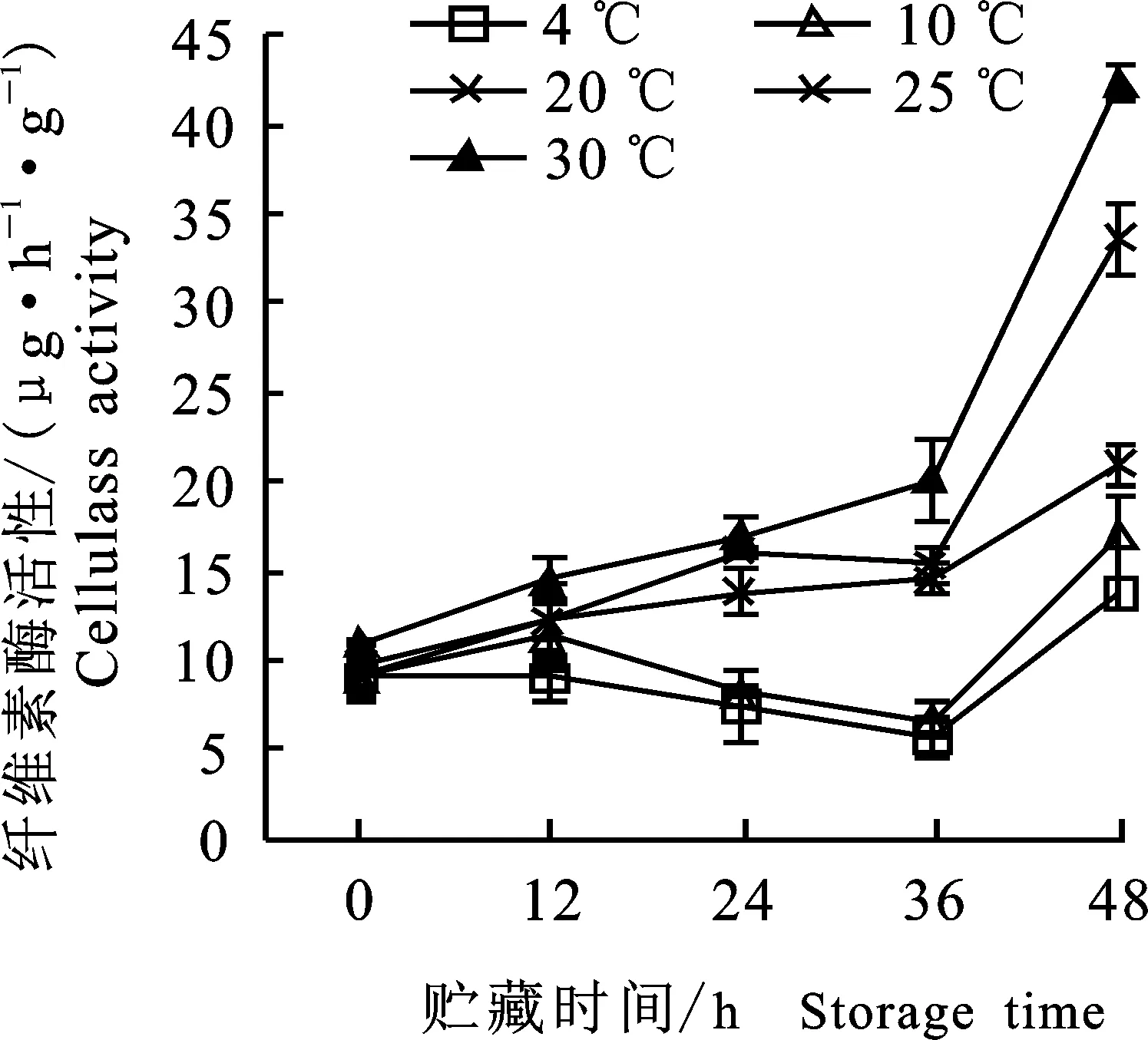
图6 不同温度贮藏过程中绿豆芽纤维素酶活性的变化Fig.6 Changes of cellulase activity in green bean sprouts during storage of different temperatures
2.1.8 果胶酶活性变化 如图7所示,随着贮藏时间的延长,绿豆芽果胶酶活性整体呈上升趋势,果胶酶活性的变化与果胶含量的变化高度相关 (P<0.01,r=- 0.835)。前12 h,各组绿豆芽果胶酶活性差异不显著(P>0.05),24 h后果胶酶活性差异显著(P<0.05),温度越高,新鲜状态越差,果胶酶活性越高。表明随着绿豆芽新鲜状态下降,其内部果胶酶活性升高,使组成细胞壁的主要成分水解,果胶含量下降,导致细胞壁自溶,从而出现绿豆芽组织软腐、汁液流失的现象。
2.2 酶抑制剂处理对绿豆芽保鲜的影响
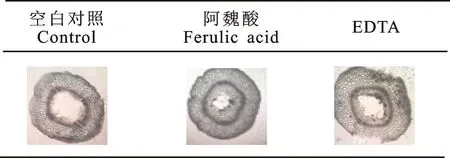
如图8和图9所示,阿魏酸及EDTA处理的绿豆芽贮藏过程中纤维素酶和果胶酶活性均比对照组低,且贮藏过程中感官评分也高于对照组,有利于绿豆芽新鲜状态的维持。其中,对照组绿豆芽贮藏24 h时,其感官评分 < 85,新鲜状态不可接受,而此时阿魏酸和EDTA处理的绿豆芽感官评分 > 85,较新鲜;贮藏36h时,EDTA处理的绿豆芽开始变软变坏,其感官评分 < 85,阿魏酸处理的绿豆芽48 h时开始变坏,相比于对照组,EDTA及阿魏酸处理分别可使绿豆芽25 ℃保鲜时间延长12 h、24 h。贮藏至48 h时,阿魏酸及EDTA处理的绿豆芽下胚轴中空结构面积均比对照组小(表3),表明阿魏酸及EDTA处理均能抑制纤维素酶和果胶酶的活性,缓解细胞壁自溶,从而延迟空洞结构的形成,有利于绿豆芽保鲜。
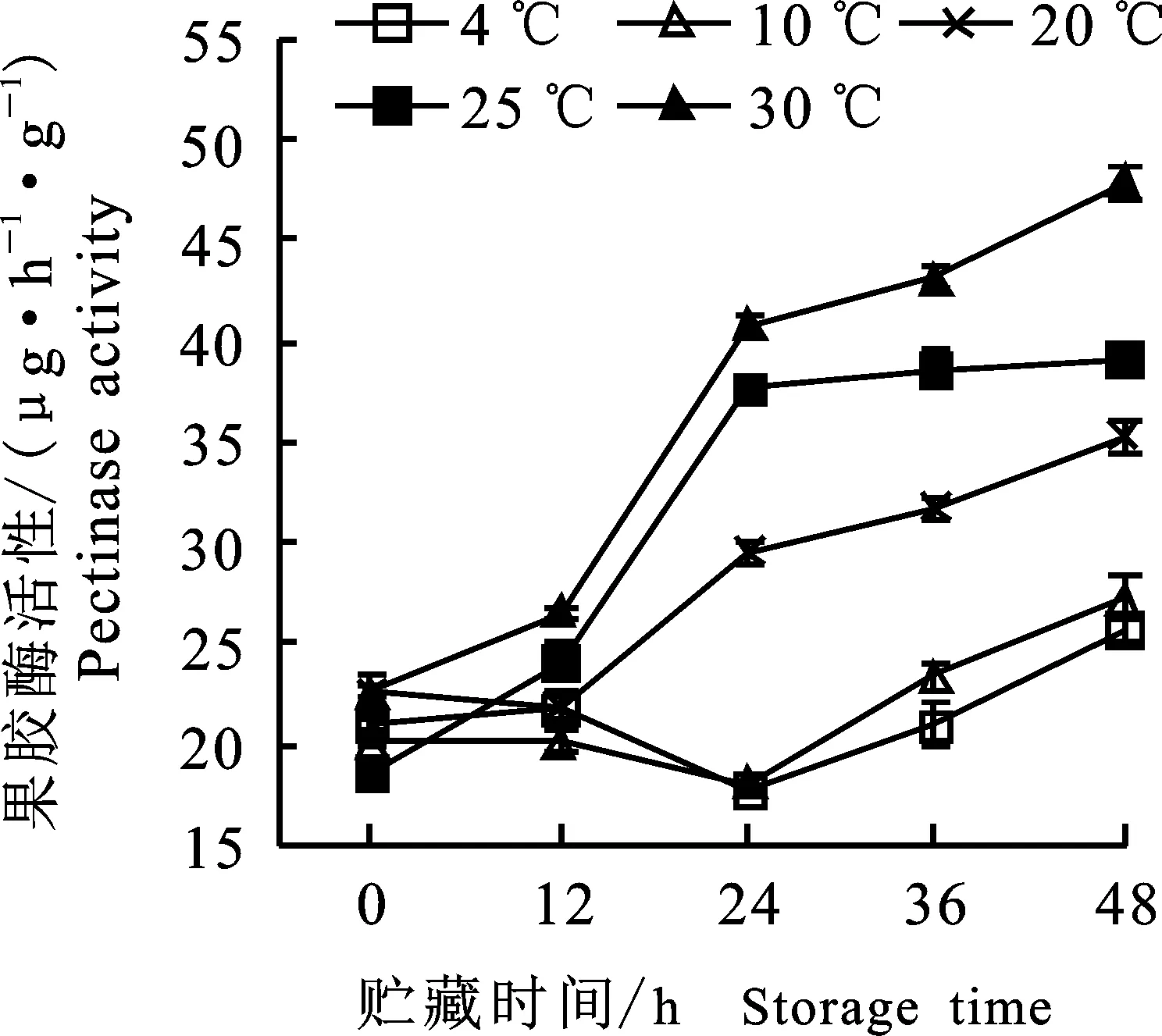
图7 不同温度贮藏过程中绿豆芽果胶酶活性的变化Fig.7 Changes of pectinase activity in green bean sprouts during storage of different temperatures
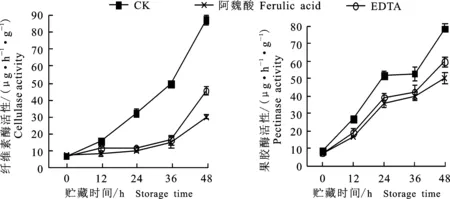
图8 酶抑制剂处理绿豆芽贮藏过程中纤维素酶活性及果胶酶活性的变化Fig.8 Changes of cellulase activity and pectinase activity during storage of green bean sprouts treated with different enzyme inhibitors
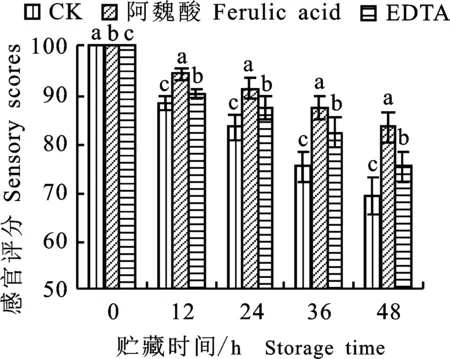
图9 酶抑制剂处理绿豆芽贮藏过程中感官评分的变化Fig.9 Changes of sensory scores during storage of green bean sprouts treated with different enzyme inhibitors
表3 酶抑制剂处理绿豆芽贮藏至48 h时下胚轴横切面显微结构
Table 3 Microstructure of hypocotyl cross-sectionin green bean sprouts treated withdifferent enzyme inhibitors stored for 48 h
3 讨 论
近年来,已有不少关于果蔬贮藏品质与细胞壁自溶的关系研究。解越等[19]将茄子分别在 2 ℃、12 ℃及20 ℃下贮藏,分析贮藏温度对其活性氧代谢及细胞壁降解的影响,综合比较得出, 12 ℃为茄子最适宜的贮藏温度。林河通等[20]在 10 ℃贮藏‘褔眼’龙眼,发现随着贮藏时间的延长,原果胶及纤维素含量不断减少,果胶酯酶、多聚半乳糖醛酸酶及纤维素酶活逐渐升高,果肉自溶指数及细胞壁自溶程度不断增加。本试验通过不同温度贮藏绿豆芽,得到腐败速率不同的绿豆芽,通过显微观察,随着贮藏时间的延长,绿豆芽下胚轴会出现中空结构,且绿豆芽新鲜度越低,中空结构的面积越大;结合绿豆芽贮藏过程中纤维素、果胶含量及纤维素酶、果胶酶活性的变化,说明绿豆芽的腐败及下胚轴中空结构的出现与其细胞壁自溶有关。因此,若能抑制绿豆芽细胞壁中纤维素酶与果胶酶的活性,减缓壁自溶,则可能有效延长保鲜期。
赵云峰等[21]通过热水处理龙眼降低了果肉细胞壁降解酶的活性从而达到延长保鲜的效果,Ortiz等[22]采用超低氧和钙处理苹果抑制细胞壁降解酶的活性,降低了硬度的损失。本试验采用阿魏酸与EDTA溶液分别处理绿豆芽,其纤维素酶与果胶酶活均受到一定程度的抑制,减缓了下胚轴中空结构面积的增大,缓解细胞壁自溶,从而延长绿豆芽的保鲜期,与对照组相比,EDTA处理可使绿豆芽25 ℃贮藏保鲜时间延长12 h,阿魏酸处理可延长24 h,说明通过抑制绿豆芽细胞壁中纤维素酶及果胶酶的活性来延长绿豆芽的保鲜期的技术路线是合理的。后续研究还需继续优化降低绿豆芽纤维素酶和果胶酶活性的技术路线,以便开发出更方便、高效、安全的保鲜方案。
