异迟眼蕈蚊对溴氰菊酯的抗性风险及解毒酶活力分析
2019-07-29沈登荣袁盛勇田学军张宏瑞
沈登荣,何 超,袁盛勇,田学军,李 珣,张宏瑞
(1. 红河学院 生命科学与技术学院,云南省高校农作物优质高效栽培与安全控制重点实验室,云南蒙自 661199; 2. 云南农业大学 植物保护学院,昆明 650201)
异迟眼蕈蚊(Bradysiadifformis)是世界性的农业和林业害虫,主要分布在亚洲、欧洲、北美洲、南美洲和非洲等地区[1-2]。2009年中国首次报道异迟眼蕈蚊在云南食用菌的危害,同时该虫也是云南食用菌、野生菌害虫的优势种类[3-4]。异迟眼蕈蚊以幼虫取食菌丝体造成食用菌产量的下降,因其发育历期短、繁殖力强等特点,目前在食用菌生产中主要采用化学药剂对其进行防治,其中拟除虫菊酯类杀虫剂是食用菌栽培中广泛用于防治菇蚊、菇蝇的常用杀虫剂,具有防效好、易分解、对食用菌产品质量安全等优点[5]。
由于化学杀虫剂的长期使用,国外已有食用菌眼蕈蚊抗药性的研究报道,例如美国宾夕法尼亚州和特拉华州的厉眼蕈蚊属害虫Lycoriellamali对苄氯菊酯产生高抗水平的抗性[6]。Shirvani-Farsani等[7]研究发现溴氰菊酯、烟草提取物不能有效控制食用菌的厉眼蕈蚊属害虫Lycoriellaauripila。国内也报道韭菜迟眼蕈蚊Bradysiaodoriphaga对有机磷类、菊酯类和新烟碱类的抗药性[8-9],其中河南郑州种群对毒死蜱、辛硫磷产生极高水平抗性,对高效氯氰菊酯产生中等水平抗性;山东李坡种群对噻虫嗪产生高水平抗性[8]。目前,中国还没有关于食用菌眼蕈蚊抗药性的研究报道,近年来在国内主要食用菌栽培区的食用菌样品中检测到有机磷类(乐果、甲拌磷、甲基对硫磷、马拉硫磷、倍硫磷)和拟除虫菊酯类(溴氰菊酯、氰戊菊酯、甲氰菊酯、三氟氯氰菊酯)杀虫剂残留超标[10-11]。研究发现,昆虫对拟除虫菊酯类杀虫剂的抗性机制包括表皮穿透率下降、靶标抗性以及代谢抗性,其中以代谢抗性机制较为普遍,昆虫体内的多功能氧化酶(MFO)、羧酸酯酶(CarE)和谷胱甘肽S-转移酶(GSTs)等解毒酶系的改变均与昆虫对该类杀虫剂的代谢抗性有关[12]。鉴于拟除虫菊酯类是目前用于防治食用菌眼蕈蚊的常用杀虫剂,且在防治食用菌眼蕈蚊中出现药效降低和食用菌样品的残留问题,本试验采用溴氰菊酯对异迟眼蕈蚊种群进行抗性选育,进一步明确异迟眼蕈蚊对溴氰菊酯产生抗药性的潜在风险;通过增效剂的增效性和解毒酶的活性分析,旨在探究异迟眼蕈蚊对溴氰菊酯代谢抗性形成的生化机理,从而为该虫的抗性预防和治理提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 虫源 异迟眼蕈蚊于2014年3月采自云南省蒙自市文澜镇平菇菇房内,采用饲养笼(60 cm×60 cm×60 cm)和饲养盒(22 cm×15 cm×16 cm)进行室内饲养,期间不接触任何药剂。在饲养盒中放入灭菌的腐殖土作为饲养基质,添加黄豆粉作为营养补充。饲养和试验处理条件为:温度(25±1)℃、相对湿度为70%、光周期L/D=16 h/8 h。
1.1.2 试剂 25 g/L溴氰菊酯乳油,拜耳作物科学有限公司;95%增效醚(PBO)、96%顺丁烯二酸二乙酯(DEM)、98%磷酸三苯酯(TPP),阿拉丁试剂有限公司;丙酮,上海申博化工有限公司;α-萘酚(α-NA)、毒扁豆碱、固蓝B 盐、十二烷基磺酸钠(SDS)、还原型谷胱甘肽(GSH)、1-氯-2,4-二硝基苯(CDNB)、对硝基苯甲醚、对硝基苯酚、NADPH、牛血清蛋白、考马斯亮蓝,上海阿拉丁生化科技公司。
1.2 试验方法
1.2.1 异迟眼蕈蚊生物测定方法 采用薛明等[13]的幼虫浸渍法,略做改动。将各药剂稀释成5~6个系列浓度(死亡率为20%~90%),挑取大小一致的3龄幼虫约20头,放入底部铺有滤纸的塑料瓶(直径5 cm,高6 cm)中,用移液器滴加500 μL药液于虫体上浸渍30 s,用滤纸吸掉过量药液后放入培养基质进行饲养。设无菌水为对照,每个浓度重复3次,24 h后观察死亡情况(毛笔轻触虫体无反应判定为死亡)。
1.2.2 异迟眼蕈蚊抗性选育 抗性选育包括敏感品系和抗性品系的选育。
敏感品系:采用郭天凤等[14]的单体选育法,略做改动。将羽化的单对成虫放入塑料瓶(直径8.5 cm,高11 cm)中(内置2%水琼脂)进行交配繁殖,建立30个稳定种群。待异迟眼蕈蚊种群繁殖到一定数量后,用选育前品系的LC10溴氰菊酯浓度处理试虫,采用“1.2.1”中方法测定各种群对溴氰菊酯的敏感性,挑选出死亡率较高的3~4个种群混合饲养,作为下一代筛选的虫源,每隔3代进行1次生物测定。
抗性品系:采用群体选育法进行,以溴氰菊酯(上一代3龄幼虫死亡率为40%~60%的浓度)处理群体饲养的3龄幼虫,放入药液浸渍30 s,用相同浓度药剂处理灭菌的腐殖土用于饲养幼虫,待存活3龄幼虫发育至成虫阶段,将羽化成虫接入不含药剂的腐殖土中隔离饲养,作为下一代筛选的虫源,每隔3代进行1次生物测定。
1.2.3 抗性现实遗传力估算和抗性风险评估 采用Tabashnik等[15]的阈性状分析方法估算抗性现实遗传力h2。依据抗性现实遗传力h2,预测不同选择压抗性上升10倍所需的筛选代数。
1.2.4 增效毒力测定 采用抗性选育中敏感性筛选的F12为敏感品系,抗性筛选的F24为抗性品系进行增效毒力测定。参照郭天凤等[14]的方法,略做改动。通过预试验确定PBO、TPP和DEM 3种增效剂最高使用质量浓度为60 mg/L,对异迟眼蕈蚊3龄幼虫的存活和取食无不良反应。将3龄幼虫约20头浸入各增效剂(60 mg/L)10 s取出,待增效剂晾干转入培养基质饲养,12 h后进行幼虫毒力测定,3次重复,增效比=单剂LC50/(单剂+增效剂)LC50。
1.2.5 解毒酶活性测定 羧酸酯酶(CarE)活性测定参照余慧灵等[16]方法[CarE比活力单位为:mmol/(min·mg)]。谷胱甘肽S-转移酶(GSTs)活性测定参照余慧灵等[16]方法[GSTs比活力单位为:mmol/(min·mg)]。多功能氧化酶O-脱甲基(MFO)活性测定参照余慧灵等[16]方法[MFO比活力单位为:nmol/(min·mg)]。酶原蛋白质含量测定参照Bradford[17]的考马斯亮蓝G-250法。
1.3 数据处理
采用SPSS 17.0软件对异迟眼蕈蚊的生物测定数据进行统计分析,采用单因素和 Duncan法进行方差分析和多重比较,用概率单位回归法(Probit)计算毒力回归直线方程、致死中浓度(LC50)和 95%置信区间。
2 结果与分析
2.1 异迟眼蕈蚊敏感品系的选育
采用单体选育法对异迟眼蕈蚊敏感品系进行选育(表1),总体上溴氰菊酯对3龄幼虫的LC50呈逐渐下降的趋势,筛选至F18代后溴氰菊酯对异迟眼蕈蚊3龄幼虫的致死中质量浓度LC50为 12.413 mg/L,抗性倍数仅为F0代的0.74倍。其中F0~F9代的LC50下降趋势相对较快,而 F15~F18代的LC50基本维持不变,说明筛选的敏感品系的敏感性已基本趋于稳定。
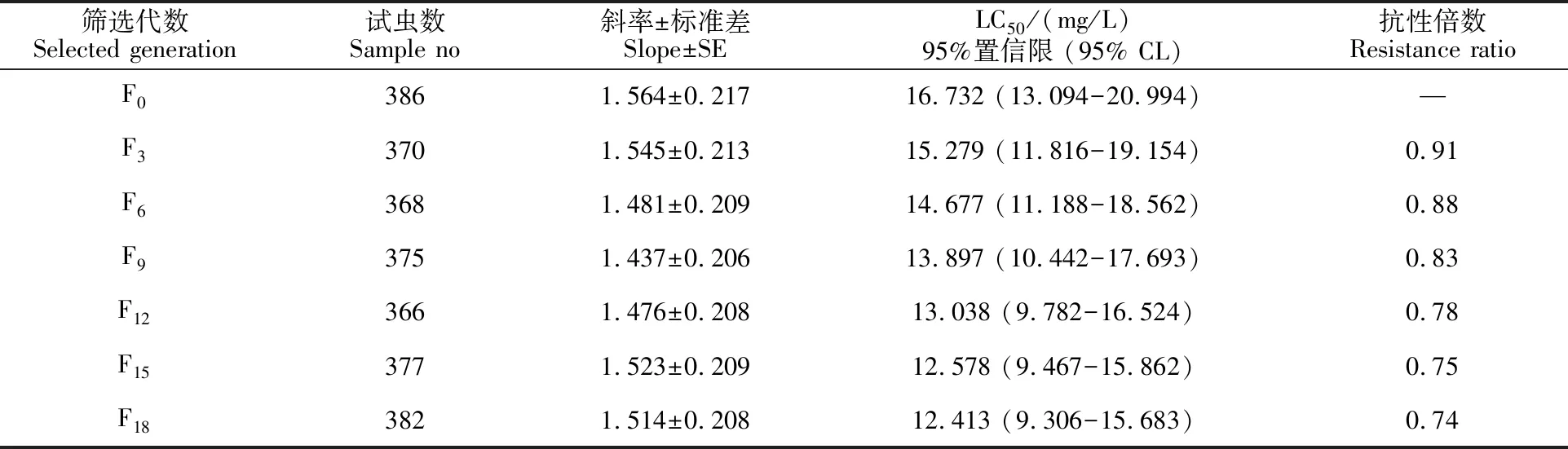
表1 溴氰菊酯对异迟眼蕈蚊种群的敏感性筛选Table 1 Selection of susceptibility to deltamethrin in B.difformis
2.2 异迟眼蕈蚊抗溴氰菊酯品系的选育
溴氰菊酯对异迟眼蕈蚊的抗性筛选见表2,筛选至F24代后,溴氰菊酯对3龄幼虫的LC50由最初的16.621 mg/L上升至141.070 mg/L,抗性倍数达到8.49倍;相对于室内敏感品系最终选育结果(LC50为12.413 mg/L),其抗性倍数达到11.36倍,说明通过室内连续筛选24代后异迟眼蕈蚊对溴氰菊酯已经达到中等抗性水平。在抗性选育过程中, F0~F9代的抗性倍数增长速度缓慢;F12~F24代的抗性倍数增长速度呈逐渐增大趋势。
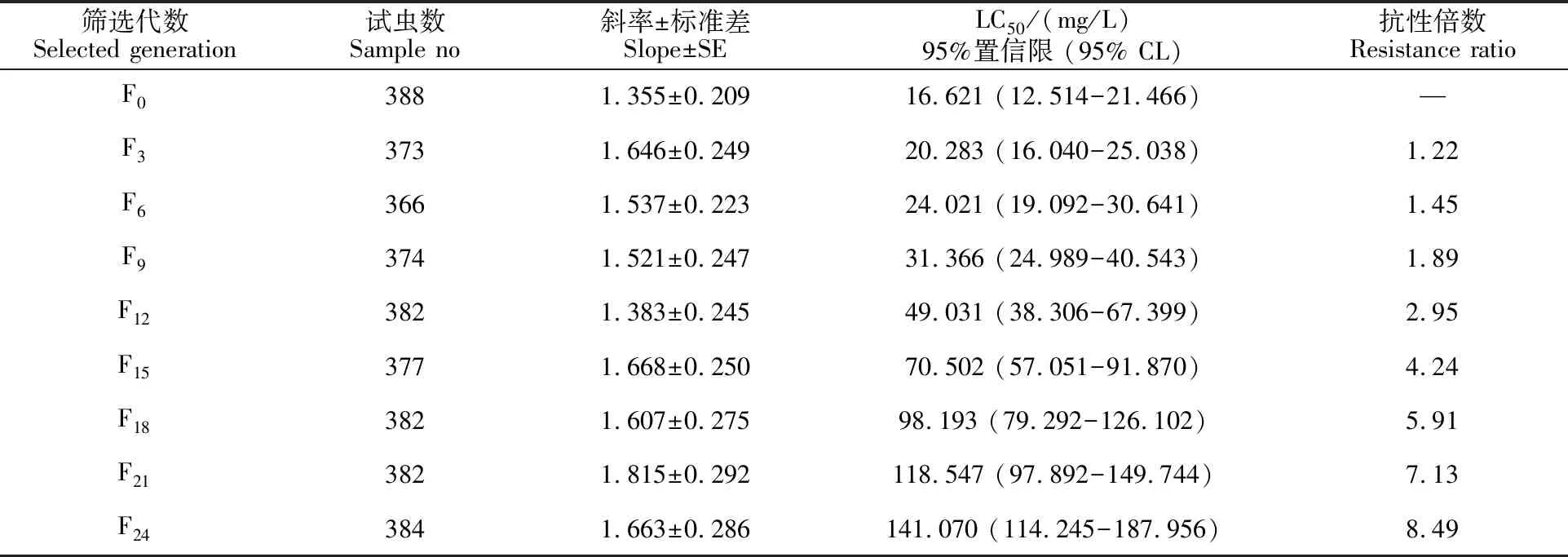
表2 溴氰菊酯对异迟眼蕈蚊种群的抗性筛选Table 2 Selection of resistance to deltamethrin in B.difformis
2.3 异迟眼蕈蚊对溴氰菊酯的抗性现实遗传力和发展速率预测
异迟眼蕈蚊对溴氰菊酯的抗性现实遗传力分析见表3,通过连续24代的抗性筛选,至F24代现实遗传力h2为0.077 1,其中在抗性筛选前期(F0~F9)的h2较低,抗性上升较为缓慢;而在F12~F24期间,h2明显增大,抗性发展速度明显提升。
根据估算的异迟眼蕈蚊对溴氰菊酯的抗性现实遗传力h2=0.077 1,平均斜率1.509 0,即表型标准差δp=0.662 7,以溴氰菊酯对异迟眼蕈蚊的致死率分别为50%、60%、70%、80%、90%和99%作为选择压力,预测抗性提高 10倍所需的代数。从图1可看出,异迟眼蕈蚊的抗性发展速率随药剂致死率的提高而逐渐加快,当选择压力在50%~80%时,抗性增加10倍需要14~25代;选择压力在80%~90%时,抗性增加10倍需要11~14代。
2.4 增效剂对溴氰菊酯的增效毒力测定
由表4可知,在敏感品系中3种增效剂对溴氰菊酯的增效作用均不显著,而在抗性品系中PBO和TPP对溴氰菊酯的增效作用显著,其中PBO对溴氰菊酯的增效程度最强(F=204.35,P< 0.05),对抗性品系的增效比为2.32倍;TPP对溴氰菊酯也有明显的增效作用(F= 86.12,P<0.05),对抗性品系的增效比为1.75倍;而DEM对溴氰菊酯的增效作用不显著。初步表明异迟眼蕈蚊对溴氰菊酯代谢抗性的提高与多功能氧化酶和羧酸酯酶有关。
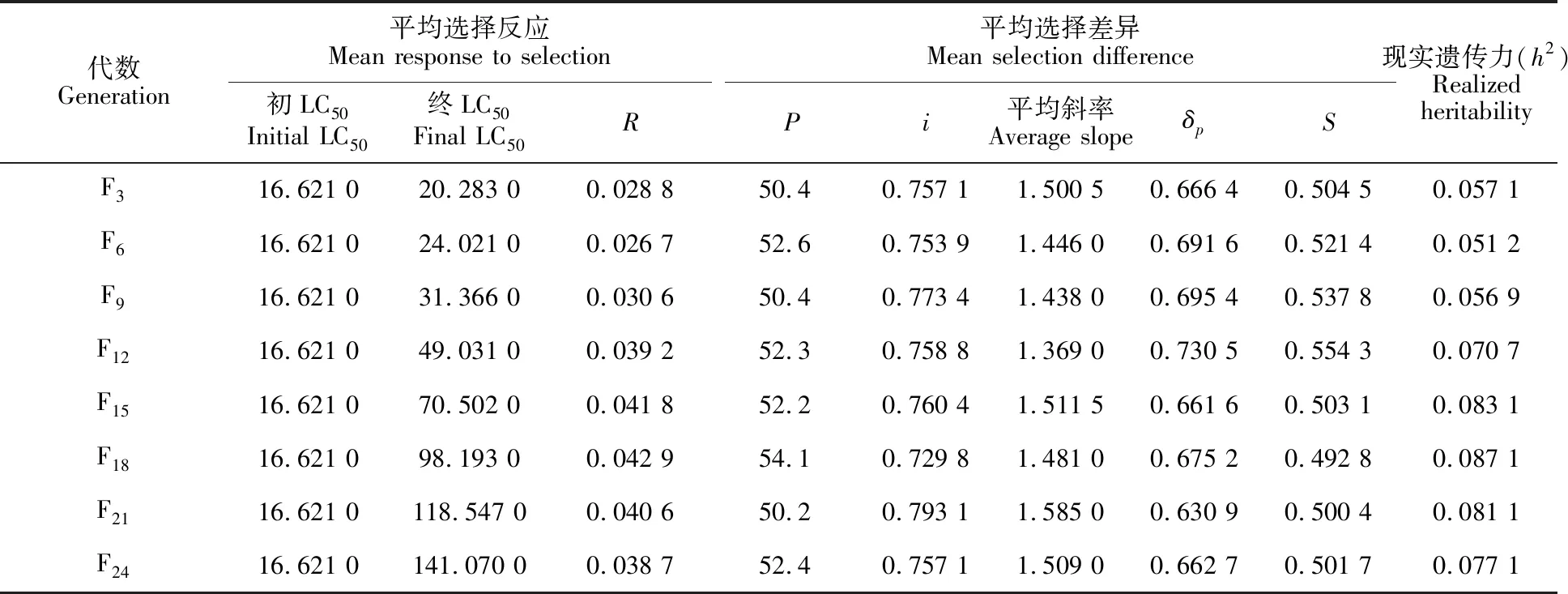
表3 异迟眼蕈蚊对溴氰菊酯的抗性现实遗传力Table 3 Realized heritability of resistance to deltamethrin in B.difformis
注:R.选择反应;P.筛选存活率;i.选择强度;δp.表现型标准方差;S.选择差异。
Note.R.Response to selection;P.Mean survival percentage of the selection generation;i.Intensity of selection;δp.Phenotypic standard deviation;S.Selection difference.
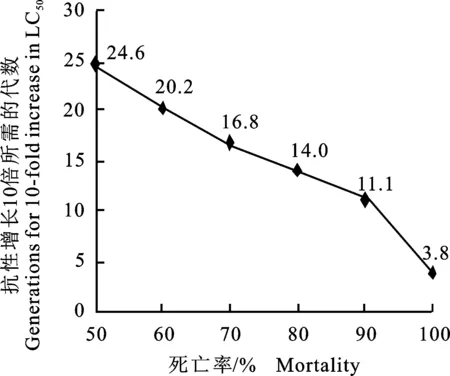
图1 不同选择压力下异迟眼蕈蚊对溴氰菊酯抗性提高 10 倍所需代数Fig.1 Generations to develop 10-fold resistance of B.difformis to deltamethrin under different selection pressures
2.5 不同抗性选育代数的多功能氧化酶O-脱甲基活性
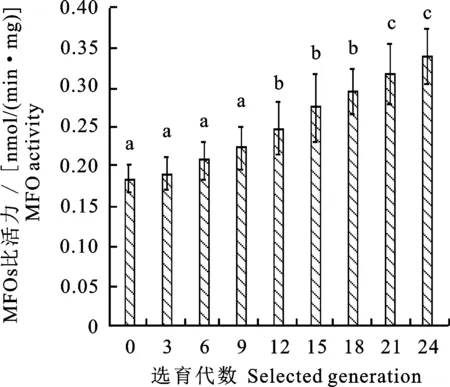
由图2可看出,随着抗性选育代数的增加,多功能氧化酶O-脱甲基活性的活性逐渐增强,其中F0~F9代多功能氧化酶O-脱甲基活性变化不显著,筛选至F12代酶活性已显著上升(P<0.05),变化倍数为1.34倍。筛选到F24代时酶活性变化倍数为1.83倍,达到差异显著(P<0.05),说明异迟眼蕈蚊对溴氰菊酯抗性的提高与多功能氧化酶O-脱甲基活性增强有直接关系。
2.6 不同抗性选育代数的谷胱甘肽S-转移酶活性
由图3表明,随着抗性选育代数的增加,谷胱甘肽S-转移酶活性的变化程度较小,出现先下降(F0~F6),后上升(F9~F24)的趋势。筛选至F24代时,酶活性变化倍数仅为1.07倍,酶活性变化不显著。说明异迟眼蕈蚊对溴氰菊酯抗性的提高并没有引起谷胱甘肽S-转移酶活性的明显变化。
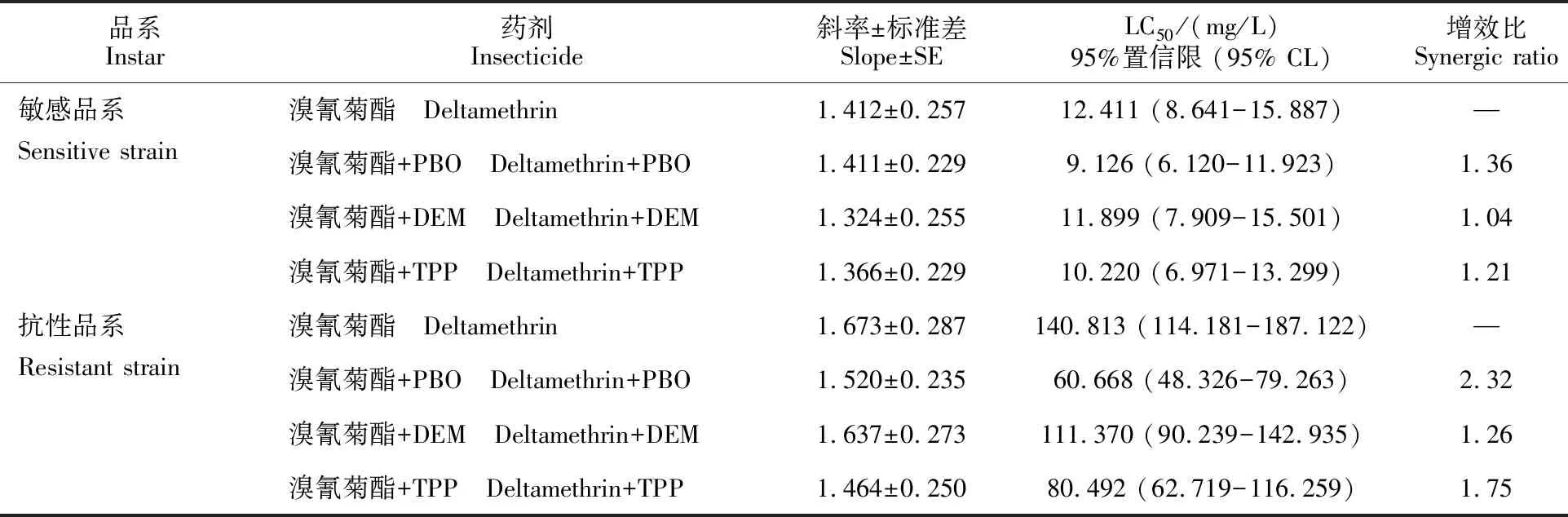
表4 增效剂在异迟眼蕈蚊不同品系对溴氰菊酯的增效作用Table 4 Synergistic effect to deltamethrin in different strains of B.difformis
不同字母表示不同代数存在差异显著(P<0.05),下同。
Different letters indicate significant difference(P<0.05) among different generation,the same below.
图2 不同抗性选育代数的多功能氧化酶O-脱甲基比活力
Fig.2 Specific activity of O-demethylation of MFOin different generations of resistance selection
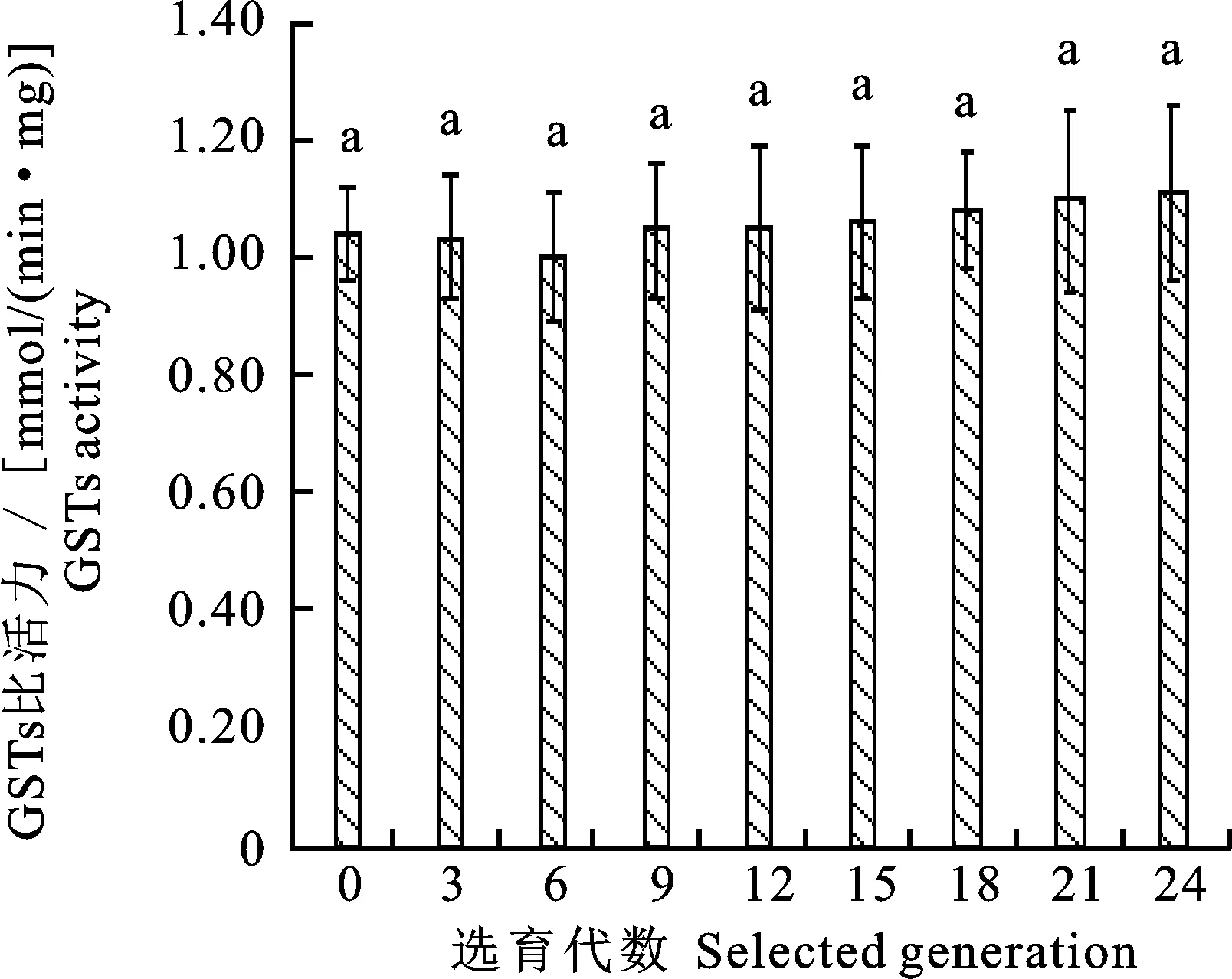
图3 不同抗性选育代数的谷胱甘肽S-转移酶比活力Fig.3 Specific activity of GSTs in different generations of resistant selection
2.7 不同抗性选育代数的羧酸酯酶活性
由图4可看出,随着抗性选育代数的增加,羧酸酯酶活性的活性逐渐增强,其中F0~F9代羧酸酯酶活性变化不显著,筛选至F12代酶活性已显著上升(P<0.05),变化倍数为1.20倍。筛选到F24代时酶活性变化倍数为1.40倍,达到差异显著(P<0.05),说明异迟眼蕈蚊对溴氰菊酯抗性的提高与羧酸酯酶活性增强有直接关系。
3 讨 论
本研究采用溴氰菊酯对异迟眼蕈蚊进行抗性选育,抗性筛选至24代后抗性倍数增长11.36倍,说明经过室内筛选24代后异迟眼蕈蚊对溴氰菊酯已经达到了中等水平抗性。目前国内多个食用菌栽培区的食用菌样品中已检测出溴氰菊酯、氰戊菊酯、甲氰菊酯、三氟氯氰菊酯的残留问题[10-11],以及国外关于溴氰菊酯不能有效控制食用菌的厉眼蕈蚊属害虫(L.auripila)的研究报道[7],均反映出食用菌眼蕈蚊主要种类(厉眼蕈蚊属、迟眼蕈蚊属)存在对拟除虫菊酯类杀虫剂产生抗药性的风险。
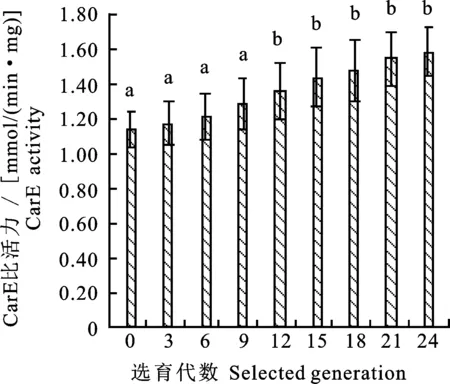
图4 不同抗性选育代数的羧酸酯酶比活力Fig.4 Specific activity of CarE in different generations of resistant selection
抗性风险评估是在抗性选育的基础上,根据抗性现实遗传力预测一定选择压力下抗性发展速率是目前常用的抗性风险评估方法。本研究表明异迟眼蕈蚊对溴氰菊酯的抗性现实遗传力h2为0.077 1,当选择压力在80%~90%时,抗性增加10倍需要11~14代。刘洪霞等[18]发现通过17代抗性选育,白纹伊蚊(Aedesalbopictus)对溴氰菊酯的现实遗传力h2为0.125 7,表明白纹伊蚊对溴氰菊酯抗性风险较大。魏绪强等[19]发现通过21代抗性选育,家蝇(Muscadomestica)对溴氰菊酯的现实遗传力h2为0.157 1,表明家蝇对溴氰菊酯抗性风险较大。徐 鹿[20]研究表明灰飞虱(Laodelphaxstriatellus)对溴氰菊酯的现实遗传力h2为0.061,表明灰飞虱对溴氰菊酯的抗性风险较小。说明卫生害虫对溴氰菊酯的抗性风险明显高于农业害虫,主要是由于卫生害虫受到的药剂选择压力明显高于农业害虫,从而引起现实遗传力h2的增大。本研究结果虽然表明异迟眼蕈蚊对溴氰菊酯的抗性风险较低,但研究发现现实遗传力h2在害虫不同的抗性选育阶段存在一定的波动情况[18-20],因此在食用菌生产中也要尽量降低溴氰菊酯的使用浓度,延缓异迟眼蕈蚊抗性的发展。
通过对异迟眼蕈蚊不同品系的增效测定发现,在抗性品系中PBO和TPP对溴氰菊酯的增效作用显著。对异迟眼蕈蚊抗性筛选中的不同世代的解毒酶活性分析表明:随着筛选代数的增加,多功能氧化酶O-脱甲基和羧酸酯酶的活性显著增加,证实异迟眼蕈蚊对溴氰菊酯抗性的提高与多功能氧化酶和羧酸酯酶活性增强有密切关系。这与Bartlett等[21]研究厉眼蕈蚊属害虫(L.mali)抗苄氯菊酯品系和敏感品系的多功能氧化酶单加氧酶活性、El-Latif 等[22]研究棉铃虫(Helicoverpaarmigera)抗溴氰菊酯品系和敏感品系的酯酶活性、Yang等[23]研究棉铃虫抗溴氰菊酯品系和敏感品系的中肠微粒体对溴氰菊酯的氧化代谢的结果相似。主要原因可能是与拟除虫菊酯类杀虫剂的生物代谢作用位点有关,研究发现拟除虫菊酯类杀虫剂最主要的生物代谢反应是酯键的清除,由于大多数拟除虫菊酯杀虫剂都是羧酸酯类。因此,容易被羧酸酯酶水解,氧化作用也可导致对拟除虫菊酯类药剂中酯键的清除[23]。
本研究主要从生理生化水平研究异迟眼蕈蚊对溴氰菊酯的代谢抗性,研究结果仅说明多功能氧化酶和羧酸酯酶参与异迟眼蕈蚊对溴氰菊酯的代谢抗性形成,但两类解毒酶的抗性基因及表达水平,以及相关解毒酶对溴氰菊酯的代谢作用等问题还未明确。因此,在后续的研究中还需要从分子水平上探索抗性的形成和发展机制,通过生理生化水平和分子水平两个方面的相互应证,才能系统揭示该虫对溴氰菊酯的代谢抗性形成及其主导的抗性机制。
