荧光假单胞菌2P24中RstA蛋白的功能鉴定
2019-07-26李谛音何永兴韩建庭李坤王志平李妙慧
李谛音 何永兴 韩建庭 李坤 王志平 李妙慧
(1. 兰州大学第二医院泌尿外科 甘肃省泌尿系疾病研究重点实验室,兰州730030;2. 兰州大学生命科学学院细胞活动与逆境适应教育部重点实验室,兰州730000;3. 四川大学华西临床医学院,成都610041)
荧光假单胞菌(Pseudomonas fluorescens,Pf)是一种革兰氏阴性可动杆菌,广泛分布于土壤、水等自然环境中[1];其最适生长温度和最适生长pH分别为4-32℃和4-8,具有广泛适应性、营养多样性和代谢复杂性的特点[2]。一方面,Pf是生防菌株的重要一员并参与生物降解与工业生物转化[3],其产生的丰富次级代谢产物,如2,4-二乙酰基间三苯酚、吩嗪和藤黄绿菌素等[4-5],及多样的代谢机制已被广泛研究。另一方面,Pf对环境中多种有害化合物的响应机制也备受关注,尤其是多样的抗生素抗性基因,很可能成为基因水平转移的储库[6-7]。
研究表明,Pf对多种抗生素的耐受性常由外排系统介导。外排泵是一种膜转运蛋白,广泛存在于许多微生物基因组中,它不仅参与正常物质运输和代谢,还能转运抗生素、重金属、有机溶剂、去污剂等毒性分子,调节微生物对不同环境的适应能力[8]。EmhABC是荧光假单胞菌2P24中最主要的RND(Resistance nodulation division)家族外排泵,其基因缺失菌株对氨苄西林、卡那霉素、庆大霉素等多种毒物的耐受性大幅下降[9],可见EmhABC能够显著影响细菌对外界有毒物质的抵抗能力,但目前对EmhABC的调控机制并不清楚。本研究中,我们鉴定了荧光假单胞菌2P24中一个新的OmpR家族转录因子RstA,证实RstA能够直接调控外排泵基因emhABC的表达并影响细菌多重耐药性。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 野生型荧光假单胞菌2P24菌株由中国农业大学张立群教授惠赠;大肠杆菌DH5α、Wm3064及BL31(DE3)感受态细胞购自美国Novagen;表达载体pET28b、敲除载体pK18mobsacB及报告基因载体pRG970由本实验室保存;本研究中所使用的引物见表1。

表1 PCR扩增所用引物
1.1.2 试剂与仪器 细菌基因组提取试剂盒、质粒小提试剂盒、胶回收试剂盒购自北京天根生化科技有限公司,Taq MIX购自北京佳兰生物科技有限公司,T4连接酶、限制性内切酶NdeI和XhoI、定量PCR相关制品购自大连宝生物工程有限公司,氯霉素、卡那霉素、庆大霉素、洛美沙星、氨苄霉素、四环素、强力霉素、IPTG购自百灵威科技有限公司,美罗培南、BSA购自索来宝生物,o-nitrophenol、咪唑购自美国Sigma-Aldrich。DU530 UV/Vis 分光光度计购自美国Beckman Coulter,NanoDrop2000购自美国Thermo Fisher,凝胶成像系统购自Bio-Rad公司。
1.2 方法
1.2.1 共适应性分析 Cofitness Browser Database(http://fit.genomics.lbl.gov/cgi-bin/myFrontPage.cgi)由美国加州大学伯克利分校研究组建立,通过构建随机转座子插入突变体库并联合全基因组测序(Random Bar Code Transposon-site Sequencing,RBTnSeq),评估了32株来自不同种属菌株突变体对多种生长环境的适应度。每个菌株内都涉及上千种基因缺失突变;生长条件设置包括94种碳源、45种氮源及34-55种抗生素或金属离子。具体评估过程如下:将某菌种所有转座子突变株的混合体在某一生长条件下培养4-8代后,采用DNA Barcode Sequencing技术对比所有突变体培养前后各自标记基因的丰度,并以培养前后该基因突变体丰度比值的对数表征菌株适应度(Strain fitness);基因适应度Gene fitness为不同菌株适应度的加权平均值,并通过计算t值评估每个基因的菌株适应度值的一致性(|t|<4时无参考意义),即:

在Cofitness Database中,参数Fitness即指上文中的Gene fitness,Fitness<0表示某基因对某特定生长条件的适应很重要,Fitness> 0则表示某基因对增殖有害,突变体具有生长优势。一般当Fitness<-2或> 2时表示对生长影响明显。而数据库中的Cofitness值则指同一细菌中一对基因的所有适应度值具有Pearson相关性,即具有相似的适应度模式。通常,Cofitness值> 0.75,提示两基因可能在相同的通路中发挥作用;Cofitness值> 0.6,且它们的直系同源物Cofitness值也>0.6,即保守共适应性(Conserved Cofitness),则亦证实紧密功能关系[10-11]。本研究中分别BLAST EmhA、EmhB、EmhC蛋白序列后分析其共适应蛋白及共适应条件。荧光假单胞菌2P24基因组数据取自NCBI,同源序列比对采用软件MEGA7.0完成。
1.2.2rstA基因缺失菌株的构建 本研究中采用两步同源重组法构建基因缺失菌株[9],即以荧光假单胞菌2P24基因组为模板,分别用引物rstAkoUF/rstAkoU-R和rstAkoD-F/rstAkoD-R扩增出rstA上下游同源臂,并利用重叠延伸PCR技术融合[12],随后采用同源重组的方法将该片段构入pK18mobsacB质粒。重组质粒先转化入大肠杆菌Wm3064感受态细胞,过夜培养后经接合转入荧光假单胞菌2P24中,经Kan、Amp各50 μg/mL 的双抗 King’s B(KB)培 养 基[13]( 蛋 白 胨 20 g/L,MgSO4·7H2O 1.5 g/L,K2HPO41.97 g/L,丙三醇10 mL/L)28℃过夜培养后,筛选出载体rstA删除序列与基因组序列发生第一次同源重组成功的菌株并采用引物RstA-F/RstA-R加以验证,随后该菌株于无抗KB培养基28℃培养8 h后利用10%蔗糖无抗KB平板筛选,获得第二次同源重组成功的菌株,经引物RstA-F/RstA-R验证得到rstA基因缺失菌株。
1.2.3 抗生素最小抑制浓度测定 将荧光假单胞菌2P24野生型及ΔrstA菌株以1∶100接种至新鲜KB无抗培养基,28℃过夜培养后测定OD600,以1 OD600≈ 109CFU/mL计数并稀释。准备无菌96孔板,采用2倍稀释法准备不同浓度的抗生素培养基,取100 μL分别加入96孔板第1至第12孔,之后于每孔中加入100 μL稀释后菌液,确保每孔约104-105个细胞,每种抗生素设置三次平行试验,每板设置一个阴性对照组,即以双蒸水代替抗生素,其余操作步骤均相同。将平板置于28℃摇床培养16-18 h后用酶标仪测定每孔的吸光值OD570,获得抗生素对细菌的最小抑菌浓度(Minimum inhibitory concentration,MIC)[14]。
1.2.4emhA及emhC转录水平检测 荧光假单胞菌2P24野生型及ΔrstA菌株以1∶100接种至新鲜无抗KB培养基,于28℃摇至OD600= 0.3。按RNA提取试剂盒说明提取总RNA,确定RNA浓度及纯度后按反转录试剂盒说明获得cDNA并于-20℃保存。设计靶基因emhA(引物AQ-F/ AQ-R)、emhC(引物CQ-F/CQ-R)及参照基因16S rRNA(引物16s-F/16s-R)的qRT-PCR引物,以cDNA为模板,采用Real Master Mix(SYBR Green)试剂盒完成qRT-PCR。最后以ΔΔCT法进行目的基因表达量分析。
1.2.5 β-半乳糖苷酶实验 在pRG970半乳糖苷酶表达基因上游融合emhABC基因的调控序列(引物emhAlacZr-F/emhAlacZr-R)[15],将构建的 pRG970-pemhABC报告质粒经供体菌(大肠杆菌WM3064感受态细胞)接合转入荧光假单胞菌2P24野生型及ΔrstA菌株。上述质粒转入成功的菌株以1∶100接种至新鲜无抗KB培养基,28℃培养至OD600= 0.6后检测β-半乳糖苷酶活性[16]。
1.2.6rstA基因的克隆 以荧光假单胞菌2P24基因组为模板,采用引物RstA-F/RstA-R扩增出rstA全基因序列,将该扩增产物与表达载体pET28b分别使用限制性内切酶NdeI和XhoI进行同步双酶切,凝胶回收后T4连接酶连接并转化至大肠杆菌DH5α,挑选双酶切验证成功的重组表达载体pET28b-rstA送至金唯智测序。
1.2.7 RstA蛋白的表达与纯化 将重组质粒转化到表达宿主BL21(DE3),并转接于50 mL含Kan(50μg/mL)的LB液体培养基中37℃过夜培养。过夜培养物按1∶50转接到1 L含Kan(50 μg/mL)的LB培养基中,37℃培养至OD600为0.6-0.8时,加入终浓度为0.2 mmol/L的IPTG,16℃诱导表达20 h后通过离心收集菌体(8000×g,10 min),而后用30 mL悬浮液(20 mmol/L Tris-HCl,10 mmol/L咪唑,400 mmol/L NaCl,pH 8.0)重悬菌体并超声破碎,经4℃,12 000×g,30 min离心得上清液并采用Ni-NTA亲和柱纯化目标蛋白,挂载的His-RstA蛋白由洗脱液(20 mmol/L Tris-HCl,250 mmol/L咪唑,400 mmol/L NaCl,pH 8.0)洗脱后采用超滤法进行溶液置换,使咪唑浓度低于5 mM,最终将蛋白浓度浓缩至4 mg/mL冻存于-80℃待用。
1.2.8 凝胶阻滞实验 利用引物FAM-emhAp-F/FAM-emhAp-R扩增emhA基因启动子区域,并用NanoDrop2000测定其浓度,将纯化后的DNA片段(0.225 pmol/L)与不同浓度纯化后的His-RstA蛋白在EMSA结合缓冲液中混合,反应的体系为20 μL,于常温下孵育30 min后加入5 μL上样缓冲液,通过6%的非变性PAGE电泳检测结合活性[17]。
2 结果
2.1 转录因子RstA与外排泵EmhABC共适应性分析
采用Cofitness Browser Database 数据平台对EmhABC的共适应蛋白进行预测分析。分别对荧光假单胞菌外排泵EmhABC不同组件EmhA、EmhB、EmhC在该数据库中BLAST后,选择匹配度高且注释显示同为RND外排泵家族的Pf6N2E2_2823(98.1%identity)、Pf6N2E2_2824(98.9%)、Pf6N2E2_2825(99.4%)作为emhABC的功能同源蛋白[11](表2),分别预测其共适应蛋白后结果显示:Pf6N2E2_2823、Pf6N2E2_2824、Pf6N2E2_2825三者之间互为最强共适应关系,Cofitness值及Conserved值均大于0.9;同时,三者共适应物列表中均可见Pf6N2E2_463(注释为转录因子蛋白RstA),共适应强度排名分别为9#、9#、11#(图 1-A),Cofitness值分别为 0.5、0.53、0.53,且Conserved值均大于0.6。同时在Pf6N2E2_463共适应物列表中Pf6N2E2_2823、Pf6N2E2_2824、Pf6N2E2_2825分 别 位 于 列 表 的 11#、7#、8#位,Cofitness值及Conserved值同上。对比Pf6N2E2_463 与 Pf6N2E2_2823、Pf6N2E2_2824、Pf6N2E2_2825在多种生长条件的适应度(Fitness)数据,发现它们的基因缺失突变株对多种有害物质胁迫环境的适应度下降,其中夫西地酸、四环素、洛美沙星、壮观霉素及氯霉素等是它们有着共同适应度改变的胁迫条件,Fitness值均在-1 - -6之间(图1-B)。

表2 EmhABC不同组件同源蛋白
2.2 荧光假单胞菌中rstA同源序列比对
以荧光假单胞菌2P24基因组为检索对象,将Pf6N2E2_463基因序列BLAST后得到序列C0J56_12295,经序列比对明确C0J56_12295(rstA)是Pf6N2E2_463在荧光假单胞菌2P24中的同源序列,序列匹配度(Identity)大于90%。rstA编码序列全长702 bp,编码多肽含有233个氨基酸。RstA蛋白预测分子量为26.30 kD,理论等电点为5.53。
2.3 rstA基因缺失菌株的鉴定
经编码框内删除的方式构建rstA基因缺失菌株(ΔrstA),框内删除后剩余序列约250 bp。如图2(左)示单交换菌落筛选结果,即相比野生型荧光假单胞菌2P24菌株,以引物RstA-F/RstA-R 扩增后分别在700 bp和250 bp显示条带,说明pK18mobsacB载体上包含的rstA编码框内删除后序列已同荧光假单胞菌2P24基因组发生第一次同源重组。随后,经10%蔗糖固体培养基筛选后得到发生第二次同源重组的菌株,如图2(右)示双交换菌落筛选结果,即由引物RstA-F/RstA-R扩增得到两种长度的单一片段,其中若第二次同源重组后回复为野生型菌株,则条带位于700 bp;若位于250 bp附近,则表明rstA编码框内删除后序列已在基因组水平完全取代原序列,ΔrstA菌株构建成功。
2.4 RstA直接影响荧光假单胞菌多重耐药性
抗生素最小抑制浓度(MIC)测定显示,相较于荧光假单胞菌2P24野生型菌株,ΔrstA菌株对多种抗生素敏感性增加,其中氯霉素、卡那霉素及庆大霉素对ΔrstA的MIC值均降低4倍,强力霉素降低8倍;而氨苄霉素、四环素、洛美沙星和美罗培南对ΔrstA的MIC值下降不显著,降低2倍或不变(表3)。可见RstA能够直接影响荧光假单胞菌2P24对多种抗生素胁迫环境的耐受。

图1 外排泵EmhABC与转录因子RstA的共适应分析
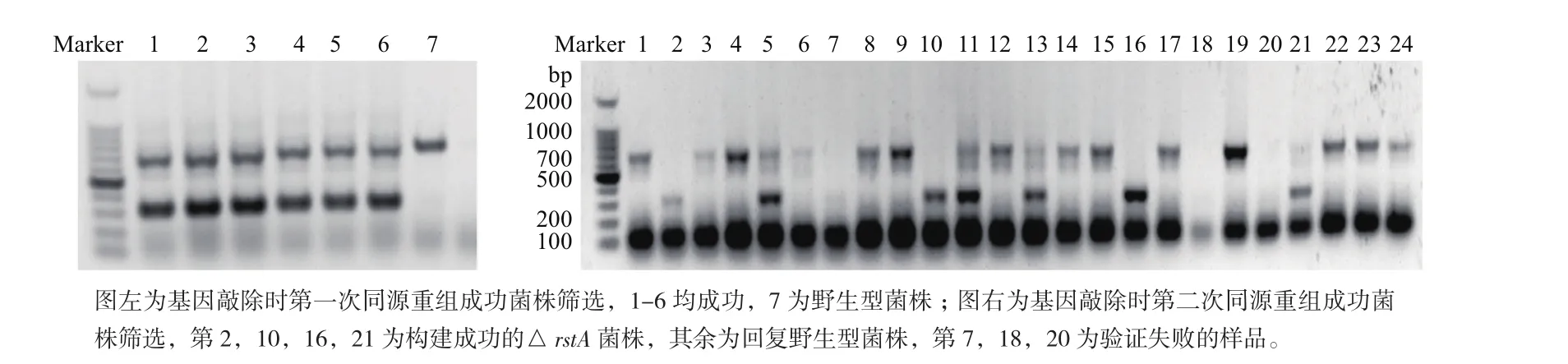
图2 rstA基因缺失菌株的构建
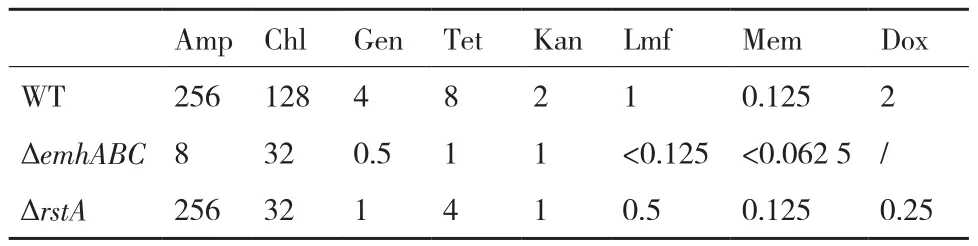
表3 多种抗生素对三种菌株的MIC值(μg/mL)
2.5 RstA正向调节emhABC的表达
ΔrstA菌株中emhA与emhC基因的mRNA水平较野生型下降超过3倍(图3);同样,β-半乳糖苷酶报告基因实验也显示,ΔrstA菌株中β-半乳糖苷酶的活性较野生型下降3倍(图4)。该结果表明RstA对emhABC有正向调控作用。
2.6 RstA蛋白的表达与纯化
构建pET28b-rstA重组质粒并转化至表达宿主菌BL21中,经IPTG诱导,如图5可见27 kD处有一明显条带,说明目标蛋白His-RstA已成功表达。经固定金属离子亲和色谱的方法对His标签蛋白纯化后得到如图所示高纯度His-RstA蛋白。

图3 qRT-PCR检测emhA、emhC基因转录水平
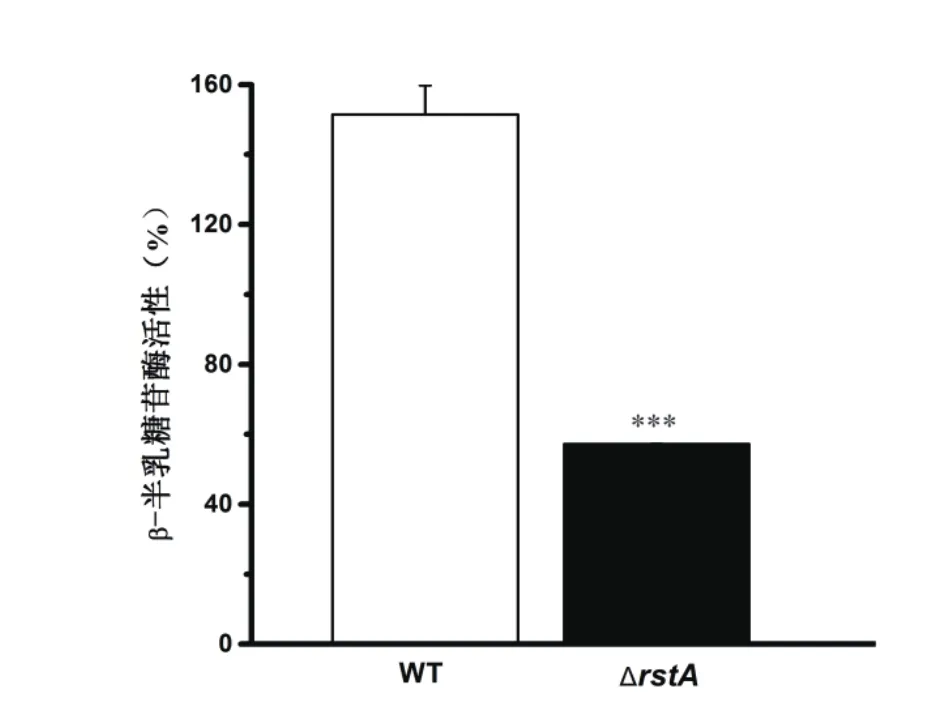
图4 β-半乳糖苷酶实验检测emhABC表达水平
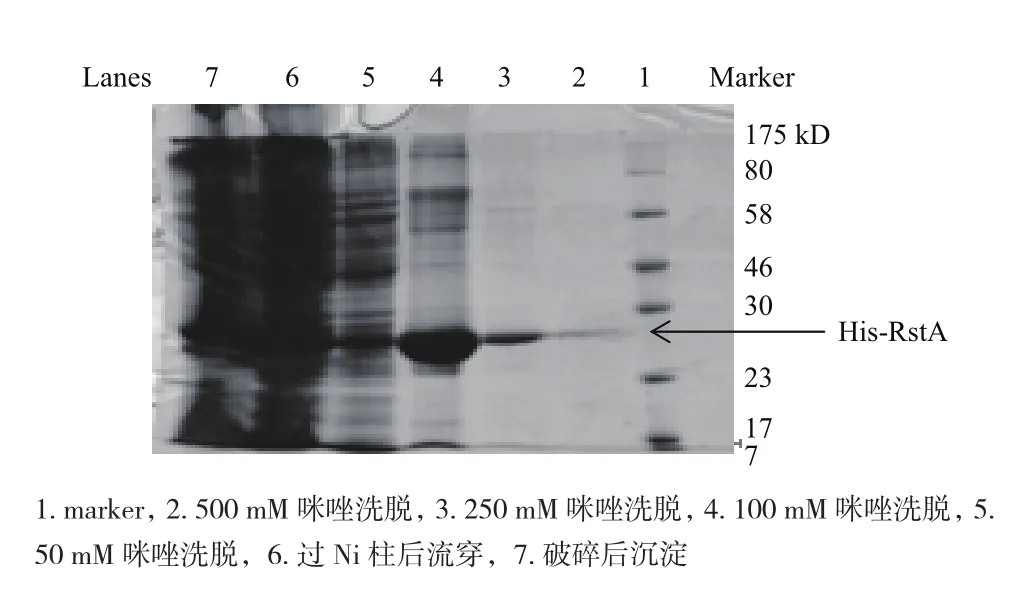
图5 His-RstA蛋白纯化SDS-PAGE电泳图

图6 重组蛋白His-RstA与启动子区域结合活性
2.7 凝胶阻滞实验
凝胶阻滞实验结果(图6)显示:随着RstA蛋白浓度的升高,emhABC基因上游调控区内长度为0.225 pmol/L DNA片段的迁移速率逐渐降低,当蛋白质终浓度达到4 μmol/L时,反应体系中大部分DNA的迁移被阻滞,表明RstA能够特异性地结合在emhABC启动子区域。
3 讨论
荧光假单胞菌2P24最早分离自山东省小麦根际周围的土壤中[18],目前大多研究主要针对其次级代谢产物2,4-二乙酰基间三苯酚的产生与调节[16,19]、群体感应效应对其在植物根际定植的影响[20]、抗生素合成调节[21]及三型分泌系统结构功能[22]等方面展开。EmhABC是目前报道荧光假单胞菌2P24中最重要的RND家族外排泵,张立群课题组研究发现,EmhABC不仅参与调控次级代谢产物2,4-二乙酰基间三苯酚的产生,还显著影响细菌对多种毒性小分子的耐受性[9]。为了进一步明确荧光假单胞菌2P24对该重要外排泵的调控机制,我们借助Cofitness Browser数据库及序列比对,发现OmpR家族转录因子RstA同EmhABC存在共适应性,二者对多种抗生素胁迫环境的适应贡献相似。因此,我们推测RstA很可能同EmhABC位于同一调控通路。为了证实这一猜想,我们首先构建了rstA基因缺失菌株,明确RstA直接影响荧光假单胞菌2P24对多种抗生素的耐药性。之后,通过对emhA、emhC转录水平及emhABC表达水平的检测,证实RstA能够正向调控emhABC的表达,这也同共适应性预测结果及抗生素敏感性测定实验的结果相一致。
OmpR家族成员均为DNA结合蛋白,属于翼状螺旋转录因子,其蛋白折叠模式很保守,即包含有与DNA大沟相互作用的识别螺旋,及与DNA小沟接触的侧环或“侧翼”,常结合于靶基因启动子区域发挥转录调控作用[23]。OmpR家族成员几乎均为双组分系统中的反应调节蛋白(Response regulator,RR)组分,常与同源的组氨酸激酶蛋白(Histidine kinase,HK)组分一起参与微生物对外界环境的感受和应答[24]。RR常经磷酸化后发生构象改变而获得功能活性,并进一步发挥调控作用[25]。据报道,OmpR家族RR常通过发生二聚体化结合在DNA启动子区的串联重复序列,进而发挥转录激活或抑制功能[26]。
根据NCBI中的功能预测注释,RstA属于RR,为了进一步明确RstA对emhABC的调控机制,我们表达纯化出RstA蛋白,并通过凝胶阻滞实验证实RstA能够特异性地结合在emhABC上游启动子区域,表明RstA能够直接与emhABC启动子区发生相互作用,但其中更为深入的作用机制,如二者的互作位点、RstA同源HK在其中扮演的角色及RstA的效应模式是否符合OmpR家族RR的常规工作模式等仍需深入研究。当然,RstA是否还参与调控其他生理功能也需要进一步探索。观察ΔrstA与ΔemhABC相较于野生型对各抗生素的敏感性变化不难发现,二者的抗性变化谱存在一定差异,因此我们推断RstA很可能还通过调控其他外排泵影响细菌的多重耐药性。
4 结论
本研究以荧光假单胞菌2P24为研究对象,发现了一个新的OmpR家族转录因子RstA并对其进行功能鉴定。结果表明,RstA通过结合在emhABC上游启动子区域正向调控emhABC的表达,并可能经多个途径影响荧光假单胞菌2P24的多重耐药性。
