昆仑胎菊水溶性黄酮提取工艺优化及其对衰老小鼠肝组织SIRT1、p53表达的影响
2019-07-26李福香李富华赵吉春曾凯芳
田 勇,郅 琦,李福香,李富华,2,赵吉春,2,曾凯芳,2,明 建,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
两色金鸡菊(Coreopsis tinctoria Nutt.)属于菊科(Compositae)金鸡菊属(Coreopsis),是一种广泛分布于世界各地的小型、无毛、芳香类一年生草本植物[1]。在中国,因其生长在新疆南部海拔3 000 m以上的喀喇昆仑山脉常年积雪高山区域而被当地人称为“昆仑雪菊”或“昆仑雪茶”。它的干燥花蕾被称为昆仑胎菊(C. tinctoria buds),不仅用作花茶类饮料,还用作维传统医学中治疗高血压和高脂血症的民间药物[2-3]。植物化学研究表明,雪菊含有多种生物活性物质,包括黄酮类、酚类、苯丙素类、聚乙炔糖苷和甾醇等,其中黄酮类化合物含量最为丰富,是其主要的功能活性成分[2,4-5]。目前,国内外研究者们对雪菊黄酮类化合物的提取条件和工艺进行了部分研究,初步判断出其主要黄酮类物质包括总黄酮、水溶性黄酮、原花青素等[6-8]。昆仑胎菊在日常生活中主要作为花茶冲泡饮用,所以其水溶性黄酮的提取及功能活性研究更加值得关注。
沙爱龙等[9]研究发现雪菊黄酮可显著减缓动物脑和器官的萎缩和退化过程,促进新陈代谢,提高免疫功能,证明其具有抗衰老功能。Zhang Weixin等[10]研究发现雪菊水提取物显著提高D-半乳糖致衰老小鼠体内的抗氧化防御功能,从而延缓衰老。以上研究表明,昆仑雪菊黄酮具有良好的抗衰老作用,但对其作用机制研究尚不深入。沉默信息调节因子1(silent information regulator 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸依赖性核组蛋白去乙酰化酶,参与多种生理过程的调节,包括衰老、DNA修复、细胞周期、新陈代谢、应激条件下的细胞存活等[11-12]。p53是一种肿瘤抑制因子,可被许多应激物激活,诱导细胞凋亡、细胞周期停滞或衰老,在衰老过程中也起着重要作用[13-14]。研究表明,SIRT1的激活对衰老调节因子p53有明显的抑制作用,从而减少细胞凋亡,延缓衰老[15-16]。
本实验以干燥昆仑胎菊为原料,利用水浸提其水溶性黄酮,并采用响应面法优化浸提工艺。同时,通过D-半乳糖致衰老小鼠模型,探讨优化工艺提取条件下制备的昆仑胎菊水溶性黄酮(C. tinctoria buds water soluble flavonoids,CBF)对衰老小鼠肝组织SIRT1、p53表达的影响,以期为深入研究昆仑胎菊的营养价值及保健功能提供理论基础。
1 材料与方法
1.1 材料、试剂与动物
昆仑胎菊由新疆维吾尔自治区中医院提供,并经主任医师赵生俊鉴定。
芦丁标准品(色谱级)、D-半乳糖(分析纯)美国Sigma-Aldrich公司;SIRT1抗体、p53抗体 美国Proteintech公司;BCA蛋白定量检测试剂盒、抗兔二抗武汉赛维尔生物科技有限公司;乙醇、NaOH、NaNO2、Al(NO3)3均为国产分析纯。
60 只SPF级昆明小鼠(雌雄各半,(20±2)g)购于重庆市中药研究院,动物生产许可证为SCXK(渝)2017-003。
1.2 仪器与设备
HH-6数显恒温水浴锅 金坛市富华仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;VIS-722紫外-可见分光光度计 上海精科科学仪器有限公司;FA1004A电子天平 上海精天电子仪器有限公司;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;DF8517超低温冷冻储存箱(-80 ℃) 韩国Ilshin公司;RM2016病理切片机 上海徕卡仪器有限公司;HI1220烤片机 德国LEICA公司;DYCZ-24DN双垂直电泳仪 北京六一仪器厂;LC-20A高效液相色谱仪(配有二极管阵列检测器) 日本岛津公司。
1.3 方法
1.3.1 总黄酮提取量的测定
参照吴瑛等[17]的方法进行。以芦丁制作标准曲线:称取芦丁标准品11.2 mg,置于50 mL容量瓶中,加适量体积分数60%乙醇溶液,水浴加热使之溶解,并定容至刻度,即得到0.224 mg/mL的对照品溶液。移取对照品溶液0、1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL容量瓶中,并用蒸馏水定容至6 mL。加入1 mL的50 g/L NaNO2溶液,摇匀后静置6 min;加入1 mL的100 g/L Al(NO3)3溶液,摇匀后静置6 min;加入10 mL的40 g/L NaOH试液,加蒸馏水稀释至刻度,摇匀后静置15 min。以不加样品溶液为空白对照,于波长510 nm处测定各标准溶液吸光度。以吸光度(Y)为纵坐标,芦丁对照溶液质量浓度(X,μg/mL)为横坐标,绘制标准曲线,得到回归方程为Y=0.012 6X-0.006 1(R2=0.999 6)。在芦丁质量浓度0~53.76 μg/mL范围内,质量浓度与吸光度呈良好的线性关系。
总黄酮提取量的测定:移取1 mL适当稀释倍数的样品溶液,加蒸馏水至6 mL,以不加样品溶液为空白,按芦丁标准曲线制作步骤处理后,在波长510 nm处测得吸光度,带入标准曲线回归方程,并按下式计算昆仑胎菊水提取液中总黄酮提取量:

式中:C1为根据标准回归方程计算的黄酮质量浓度/(mg/mL);N1为稀释倍数;V1为样品溶液总体积/mL;m1为样品质量(干基)/g。
1.3.2 CBF提取的单因素试验
采用水溶剂提取法提取昆仑胎菊中水溶性黄酮类化合物,称取3 g昆仑胎菊(干质量),固定其他条件,分别考察水提时间(2、5、8、11、14、17 min)、水提温度(75、80、85、90、95、100 ℃)、液料比(50∶1、60∶1、70∶1、80∶1、90∶1、100∶1(mL/g))3 个因素对昆仑胎菊总黄酮提取量的影响。
1.3.3 响应面分析法优化提取条件
根据单因素试验结果,采用Box-Behnken试验设计原理,以水提时间、水提温度、液料比为自变量,提取液中总黄酮提取量为响应值,进行3因素3水平的响应面分析,优化CBF提取条件。各因素水平编码见表1。

表1 响应面试验自变量因素与水平Table 1 Independent variable and levels used in response surface analysis
1.3.4 CBF的高效液相色谱分析
1.3.4.1 色谱条件
参照Liang Qian等[18]的方法,稍作修改。采用BDS C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为乙腈、B为体积分数0.1%甲酸溶液;流速0.7 mL/min;进样量10 μL;柱温40 ℃;LC-20A二极管阵列检测器;色谱数据在200~600 nm波长范围内扫描,检测波长280 nm。梯度洗脱程序如表2所示。

表2 高效液相色谱洗脱条件Table 2 Elution conditions for HPLC
1.3.4.2 标准品溶液制备
准确称取绿原酸、黄诺马苷、儿茶素、花旗松素和马里苷标准品各5.0 mg,用色谱甲醇溶解并分别定容于5 mL棕色容量瓶中,配制成1 mg/mL标准储备液,并稀释成不同质量浓度溶液(0、10、40、70、100、200、400 μg/mL),经0.45 μm有机滤膜过滤,备用。按照上述的色谱条件制作标准曲线。以标准品液质量浓度(μg/mL)为横坐标(x),以峰面积为纵坐标(y),绘制标准曲线,分别得到回归方程:y绿原酸=24 279x-99 047,R2=0.999 1;y黄诺马苷=17 868x-72 736,R2=0.999 2;y儿茶素=16 162x-53 422,R2=0.999 3;y花旗松素=29 328x-75 521,R2=0.999 5;y马里苷=10 549x-18 026,R2=0.999 5;在0~400 μg/mL线性关系良好。结果以干质量表示(mg/g)。
1.3.5 动物分组与给药
用于动物模型给药处理的CBF浓缩制备:称取10 g干燥昆仑胎菊,按照响应面优化得到的最优工艺条件提取3 次,每次提取液过滤后合并滤液。在减压旋转蒸发仪中45 ℃旋转蒸发浓缩后,真空冷冻干燥成棕褐色粉末。按照1.3.1节方法测定其总黄酮含量占(35.27±1.81)%。用药处理时用灭菌生理盐水溶解稀释到相应的黄酮浓度。参考Zhang Weixin等[10]的方法建立衰老小鼠模型,小鼠随机分为5 组,每组12 只,除正常对照组外,其余4 组每日颈背部皮下注射D-半乳糖(无菌生理盐水溶解,300 mg/(kg·d)),连续造模45 d。每日D-半乳糖造模后,每组分别进行给药灌胃处理,小鼠分组及给药情况如表3所示。小鼠体质量每隔7 d称量一次。

表3 各组小鼠的基本给药情况Table 3 Animal grouping and administration protocol
1.3.6 小鼠一般行为学的观察及肝组织样品的制备
造模给药期间每天观察并记录各组小鼠的一般行为学变化,包括进食、皮肤、毛色、活动和精神等情况。小鼠造模45 d后,禁食不禁水24 h,颈椎脱臼处死,迅速摘取小鼠肝脏组织,用预冻4 ℃灭菌生理盐水分别洗净淤血。将肝组织分为2 份,一份固定在福尔马林中,用于制备石蜡切片(4 μm);另一份液氮冻存于-80 ℃冰箱,用于测定衰老相关蛋白表达。
1.3.7 肝组织切片的制作及病理学形态观测
新鲜肝组织→放入10%福尔马林试剂固定24 h→分别经体积分数为75%、85%、90%、95%乙醇溶液脱水处理4、2、2、1 h→无水乙醇I 30 min→无水乙醇II 30 min→醇苯5~10 min→二甲苯I 5~10 min→二甲苯II 5~10 min→石蜡包埋组织块→石蜡切片机切片厚4 μm→烤片→石蜡切片脱蜡复水→苏木素染液染3~5 min→分化液分化→返蓝液返蓝→流水冲洗→切片依次入体积分数85%、95%的梯度乙醇脱水各5 min→入伊红染液中染色5 min→切片依次放入无水乙醇I、II、III和二甲苯I、II各5 min→中性树胶封片→显微镜镜检(×200),图像采集分析[19]。
1.3.8 肝组织中SIRT1、p53蛋白表达水平
采用Western blot法测定。称取适量肝组织,加入蛋白酶抑制剂和蛋白裂解液,彻底匀浆,离心,提取总蛋白。BCA蛋白定量试剂盒检测蛋白浓度,加热使之变性,每个蛋白样品等量(30 μg)进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,电泳后将蛋白转印至PVDF膜上,用5%的脱脂牛奶封闭1 h后,加入稀释一抗(SIRT1、p53)4 ℃孵育过夜,TBST洗3 次,加二抗(TBST稀释3 000 倍)室温下孵育30 min,TBST洗3 次,ECL化学发光法显影曝光,扫描记录,采用alphaEaseFC软件测定条带灰度值[20]。
2 结果与分析
2.1 单因素试验结果
2.1.1 水提时间对总黄酮提取量的影响

图1 水提时间对总黄酮提取量的影响Fig. 1 Effect of extraction time on the yield of flavonoids from C. tinctoria buds
由图1可知,在水提时间2~17 min的范围内,随着时间的延长,昆仑胎菊总黄酮的提取量均呈现逐渐增加的趋势。但考虑到日常生活中昆仑胎菊用于茶饮的水提时间一般不会超过15 min,故选择水提时间14 min较佳。
2.1.2 水提温度对总黄酮提取量的影响

图2 水提温度对总黄酮提取量的影响Fig. 2 Effect of extraction temperature on the yield of flavonoids from C. tinctoria buds
由图2可知,在水提温度75~100 ℃的范围内,随着温度的增加,昆仑胎菊总黄酮的提取量呈现逐渐增加的趋势,当温度达到95 ℃以上,总黄酮提取量的增加不明显。因此选择水提温度95 ℃较为合适。
2.1.3 液料比对总黄酮提取量的影响

图3 液料比对总黄酮提取量的影响Fig. 3 Effect of water-to-material ratio on the yield of flavonoids from C. tinctoria buds
由图3可知,在液料比为50∶1~100∶1的范围内,随着液料比的增加,昆仑胎菊总黄酮的提取量呈现先增加后减少的趋势,当液料比为70∶1(mL/g)时,总黄酮提取量达到最高值。因此最合适的液料比为70∶1。
2.2 响应面分析法优化试验
2.2.1 响应面试验结果与方差分析
在单因素试验结果基础上,采用Design-Expert 8.0.6软件进行响应面试验设计及数据分析,以考察各因素间的交互作用以及优化最佳提取工艺,结果见表4。对表4的试验数据进行多元回归拟合,得到总黄酮提取量对水提时间(A)、水提温度(B)和液料比(C)的二次回归模型方程为:
总黄酮提取量=-2 191.079 28+28.798 36A+36.740 05B+9.382 85C-0.163 97AB-0.010 747AC-0.045 800BC-0.385 66A2-0.160 00B2-0.033 759C2

表4 响应面试验设计及结果Table 4 Experimental design and results for response surface analysis
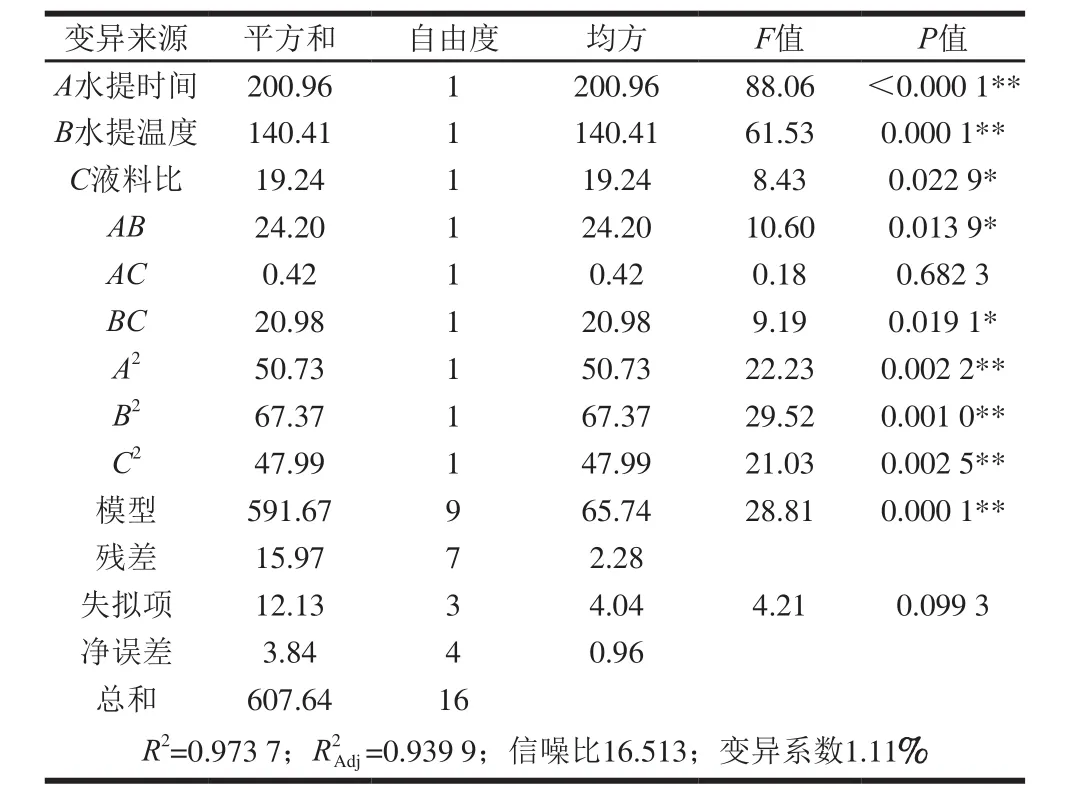
表5 响应面回归模型的方差分析Table 5 Analysis of variance (ANOVA) for the yield of flavonoids against various extraction conditions
对此模型进行回归方差分析,由表5可知,总黄酮提取试验设计的整体模型呈现极显著水平(P<0.01),失拟项不显著(P>0.05),表明模型选择合适。回归模型的一次项、二次项均显著,交互项AB、BC显著,AC不显著。表明各因素对于昆仑胎菊提取过程中总黄酮提取量的影响并不是简单的线性关系。由F值可知,各因素对总黄酮提取量影响大小顺序为水提时间(A)>水提温度(B)>液料比(C)。回归方差分析结果表明,该模型的复相关系数R2为0.973 7,模型校正决定系数R2Adj为0.939 9,表明此模型可以解释93.99%响应值的变化,仅有总变异的6.01%,不能用此模型来解释。模型的变异系数为1.11%,较小,表明试验结果重复性较好。此外,模型的信噪比较高(为16.513),表明此模型的拟合度和可信度较好,可用于预测和优化CBF提取工艺的实验结果[21-22]。
2.2.2 响应面分析
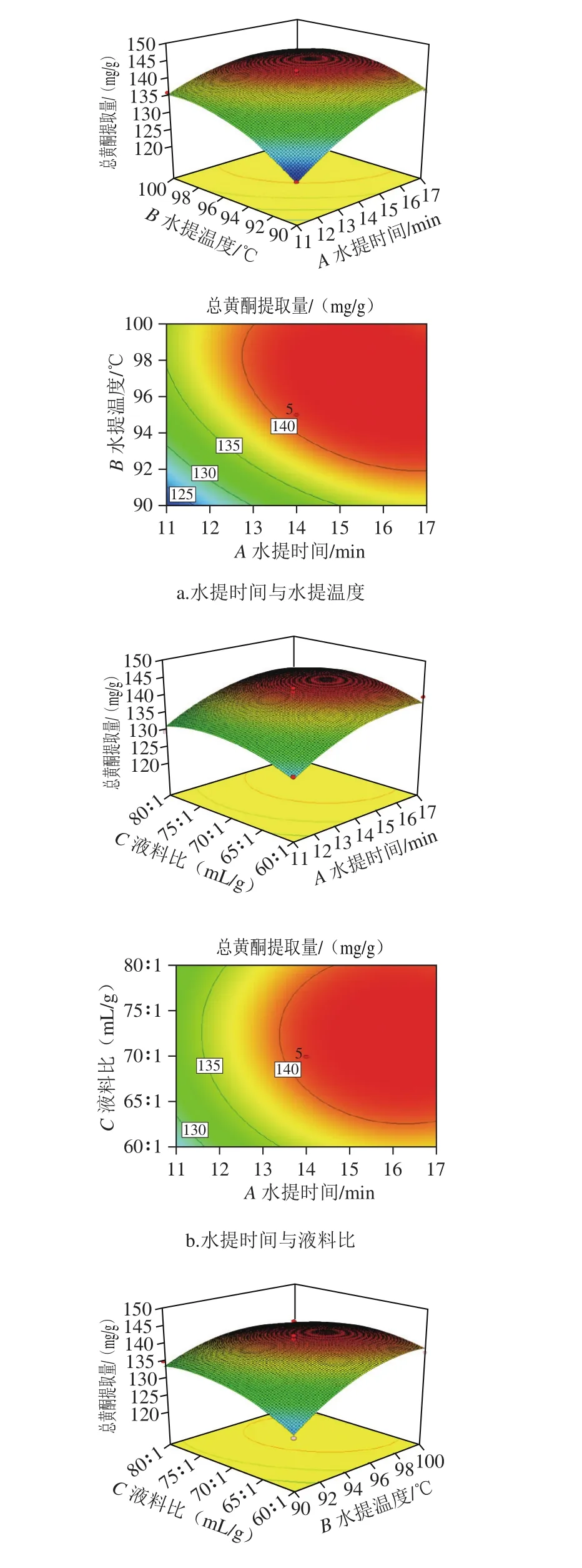

图4 各因素交互作用对总黄酮提取量的影响Fig. 4 Response surface and contour plots showing the interactive effects of three extraction parameters on the yield of flavonoids from C. tinctoria buds
为了更直观反映各因素对昆仑胎菊总黄酮提取量的影响以及最佳工艺参数和参数间的交互作用,采用响应面及其等高线图分析,如图4所示。图4可以直观地反映出水提时间、水提温度和液料比3 个因素之间的交互作用对昆仑胎菊水溶性总黄酮提取量的影响。响应面陡峭表明该因素对总黄酮提取量的影响较强,曲面平缓表明影响较弱;等高线的形状可反映出各因素间交互效应的强弱,趋于椭圆形表明两因素的交互作用显著,而圆形表明不显著[23-24]。由图4可知,比较响应面的陡峭程度为水提时间(A)>水提温度(B)>液料比(C),表明各因素对总黄酮提取量影响大小顺序为水提时间(A)>水提温度(B)>液料比(C),其结论同表5方差分析结论一致;比较3 个因素交互作用的等高线:AB椭圆形,AC圆形,BC椭圆形,表明水提时间与水提温度、水提温度与液料比交互作用显著,水提时间与液料比交互作用不显著,其结论同表5方差分析结论一致。
2.2.3 提取工艺条件的优化及验证
根据Box-Behnken试验设计获得的结果和二次回归方程,利用Design-Expert软件优化分析得到总黄酮的最佳提取条件为:水提时间15.39 min、水提温度95.89 ℃、液料比71.04∶1(mL/g),在此条件下预测的总黄酮提取量为143.04 mg/g,结合实际操作,选取最佳条件的近似值,即水提时间15 min、水提温度96 ℃、液料比71∶1(mL/g)进行3 次重复验证实验,得到总黄酮提取量为(145.45±4.60)mg/g,与理论预测值相比,相对误差仅为1.68%,表明该回归模型优化得到的提取工艺条件实际有效。
2.2.4 CBF的高效液相色谱分析
研究表明,昆仑胎菊的活性成分主要是黄酮类化合物[2-3]。由图5所示,CBF包含绿原酸(0.94±0.09) mg/g、黄诺马苷(13.64±0.13)mg/g、儿茶素(2.22±0.11)mg/g、花旗松素(2.11±0.10) mg/g和马里苷(13.39±0.34)mg/g,表明CBF的主要活性成分由酚酸和黄酮类化合物组成,其中黄酮类化合物种类更多且含量更高。
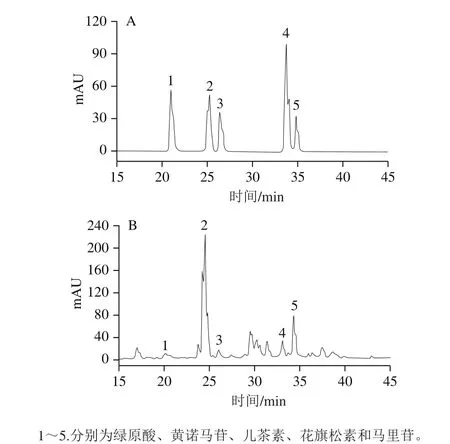
图5 标准品(A)与CBF(B)色谱图Fig. 5 Chromatograms of reference substances of CBF (A) and flavonoid composition of CBF (B)
2.3 CBF对衰老小鼠体质量及一般行为学的影响

图6 CBF对衰老小鼠体质量变化的影响Fig. 6 Effect of CBF on body mass changes of aging mice
D-半乳糖长期注射导致衰老小鼠动物模型是抗衰老理论及药理学研究的经典方法[25-26]。D-半乳糖造衰老小鼠模型期间,观测小鼠体质量的增长变化情况可反映其生长发育及健康状况[27]。由图6所示,随着衰老造模期间的延长,各组小鼠体质量均有所增加。衰老模型组小鼠体质量增长逐渐缓慢,并出现精神萎靡、反应迟钝、行动缓慢、皮肤松弛、毛色灰暗粗糙、经常脱毛炸毛、经常扎堆嗜睡、活动量明显减少等一般行为学状况。从第7天开始,衰老模型组小鼠体质量低于正常组,呈显著性差异(P<0.05),并且差异随时间延长呈逐渐增大的趋势。整个实验期间,阳性对照组(VE)和高剂量组(CBF-H)小鼠体质量与正常组之间无显著差异(P>0.05),同时衰老小鼠在精神状况、行动、皮肤及毛发等状态方面均得到一定改善。这说明CBF对小鼠生长发育无不良影响且可改善衰老小鼠的行为状况,具有抗衰老作用[28]。
2.4 CBF对衰老小鼠肝脏病理学形态变化的影响

图7 CBF对衰老小鼠肝组织形态学的影响(HE染色,×200)Fig. 7 Effect of CBF on liver tissues of aging mice observed by HE staining (× 200)
大量研究表明,许多天然成分的用药处理能在D-半乳糖诱导的动物衰老模型中发挥有效的保肝作用[29-30]。如图7所示,正常组小鼠肝组织显示出正常的结构和明显的肝细胞边界,没有充血现象。与正常组小鼠相比,衰老模型组小鼠肝组织切片显示出明显的损伤,表现出几种类型的病理损伤,如细胞间隙增大(长箭头)和气球样变性(短箭头)。此外,肝细胞还观察到其他损伤,如局灶性坏死,纤维化,淋巴细胞浸润等。CBF的灌胃给药有效地改善了D-半乳糖引起的肝脏异常变化。在VE组和低剂CBF-L组中,可观察到肝脏细微充血,气球样变性和纤维化的改善;CBF-H组的改善效果更显著,小鼠肝脏的组织病理学形态与正常组没有明显差异。结果表明,CBF对D-半乳糖引起的衰老小鼠肝损伤有一定抑制作用。
2.5 CBF对衰老小鼠肝脏SIRT1、p53蛋白表达的影响
大量研究表明,SIRT1与p53基因参与衰老过程的调节[15-16]。如图8A所示,衰老模型组小鼠肝组织中SIRT1蛋白表达量显著低于正常组(P<0.05),降低了57.75%。与衰老组相比,VE及CBF高低剂量给药处理均能显著地提高衰老小鼠肝组织SIRT1蛋白表达(P<0.05),VE、CBF-L和CBF-H组分别提高了106.99%、160.45%和279.02%。如图8B所示,衰老模型组小鼠肝组织中p53蛋白表达量显著高于正常组(P<0.05),提高了390.13%。与衰老组相比,除CBF-L组降低效果不显著外,VE及CBF-H能显著降低衰老小鼠肝组织p53蛋白表达(P<0.05),VE、CBF-L和CBF-H组分别降低了23.22%、12.25%和30.90%。结果表明,CBF抑制衰老作用可能与激活SIRT1/p53信号通路有关。
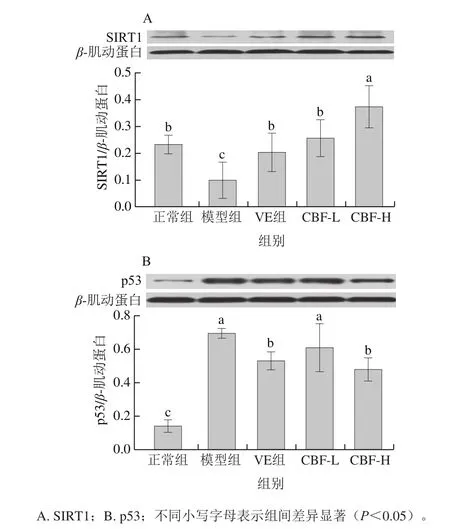
图8 CBF对衰老小鼠肝组织中SIRT1、p53蛋白表达的影响Fig. 8 Effect of CBF on protein expression levels of SIRT1 and p53 in liver tissues of aging mice
3 结 论
本实验以昆仑胎菊为原料,采用水溶剂提取法对其水溶性总黄酮进行提取并通过响应面法优化提取工艺,即水提时间15 min、水提温度96 ℃、液料比71∶1(mL/g),在此最优条件下进行验证得到提取液中的总黄酮提取量可达到145.45 mg/g,与理论预测值的相对误差仅为1.68%,表明该回归模型合理可靠,优化得到的提取工艺条件实际有效。
本实验同时研究CBF对D-半乳糖致衰老小鼠的抗衰老作用及其对衰老小鼠肝组织中SIRT1、p53蛋白表达的影响。造模过程观测各组小鼠体质量变化和一般行为学状态表明,CBF对小鼠生长发育无不良影响且可改善衰老小鼠的行为状况;各组小鼠肝组织病理学形态观测表明,VE和CBF能显著改善D-半乳糖引起的肝组织异常变化,特别是CBF-H组小鼠肝组织细胞结构完整,几乎没有充血现象,与正常组小鼠肝组织细胞基本一致;Western blot法分析各组小鼠肝组织SIRT1、p53蛋白表达情况表明,CBF能显著提升衰老小鼠肝组织中SIRT1蛋白表达(P<0.05),有效抑制D-半乳糖引起的p53过量表达(P<0.05)。以上结果说明CBF具有良好的抗衰老作用,其作用机理可能与激活SIRT/p53信号通路有关。
本实验以响应面法优化确定CBF的提取工艺,并初步探讨其抗衰老作用机制,为昆仑胎菊实际应用及食药作用的进一步研究提供理论基础。
