氯化钙对食品致腐荧光假单胞菌生物被膜形成的影响
2019-07-26樊洁敏王雅莹朱军莉陆海霞
樊洁敏,唐 蓉,王雅莹,朱军莉*,陆海霞
(浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江 杭州 310018)
荧光假单胞菌(Pseudomonas fluorescens)是一种好氧或兼性厌氧的革兰氏阴性菌,无菌毛,有数根极端鞭毛,广泛存在于水生环境和食品中,是牛奶、肉制品、水产品等富含蛋白和脂类食品中重要嗜冷腐败菌[1]。研究表明,荧光假单胞菌分泌的蛋白酶和酯酶等代谢产物难以用瞬时高温灭活,导致冷藏食品的风味等理化性质变化[2]。在食品环境中假单胞菌还常在生产设备表面形成生物膜,生物被膜成为假单胞菌的寄所,被膜菌对食品加工过程中各种环境压力(低温、酸、盐、消毒剂)的抵抗力都有所提高。因此,致腐被膜菌是一种生产加工中生物危害的潜在污染源[3]。
自然界中大部分微生物并非以单个浮游状态存在,多以群体生物被膜形式生存。生物被膜是微生物黏附于物体(或人体组织)表面,通过分泌的多糖基质、蛋白质、核酸等构成的胞外聚合物共同组成高度组织化的三维结构[4]。根据微生物黏附介质可以将生物被膜分为固液被膜、气固被膜、气液被膜(薄膜)3 种形式[5]。生物被膜的形成受鞭毛[6]、胞外多聚物等内在条件,及菌种、营养条件[7]、温度[8]、接触介质[8]类型等外部因素的影响。食品中含有多种金属元素,而环境中金属离子能影响细菌生物被膜的形成和发展。研究表明,0.5 mmol/L Cu2+能减弱嗜水气单胞菌生物被膜形成和毒力[9],添加0.05% Mn2+、Ca2+、Fe2+对单增李斯特菌生物被膜无影响,而Cu2+可抑制被膜形成及胞外多糖分泌[10],Mg2+、Cu2+、Fe3+在0.25%~1.5%范围都能抑制副溶血性弧菌生物被膜形成[11]。目前,仅报道环境金属离子影响不同种属细菌的生物被膜形成存在差异影响,而未对作用浓度及机制进行深入研究。海产品和奶制品富含钙质,已报道Ca2+在0.5%和1%条件下分别能促进副溶血性弧菌[8]和铜绿假单胞菌[12]的生物被膜形成,在2.5~6.5 mmol/L浓度条件下显著刺激嗜水气单胞菌的被膜[13]。然而,Ca2+对水产品致腐菌荧光假单胞菌生物被膜形成的影响仍鲜见报道。
鉴于此,本研究分析不同浓度CaCl2对荧光假单胞菌生物被膜、胞外聚合物、薄膜形成、细胞运动性的影响,并观察Ca2+作用下生物被膜结构的变化,实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测被膜相关基因动态变化,从多角度探究Ca2+对荧光假单胞菌被膜形成的调控作用,旨在阐明食品中内源成分影响腐败菌生物被膜的作用及机制。
1 材料与方法
1.1 材料与试剂
荧光假单胞菌PF07分离于腐败冷藏大黄鱼,被鉴定为特定腐败菌,16S RNA登录号KT716389。
LB肉汤、PCA琼脂和泳动性培养基(胰蛋白胨1%,NaCl 0.5%,琼脂0.3%) 青岛海博生物有限公司;CaCl2阿拉丁有限公司;荧光染料SYTO9美国Thermo Fisher公司;96、24、6 孔细胞培养板美国Costar公司。
1.2 仪器与设备
LRH-250A型生化培养箱 上海一恒科技有限公司;VICTOR X酶标仪 美国Perkin Elmer公司;台式高速冷冻离心机 美国Sigma公司;LSM 710共聚焦扫描显微镜 德国Zeiss公司;QuantStudioTM6Flex实时荧光定量PCR仪 美国Life Technologies公司。
1.3 方法
1.3.1 菌株活化培养
将-80 ℃保藏的荧光假单胞菌甘油菌划线于LB平板,在28 ℃培养过夜24 h后,挑去单菌落接种于LB培养基。在28 ℃、200 r/min过夜活化2 次后,离心收集菌体,采用比浊法用无菌生理盐水将菌体浓度准备至约108CFU/mL,待用。
1.3.2 浮游菌和生物被膜测定
分别配制含0、0.1、1、10、20 mmol/L CaCl2的LB肉汤,灭菌,按1%将活化备用的PF07菌接种到不同浓度CaCl2的LB肉汤,将接种的肉汤添加至96 孔板,每个浓度加5 个孔,每孔200 µL。28 ℃静置培养2~4 h后,取培养物进行系列稀释,挑去合适的稀释度涂布平板计数琼脂,在28 ℃培养48 h计数,计算浮游菌的生长。同时参考Djordjevic等[14]方法用结晶紫法测定被膜含量,将孔板轻轻倒去上清液,用灭菌的磷酸缓冲液清洗2 次后,干燥,用结晶紫染色15 min,清洗干燥,加入33%冰醋酸静置5 min,用酶标仪测定590 nm波长处OD值。
1.3.3 细菌的胞外多糖测定
将1.3.2节中已接种PF07菌的不同浓度CaCl2-LB肉汤,分别添加至6 孔板,每个浓度加3 个孔,每孔9 mL。28 ℃静置培养12 h和24 h后取出,去菌悬液后,用磷酸缓冲液重悬菌体,用细胞破碎仪在50 kHz超声5 min后,在80 ℃水浴30 min,4 ℃离心(15 000×g,30 min),用0.22 µm滤膜过滤。采用苯酚-硫酸法[15]测定被膜胞外多糖含量。
1.3.4 细菌薄膜观察
将1.3.2节中已接种PF07菌的不同浓度CaCl2-LB肉汤,分别添加至24 孔板,每孔2 mL。菌液在28 ℃静置培养12、24、36 h和48 h后取出孔板。参考Marsden等[16]用无菌牙签挑破薄膜,透光进行薄膜的透明度、黏稠性和厚度等定性观察。
1.3.5 细菌泳动性观察
参考Sperandio等[17]的方法,配制含0、0.1、1、10、20 mmol/L不同浓度CaCl2的泳动培养基(1%胰蛋白胨、0.5%氯化钠、0.3%琼脂),取3 μL过夜培养的PF07菌液接种在平板中心,在28 ℃静置培养12、24、36 h和48 h,测量泳动圈的直径。
1.3.6 共聚焦扫描显微镜观察被膜结构
将PF07菌体按1%分别接种到含0、1、20 mmol/L CaCl2的LB肉汤中,在28 ℃静置培养24 h后取出,倒去菌液。参考SYTO-9染料说明书和Liu Li等[18]方法,将SYTO-9稀释500 倍后添加至培养皿,于室温静置15 min。SYTO-9的激发和发射波长大约在480 nm和500 nm,图像使用Zeiss LSM 710共聚焦扫描显微镜,在63×油镜下采集图像,使用ZEN 2012软件处理图像,生成三维结构。
1.3.7 实时荧光定量PCR检测
参考1.3.6节方法培养24 h获得菌体,分别提取总RNA,用反转录试剂盒将RNA反转录cDNA,获得的cDNA在-20 ℃备用。荧光定量PCR体系(20 μL):RNAfree水8 μL,Power SYBR Master Mix 10 μL;上下游引物(10 μmol/L)各0.5 μL;模板cDNA 1.0 μL。反应条件:95 ℃、10 min;40 个循环(95 ℃、15 s;60 ℃、60 s,收集荧光);60~95 ℃,熔点曲线分析。每个样品重复3 次,以16S rRNA基因作为内参基因,各个基因的相对表达水平以2Ct内参基因-Ct目的基因进行统计分析。引物序列如表1所示。
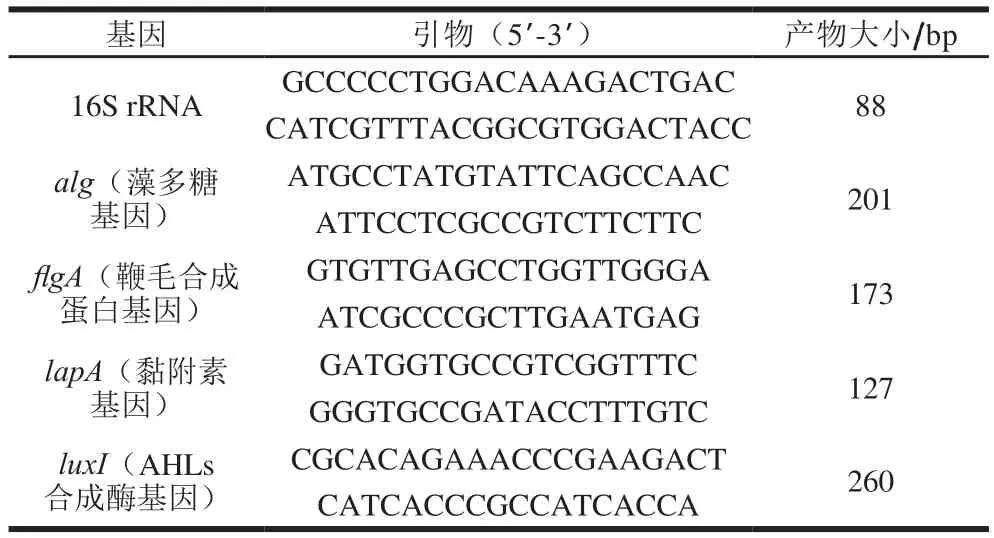
表1 PF07被膜相关基因引物Table 1 Primer sequences used for PCR amplification of biofilmforming genes in PF07
1.4 数据处理
生物被膜结晶紫检测样品重复5 次,胞外多糖、运动性、实时荧光定量PCR等样品检测每组设3 次重复,采用Microsoft Excel和Origin 8.5进行数据处理和作图,用SPSS17.0的ANOVA进行方差分析,P<0.05,差异显著。
2 结果与分析
2.1 Ca2+对荧光假单胞菌PF07生物被膜形成的影响
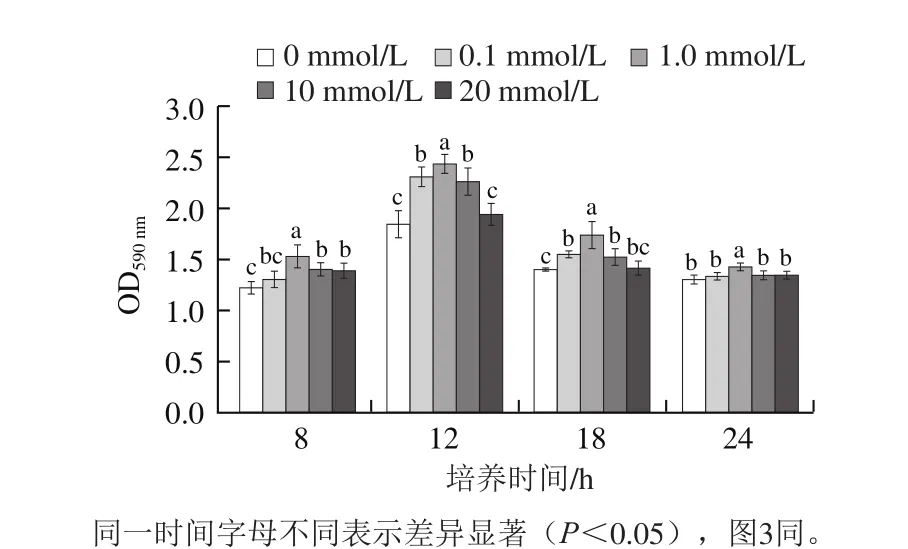
图1 Ca2+浓度对荧光假单胞菌PF07生物被膜形成的影响Fig. 1 Effect of Ca2+ concentration on biofilm formation of PF07 at 28 ℃
如图1所示,Ca2+添加能影响PF07生物被膜的形成,其中0.1、1、10 mmol/L Ca2+促进被膜形成,12 h后被膜分别增加25.1%、35.7%和22.6%。随着Ca2+浓度增加,荧光假单胞菌促进作用呈现先增强后减弱的趋势,而20 mmol/L Ca2+对整个被膜周期影响微弱。渠宏雁等[9]发现Ca2+浓度对副溶血性弧菌生物被膜的促进也表现先增加后减弱,其中0.5% Ca2+的促进率最强,与本结果相似。同时随着培养时间的延长,Ca2+刺激荧光假单胞菌被膜形成逐步减弱,其中1 mmol/L Ca2+在12 h表现最强,之后24 h Ca2+影响逐步降低。该现象与Ca2+与细胞和黏附基质表面带负电的基团结合引起的架桥作用有关[19],随着Ca2+浓度增加可能导致细菌与表面的静电排斥力高于吸引力,减少细菌的黏附量。
2.2 Ca2+对PF07浮游菌生长的影响
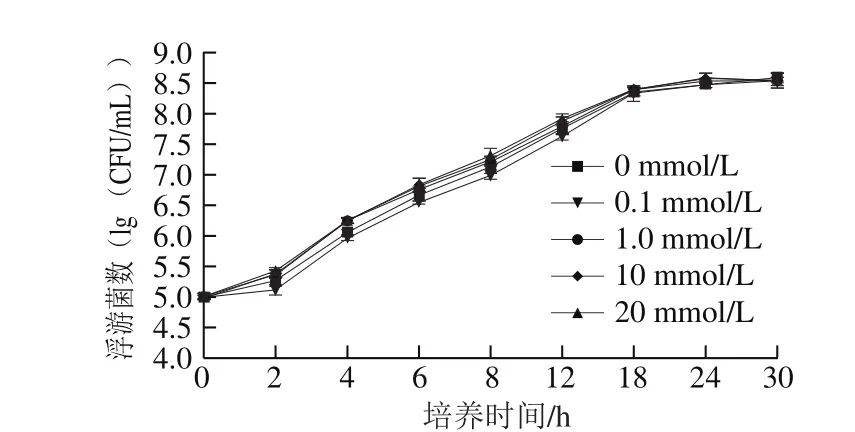
图2 Ca2+浓度对荧光假单胞菌PF0生长的影响Fig. 2 Effect of Ca2+ concentration on planktonic cell growth of PF07
如图2所示,荧光假单胞菌PF07在28 ℃生长较快,18 h逐步进入稳定期。PF07培养12 h和24 h的浮游菌数分别为达到7.75、8.59(lg(CFU/mL)),而Ca2+对PF07浮游菌生长影响较小,0.1 mmol/L低浓度Ca2+作用下PF07浮游菌生长初期有微弱的抑制,20 mmol/L Ca2+对浮游菌对数生长期略有促进,而培养24 h后0.1~10 mmol/L Ca2+对荧光假单胞菌PF07稳定期细菌密度无影响,提示Ca2+对生物被膜的促进作用与浮游细菌生长无关。
2.3 Ca2+对荧光假单胞菌PF07胞外多糖的影响
图3 Ca2+浓度对荧光假单胞菌PF07被膜胞外多糖含量的影响Fig. 3 Effect of Ca2+ concentration on exopolysaccharide protein production of PF07
如图3所示,Ca2+能影响荧光假单胞菌被膜胞外多糖的形成。1 mmol/L和10 mmol/L Ca2+在培养12 h促进PF07胞外多糖分泌,而20 mmol/L则表现抑制。培养24 h后0.1 mmol/L和1 mmol/L Ca2+促进PF07多糖分泌量为23.4%和47.7%,而10 mmol/L和20 mmol/L作用下减少15.5%和38.3%多糖含量。Ca2+对PF07胞外多糖的作用呈现浓度依赖性,低浓度下表现促进,高于10 mmol/L逐步抑制,其中1 mmol/L Ca2+促进效果最强。该作用趋势可能是由于Ca2+和细菌表面多糖静电结合,从而改变被膜的黏附特性[20]。同时,金属离子对被膜聚合物的架桥作用并不稳定,高浓度离子环境中可能降低胞外多糖分泌的现象。唐连凤等[21]发现Ca2+促进Shewanella oneidensis MR-1胞外多糖的分泌,2.1 mmol/L Ca2+环境中促进作用最强,且细菌外表面褶皱及变形程度最大,浓度增加则作用减弱。
2.4 Ca2+对荧光假单胞菌PF07薄膜形成的影响
薄膜是在细菌静置培养中气液体交界面处形成的特殊生物被膜,被称作“流动的生物被膜”。与固液被膜相似,薄膜中菌体更易接触氧气,且因缺少支持物表现较脆弱[22]。如图4所示,荧光假单胞菌PF07培养12 h逐步形成透明稀薄薄膜,划痕不清晰,添加0.1 mmol/L和1 mmol/L Ca2+的薄膜与对照组无差异,而高浓度Ca2+下薄膜厚度明显下降,20 mmol/L Ca2+中无成形的薄膜。培养至24 h对照组已形成不透明、致密的薄膜,厚度和黏度明显增加,划痕清晰且无褶皱。而0.1 mmol/L和1 mmol/L Ca2+增加薄膜厚度和黏度,并不易划破,而高浓度Ca2+被膜变薄,易划破。培养36~48 h后,对照组、0.1 mmol/L和1 mmol/L Ca2+添加组被膜厚度继续增加,不易划破,划痕表面形成褶皱,而黏度略下降。相似地,高浓度Ca2+下薄膜无增厚,膜孔分离,底部变浑浊。可见,Ca2+显著影响荧光假单胞菌薄膜的形成,其中0.1~1 mmol/L低浓度促进薄膜形成,增加薄膜厚度和机械强度,而10~20 mmol/L高浓度则抑制薄膜形成、降低厚度和黏稠性,推测可能与Ca2+改变菌体被膜胞外聚合物分泌特性有关[23-24]。

图4 Ca2+浓度对荧光假单胞菌PF07薄膜的影响Fig. 4 Effect of Ca2+ concentration on pellicle formation of PF07
2.5 Ca2+对荧光假单胞菌PF07泳动性的影响
细菌运动性与被膜形成关系密切,运动性促进被膜在表面延伸,有助于浮游菌转变为被膜菌[25]。如图5所示,随着培养时间延长荧光假单胞菌PF07泳动性逐步增强,在48 h后细菌泳动圈直径为73.0 mm。Ca2+能影响荧光假单胞菌的泳动性,其中Ca2+加速菌体的泳动性,而10 mmol/L和20 mmol/L Ca2+抑制泳动。荧光假单胞菌PF07在0.1、1、10 mmol/L和20 mmol/L Ca2+作用下培养48 h后分别增加6.8%和20.5%,及减少24.7%和31.5%。已报道假交替单胞菌在10 mmol/L Ca2+作用下菌体鞭毛的结构蛋白表达降低,鞭毛形成减少[26]。可见,低浓度Ca2+促进PF07泳动性,高浓度则表现抑制,可能与不同Ca2+浓度下菌体鞭毛结构蛋白差异变化相关。

图5 Ca2+浓度对荧光假单胞菌PF07运动性的影响Fig. 5 Effect of Ca2+ concentration on swimming motility of PF07
2.6 Ca2+对荧光假单胞菌PF07被膜结构的影响

图6 Ca2+浓度对荧光假单胞菌PF07被膜结构的影响Fig. 6 Effect of Ca2+ concentration on biofilm structure of PF07
荧光假单胞菌在稳定期后分泌大量胞外聚合物,生物膜厚度增加,是生物被膜生长的成熟期。共聚焦扫描显微镜观察Ca2+环境下荧光假单胞菌PF07生物被膜结构变化,如图6所示。荧光假单胞菌经24 h培养后0、1、20 mmol/L Ca2+处理组的生物被膜厚度分别为20.0、40.0、25.0 μm。并且,添加1 mmol/L Ca2+不仅显著增加PF07被膜的厚度,还使被膜变得非常致密,在顶部和底部聚集大量菌体和分泌物。高浓度Ca2+处理被膜厚度略有增厚,然而被膜中荧光强度弱于对照组,被膜菌体分布减少,分泌物量降低。Sarkisova等[27]观察发现1 mmol/L和10 mmol/L Ca2+作用下铜绿假单胞菌被膜厚度增加约10 倍,并且出现明显的细胞凝集现象。
2.7 Ca2+对荧光假单胞菌PF07被膜相关基因表达量的影响
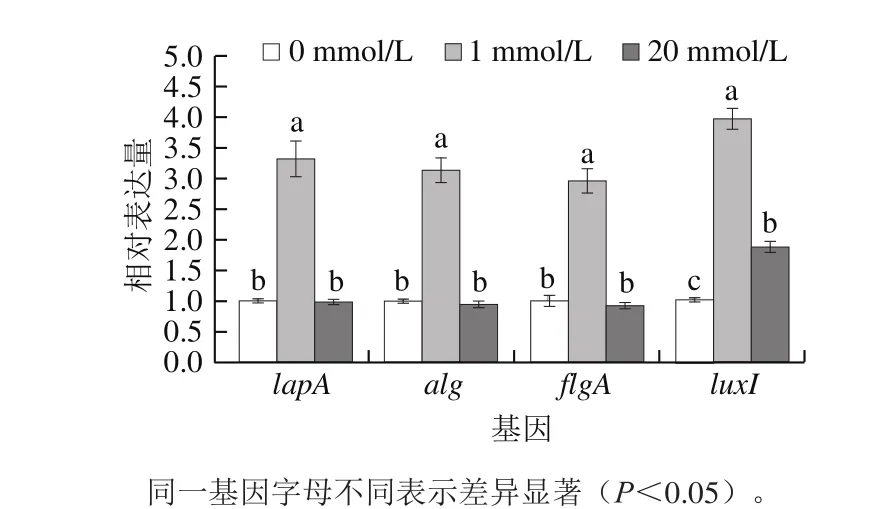
图7 Ca2+浓度对荧光假单胞菌PF07被膜相关基因表达量的影响Fig. 7 Effect of Ca2+ concentration on the expression levels of biofilm-related genes in PF07
如图7所示,PF07培养24 h后,1 mmol/L Ca2+显著促进黏附素基因lapA、藻多糖基因alg、鞭毛合成蛋白基因flgA、AHLs合成酶基因luxI四种基因相对表达量,分别为对照组的3.3、3.1、2.9 倍和3.9 倍。而20 mmol/L Ca2+对菌体中lapA、alg、flgA的相对表达量无影响,却增加luxI相对表达量,为对照组的1.9 倍。两种浓度的Ca2+对荧光假单胞菌3 种被膜相关基因lapA、alg、flgA表达量存在差异,基因表达与被膜菌、胞外多糖、运动性表型现象较一致。研究报道,Ca2+调控铜绿假单胞菌[27]、霍乱弧菌[28]、大肠杆菌[29]等众多细菌被膜形成有关基因的表达,包括胞外多糖分泌、泳动行为、群体感应、铁离子摄取行为等。菌体内Ca2+结合蛋白参与菌体的黏附,且在菌体凝集中起重要作用。同时,Ca2+作为感应分子,调节被膜相关成分的表达。已发现Ca2+不仅促进铜绿假单胞菌被膜形成,而且浮游菌和被膜菌的alg基因表达分别提高3 倍和8 倍[27]。相对于1 mmol/L Ca2+环境,20 mmol/L Ca2+作用下荧光假单胞菌被膜相关基因表达无影响,推测高浓度Ca2+可能解离胞外聚合物结构,进而降低含量。两种浓度Ca2+均能增加荧光假单胞菌luxI的相对表达量,提示Ca2+影响被膜形成与群体感应的AHLs活性有关。AHLs能与细菌特异性蛋白结合并激活细胞基因的转录表达,影响细菌运动性、胞外多糖的分泌影响,调控生物被膜的散播[30]。研究表明,Ca2+对荧光假单胞菌生物被膜黏附、胞外分泌物、薄膜、运动性的影响与群体感应LuxI/LuxR参与的调控内在相关,深层调控机制有待于进一步研究。
3 结 论
环境Ca2+影响水产品腐败荧光假单胞菌的生物被膜形成特性,不同浓度Ca2+表现差异的作用方式。低浓度Ca2+添加能促进PF07生物被膜形成,随着浓度增加促进作用减弱,其中1 mmol/L Ca2+显著促进PF07被膜菌、胞外多糖、薄膜和泳动性。共聚焦扫描显微镜证实1 mmol/L Ca2+刺激PF07被膜厚度和细胞凝集,使被膜结构更致密,其与Ca2+刺激lapA、alg和flgA三种被膜相关基因表达量有关。研究发现Ca2+添加促进菌体群体感应luxI基因的表达,提示Ca2+对荧光假单胞菌被膜的影响与群体感应活性密切相关。因此,应更多关注食品加工环境中离子成分对腐败微生物的黏附和被膜形成的影响,有效避免和减少腐败微生物对食品污染。
