四川不同地区浓香型大曲微生物群落结构比较
2019-07-26吴树坤卫春会刘燕梅黄治国万世旅
吴树坤,谢 军,卫春会,刘燕梅,黄治国,万世旅,邓 杰,*
(1.四川理工学院 酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;2.宜宾市产品质量监督检验所,四川 宜宾 644000)
“曲乃酒之骨”,好曲是生产出好酒的重要前提之一。大曲制作采用的自然接种和开放式发酵的生产工艺使其充分网罗了制曲环境中的微生物,微生物在曲坯中彼消此长,并形成独特的群落结构,自然积温转化并风干而成的一种多酶多菌多物质的微生物生态制品,具有糖化发酵生香的作用,对白酒生产起着至关重要的作用。大曲中的主要菌群为真菌和细菌,同时含有少量古菌[1],不同的微生物各司其职,对白酒的酿造也起着不同的作用,如:霉菌为糖化动力、酵母菌为发酵动力、细菌为生香动力[2]。
目前,关于大曲中微生物群落结构的研究报道较多。张会敏等[3]通过构建16S rDNA克隆文库的非培养方法对古井贡酒中温大曲和高温大曲进行细菌群落结构及其多样性研究,发现高温放线菌(Thermoactinomyces sanguinis)为古井高温大曲的优势菌且只存在于高温大曲中;中温大曲优势菌属为枝芽孢菌属(Virgibacillus sp.)、乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)等类群。夏玙等[4]探究了热风干燥工艺对贮存期大曲中真菌群落的影响,发现其优势真菌类群均为嗜热子囊菌属(Thermoascus)、根毛霉属(Rhizomucor)、曲霉菌属(Aspergillus)、假丝酵母属(Candida),其中嗜热子囊菌属在大曲真菌群落中具有明显的优势。施思等[5]通过高通量测序对大曲在贮藏过程中微生物多样性的变化进行研究,结果发现在贮存过程中大曲真菌群落结构不断调整,毕赤酵母属、根霉菌属及横梗霉属成为最终的优势菌群。本实验将利用高通量测序技术研究四川不同地区浓香型大曲微生物群落结构的差异,为探索不同地区不同工艺浓香型白酒的差异提供理论支撑。
1 材料与方法
1.1 材料与试剂
大曲样品均为入库贮存3 个月的成品曲,分别取自四川宜宾(最高品温60 ℃)、泸州(最高品温58 ℃)和遂宁(最高品温均为55 ℃),每组样品随机取3 个平行样本,将采集的样品进行等量混合后提取DNA。
氯化钠、磷酸二氢钠、磷酸氢二钠(均为分析纯)成都科龙化工试剂厂;饱和酚、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)-Na2、十六烷基三甲基溴化铵(cetrimonium bromide,CTAB)(均为分析纯) 北京索莱宝科技有限公司;三羟甲基氨基甲烷(Tris)(分析纯) 美国Sigma-Aldrich公司;AxyPrep DNA凝胶回收试剂盒 美国Axygen公司。
1.2 仪器与设备
MyCycler型聚合酶链式反应(polymerase chain reaction,PCR)仪、JY-SP-C型水平电泳槽、ChemiDoc XRS+型水平电泳仪 美国Bio-Rad公司;Lynx6000型高效落地高速离心机、超低温冰箱 美国Thermo公司。
1.3 方法
1.3.1 样品总DNA提取
目前抽提DNA的方法较多且比较完善,其关键均在于微生物的破壁及蛋白质等杂质的沉淀。本实验利用改良的CTAB[6]法提取大曲中微生物的总DNA。步骤如下:1)称取5 g大曲样品于50 mL无菌离心管中,加入13.5 mL配制好的DNA抽提液(100 mmol/L Tris-HCl、100 mmol/L Na2EDTA、100 mmol/L Na2HPO4-NaH2PO4缓冲液、1.5 mol/L NaCl、2% CTAB;pH 8.0)于旋涡振荡器上混匀。2)加入1.5 mL 20% SDS溶液(pH 7.2),于65 ℃水浴2 h,每间隔15 min轻摇颠倒。3)常温6 000×g离心10 min,上清液转入新的50 mL离心管中。4)向剩余的沉淀中加入4.5 mL DNA抽提液,0.5 mL 20% SDS,混匀,65 ℃水浴10 min后常温6 000×g离心10 min。5)合并上清液后加入等体积酚-氯仿-异戊醇(25∶24∶1,V/V)溶液混匀,振荡混匀,静置10 min,12 000×g常温离心15 min。6)将上层水相转入50 mL离心管中,加入0.6 倍体积异丙醇,混匀,室温沉淀2 h。7)12 000×g室温离心15 min,弃上清液,收集沉淀。8)转移沉淀至2 mL离心管中,加入1 mL 70%乙醇进行洗涤,12 000×g离心5 min,弃上清液;重复此步骤1 次。9)将离心管置于超净台吹风干燥,直至无乙醇味。10)向离心管中加入200 μL无菌双蒸水使DNA沉淀溶解,贮于-20 ℃备用。
1.3.2 引物接头设计
根据Illumina MiSeq测序平台对引物的要求,针对细菌16S V3-V4区和真菌ITS1区序列,设计带接头的特异引物,不同的DNA用对应的barcode[7]进行标记,PCR基于双端测序,其引物设计的结构为:5′-miseq接头A—barcode A—正向测序引物—正向特异引物—3’;5’-miseq接头B—barcode B—反向测序引物—反向特异引物—3’;细菌16S rDNA V3-V4区的通用引物为:338F(5’-ACTCCTACGGGAGGCAG-3’);806R(5’-GGACTACHVGGGTWTCT-3’);真菌引物为:ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’);2043R(5’-GCTGCGTTCTTCATCGATGC-3’)。
1.3.3 PCR扩增和产物回收
PCR采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase,20 μL反应体系:5×FastPfu Buffer 4 μL;2.5 mmol/L dNTPs 2 μL;Forward Primer(5 μmol/L)0.8 μL;Reverse Primer(5 μmol/L)0.8 μL;FastPfu Polymerase 0.4 μL;BSA 0.2 μL;Template DNA 10 ng;补ddH2O至20 μL。
PCR参数:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,28 个循环后,72 ℃延伸10 min,10 ℃保持至停止。随后用2%琼脂糖凝胶电泳检测,并使用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,再次用2%琼脂糖凝胶电泳检测。
1.4 数据分析
1.4.1 测序数据统计
高通量测序完成后[8-9],根据PE序列之间的overlap关系,将成对的序列拼接成一条序列[10],同时对序列的质量和拼接的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向。去除有效序列中的非特异性扩增片段、模糊碱基、单碱基高重复区、长度过短的序列(序列长度小于200 bp)以及PCR过程中产生的一些嵌合体,得到精准分析的优化序列。根据序列的相似性,将序列相似性大于等于97%分归为同一操作分类单元(operational taxonomic unit,OTU)[11],将所有序列与Silva库比对,得到序列的分类学信息。构建稀释曲线[12]和Shannon曲线[13],判断取样的合理性和测序量、测序深度的有效性。
群落生态学中研究微生物多样性,通过单样品的多样性分析(Alpha多样性)[14]可以反映微生物群落的丰度和多样性。Chao指数和ACE指数用于反映样品中所含OTU数目和估计物种总数的常用指数,Simpson指数和Shannon指数常用来估算样品中微生物的多样性,覆盖率是反映测序深度指数之一,其数值越高说明样本中序列被测出的概率越高。本实验在OTU相似水平97%条件下评估多样性指数。
1.4.2 测序数据绘图
测序数据采用R语言工具编辑绘图;主成分分析采用SPSS 20.0软件分析制图。
2 结果与分析
2.1 测序数据统计
2.1.1 序列统计
通过对样品DNA进行测序,总共得到117 869 条细菌的有效序列,平均长度在450 bp左右,由图1a可知,测序长度主要分布在421~460 bp(97.92%)之间,与设计引物扩增长度接近,由此判断测序结果较好。此外,共得到136 040 条真菌的有效序列,平均长度为270~290 bp,由图1b可知,测序长度集中分布在280~320 bp,与设计引物扩增序列长度为300 bp左右较接近,说明本次测序结果较合理。

图1 测序序列的长度分布Fig. 1 Length distribution of sequencing
2.1.2 测序有效性分析
稀释曲线可以用来比较测序数据量不同的样本中物种的丰富度,当曲线趋向平缓时,更多的数据量只会产生少量新的OTU,反之则表明继续测序还可能产生较多新的OTU。Shannon指数是反映样本中微生物多样性的指数,利用各样本的测序量在不同测序深度时的微生物多样性指数构建曲线,以此反映各样本在不同测序数量时的微生物多样性。根据图2和图3的结果可得,各曲样的稀释性曲线和Shannon曲线都随测序深度的增加呈现先增加后趋于平缓的趋势,这表明测序数据量合理,测序深度能够反映出样品中绝大多数微生物的物种信息。
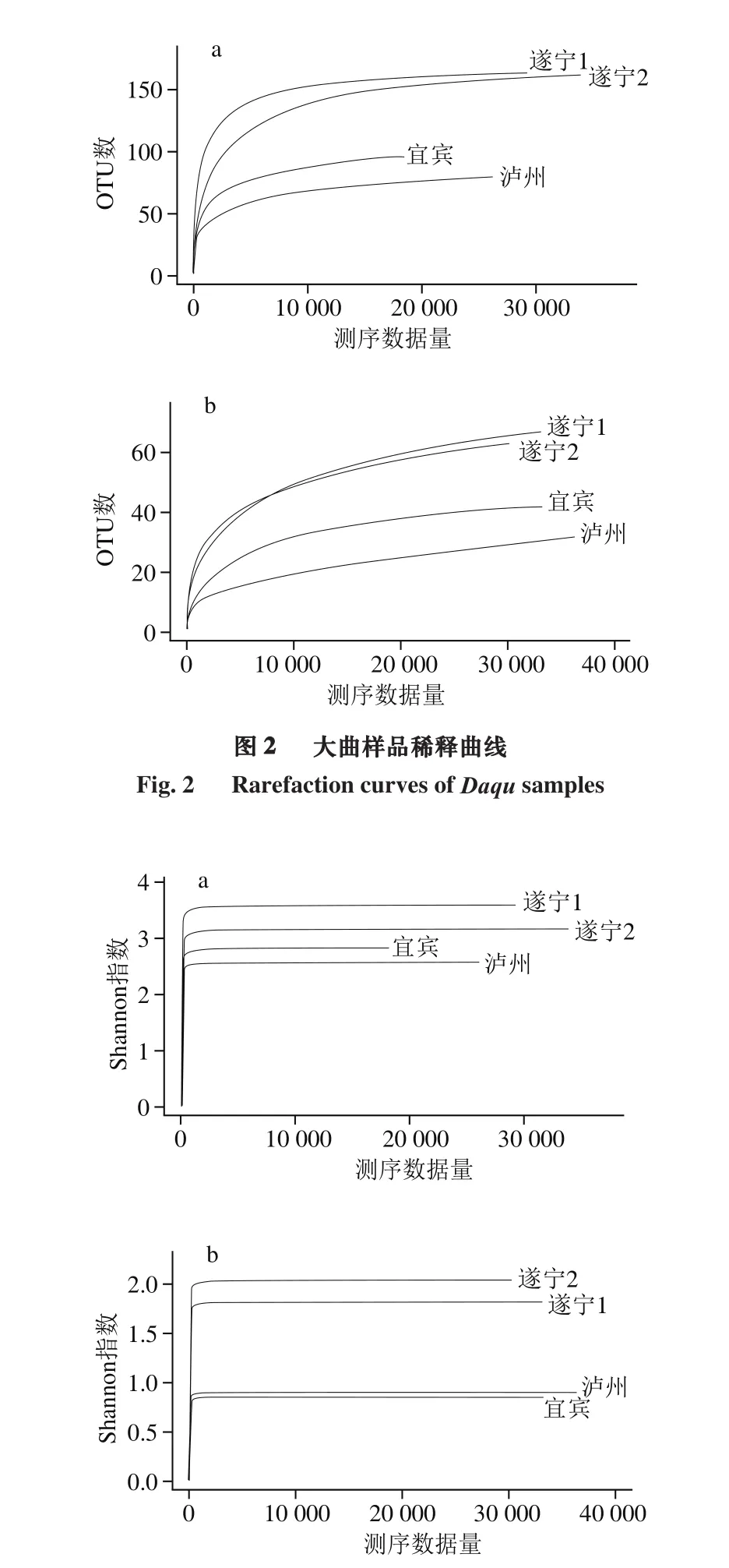
图3 大曲样品Shannon曲线Fig. 3 Shannon curves of bacteria and fungi in Daqu samples
2.1.3 Alpha多样性分析
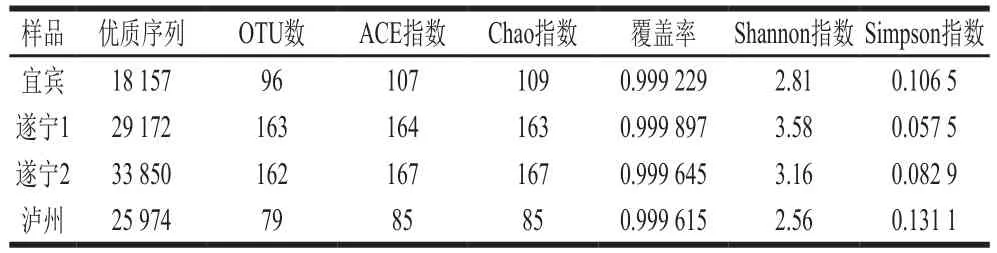
表1 大曲样品细菌Alpha多样性指数Table 1 Alpha diversity index of bacteria in Daqu samples
OTU是在系统发生学或群体遗传学研究中,为便于进行分析,通过归类操作,将序列相似性大于等于97%分归为同一OTU。由表1可知,遂宁1和遂宁2曲样OTU数最高,分别为163 个和162 个,其次是宜宾曲样(96 个),最低的是泸州取样(79 个);4 个曲样的优质序列分别为18 157、29 172、33 850 条和25 974 条,占有效序列的比例较高;Chao指数和ACE指数是用于计算群落丰度的指数,其值越大说明样品中微生物的丰度越高,根据表1结果,遂宁2曲样的丰度最高,泸州曲样的丰度最低;Shannon指数和Simpson指数是计算菌群多样性的指数,根据表1的结果可知遂宁1曲样的群落多样性最高,泸州曲样的群落多样性最低;4 个样品的覆盖率值均大于0.999,说明样本中的序列基本完全被测出,测序结果代表了样本中微生物的真实情况。
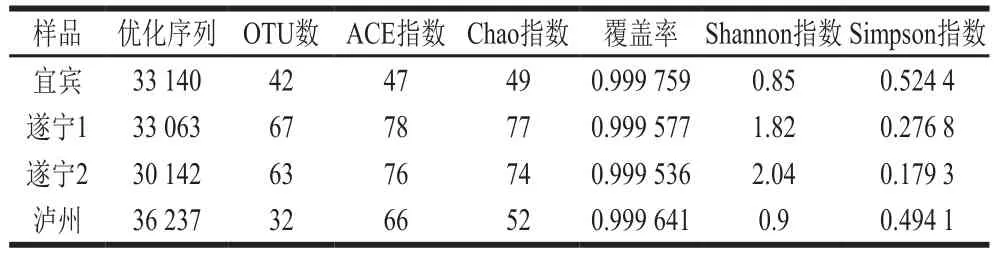
表2 大曲样品真菌Alpha多样性指数Table 2 Alpha diversity index of fungi in Daqu samples
由表2可知,4 个样品的优化序列数均在30 000 条以上;在相似度97%条件下遂宁1曲样获得最多的67 个OTU,其后是遂宁2、宜宾、泸州曲样OTU数分别为63、42 个和32 个;Chao指数和ACE指数显示遂宁2曲样的群落丰度要高于其他3 个曲样;Shannon指数和Simpson指数表明在群落结构的多样性上,4 个曲样的高低依次是遂宁2>遂宁1>泸州>宜宾;4 个样品的覆盖率均大于0.999,说明各样本文库的覆盖率较高,样本中的序列基本完全被测出,测序结果真实可靠。
2.1.4 OTU分布Venn分析
对不同大曲样品获取的OTU进行统计分类,对不同样品之间相对共有的以及独有的OTU数进行叠加,得出OTU分布Venn图[15],以比较OTU数目组成相似性及重叠情况。
根据OTU的分类结果,4 个大曲样品的细菌OTU总数为181 个。由图4a可知,在4 个大曲样品的细菌共有OTU数为42 个,占OTU总数的23%,宜宾、遂宁1、遂宁2、泸州曲样独有的OTU分别为7、57、45、3 个。宜宾和遂宁1曲样的共有OTU数为58 个,遂宁1和遂宁2曲样共有的OTU数为104 个占总OTU的57%以上,遂宁2和泸州样品的共有OTU数为58 个,宜宾和遂宁2曲样的共有OTU数为55 个,宜宾和泸州曲样的共有OTU数为71 个,占总OTU数的40%左右。可知遂宁1和遂宁2曲样的细菌OTU归类相似度最高,宜宾和泸州曲的OTU较相似。由此可以得出,大曲生产基地地理位置越相近,其样品中共有的OTU数越多,这是否存在巧合,需要进一步进行相关研究。
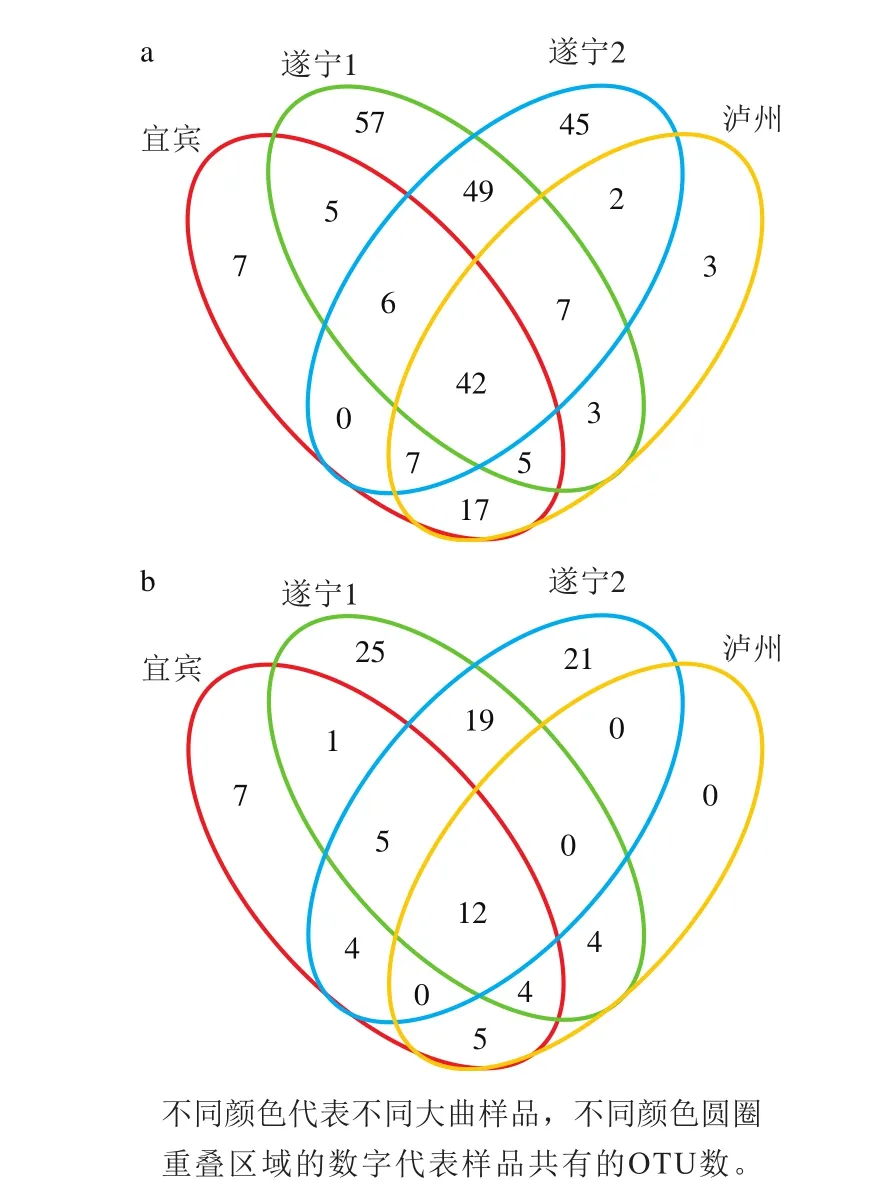
图4 不同大曲细菌(a)和真菌(b)OTU的差异性Fig. 4 OTU variability of bacteria (a) and fungi (b) from different Daqu samples
4 个大曲样品真菌的OTU总数为89 个,共同OTU为12 个占OTU总数的13%,宜宾、遂宁1、遂宁2、泸州大曲样品的独有OTU数为7、25、21、6 个。宜宾和遂宁1曲样的共有OTU数为22 个,遂宁1、遂宁2曲样共有的OTU数为36 个,占总OTU的40%以上,遂宁2、泸州样品的共有OTU数为12 个,宜宾、遂宁2曲样的共有OTU数为21 个,宜宾、泸州曲样的共有OTU数为21 个,因此遂宁1、遂宁2曲样的真菌OTU归类较相似。
2.2 细菌群落结构分析
2.2.1 大曲样品中细菌门的分类
将各类OTU的代表序列与silva细菌数据库进行比对,得到每个OTU在不同分类水平的物种分类信息,分析样本在不同分类水平上的群落结构。如图5所示,4 种曲样共分类得到10 个门类分别为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、衣原体门(Chlamydiae)、蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、疣微菌门(Verrucomicrobia)。其中厚壁菌门、放线菌门、变形菌门和拟杆菌门占比较大,分别为74.51%、16.45%、7.52%和0.99%,与陈玲等[16]对浓香型大曲中微生物多样性的研究结果较一致。其中厚壁菌门均为浓香型大曲中绝对的优势微生物,这是由于厚壁菌门主要由芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)等微生物组成[17],具有很强的环境适应性,能够在相对极端的条件保持生长代谢;放线菌广泛分布于土壤环境、海洋环境、植物体及其他极端自然生态环境中[18],同时和厚壁菌门相似,也具有极强的耐受性。
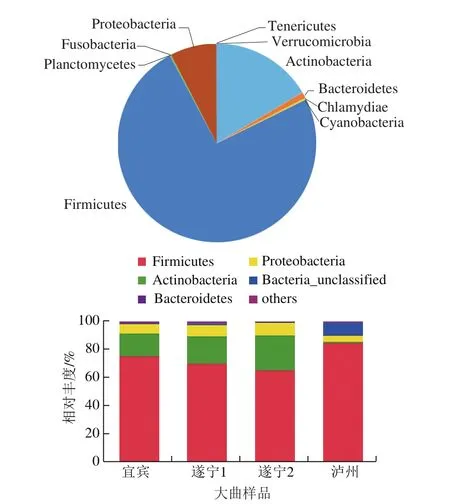
图5 大曲样品中细菌门类分布情况Fig. 5 Distribution patterns of bacteria at the phyla level in Daqu samples
2.2.2 大曲样品中细菌属的分类
在属的水平上总共得到82 个属,将丰度低于1%的合并为一类(others),由图6所示,4 种曲样中丰度较高的为厚壁菌门下的葡萄球菌属(Staphylococcus,18.21%)、魏斯氏菌属(Weissella,12.67%)、芽孢杆菌属(Bacillus,10.29%)、乳杆菌属(Lactobacillus,7.97%)、Kroppenstedtia(7.18%)、高温放线菌属(Thermoactinomyces,7.98%)、片球菌属(Pediococcus,3.07%)、Lentibacillus(1.43%)、乳球菌属(Lactococcus,1.40%),放线菌门下的糖多孢菌属(Saccharopolyspora,9.33%)、短杆菌属(Brevibacterium,2.75%)。4 种曲样的优势菌属主要分布在葡萄球菌属、魏斯氏菌属、芽孢杆菌属、糖多孢菌属、高温放线菌属、乳杆菌属和Kroppenstedtia属中,这与王彩虹[19]得到的浓香型大曲优势菌属为魏斯氏菌属、乳杆菌属、明串珠菌属(Leuconostoc spp.)、地衣芽孢杆菌(Bacillus licheniformis)、片球菌属、高温放线菌属、糖多孢菌属的结果较为相似,但本研究结果与之不同之处在于,在遂宁1、遂宁2曲样中存在高丰度的葡萄球菌属,葡萄球菌属广泛分布于土壤、空气、水、灰尘中[20],可能是由地域环境和大曲制作方法的不同造成的。
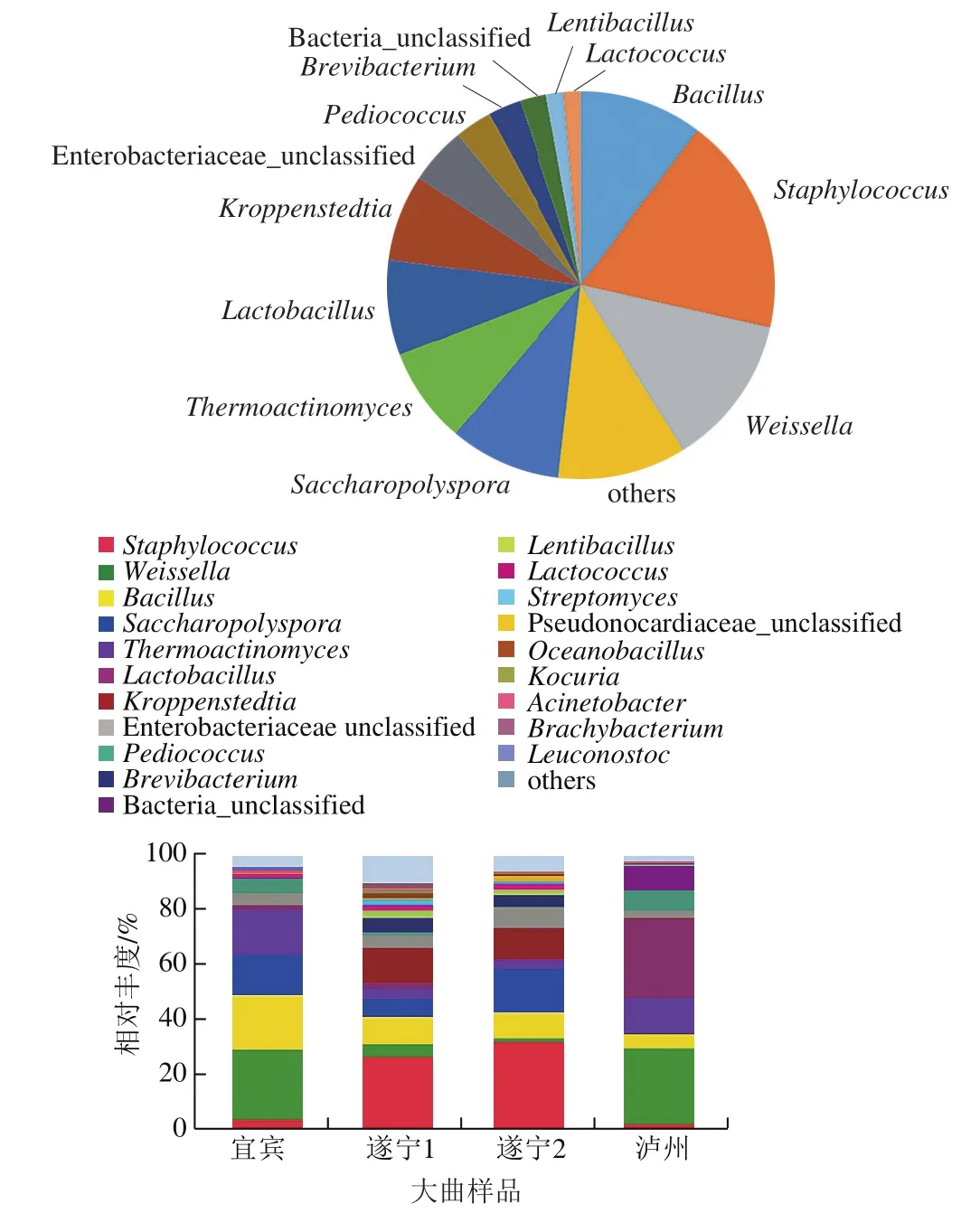
图6 大曲样品中细菌属类分布情况Fig. 6 Distribution patterns of bacteria at the genus level in Daqu samples
宜宾曲样的优势菌属为魏斯氏菌属(25.23%)、芽孢杆菌属(19.96%)、高温放线菌属(16.26%)和糖多孢菌属(14.79% );遂宁1曲样中葡萄球菌属(26.38%)、Kroppenstedtia属(12.77%)和芽孢杆菌属(9.73%)所占比例较高;遂宁2曲样占主导地位的菌属为葡萄球菌属(31.62%)、糖多孢菌属(15.87%)、Kroppenstedtia属(11.64%)和芽孢杆菌属(9.48%);此外,乳杆菌属(28.96%)、魏斯氏菌属(27.66%)、高温放线菌属(13.12%)、片球菌属(7.39%)在泸州曲样中为优势菌属。
魏斯氏菌属属于乳酸细菌,有一定的耐酸性,在发酵产品中分布广泛其分解葡萄糖产生CO2异型发酵产生乳酸[21],有利于乳酸乙酯的形成及酒质的稳定,是白酒酿造中的重要微生物之一。王海燕等[22]、李德林[23]均利用PCR-变性梯度凝胶电泳16S rRNA基因文库在浓香型白酒酒醅中鉴定出魏斯氏菌属且丰度较高,而在窖泥中未发现有该菌属的报道,因此可以推断大曲是白酒酿造中魏斯氏菌属的主要来源。芽孢杆菌属能产芽孢因此具有极强的环境适应能力,普遍存在于白酒生产的各个微生态环境中,是产乳酸、产淀粉酶和蛋白酶的重要菌属[24],同时也是大曲中风味物质的主要产生菌之一。糖多孢菌属在分类学上属于放线菌门下一类形态相似的微生物[25],能产生酶类、维生素、纤维素降解促进因子等,是一类安全的生物资源菌,在浓香型大曲中普遍存在。高温放线菌属具有耐高温、生长快的特点,可产蛋白酶和纤维素酶[26]对白酒的风味和原料的利用有重要作用,近几年研究发现其不仅仅存在于高温大曲中,研究表明[19,27-28]在中高温的浓香型大曲中高温放线菌属也有较高的分布,其丰度受制曲温度的影响,和本研究的结果类似。
2.3 真菌群落结构分析
2.3.1 大曲样品中真菌门的分类
将得到的各类OTU的代表序列与Unite的真菌数据库进行比对,得到每个OTU在不同分类水平的物种分类信息,分析其群落结构。由图7所示,4 个曲样的真菌组成可准确归为3 个门,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota),其中子囊菌门真菌占比最大,达97.97%,担子菌门和接合菌门分别为1.63%和0.40%,这与张会敏等[3]利用ITS rDNA克隆文库法得到的中温大曲中真核微生物的门类为子囊菌门、毛霉亚门(Mucoromycotina)、担子菌门的研究结果相似。4 个曲样的优势菌门均为子囊菌门,丰度均在95%以上。此外,在遂宁1和遂宁2曲样中担子菌门的占比分别为4.08%和2.49%,而在宜宾和泸州曲样中含量较少;泸州曲样中有1.32%的接合菌门,这在其他3 个曲样中含量较少。尽管这些存在差异的微生物群落丰度较小,但同样不能忽视它们在酿造中起到的特征性作用。
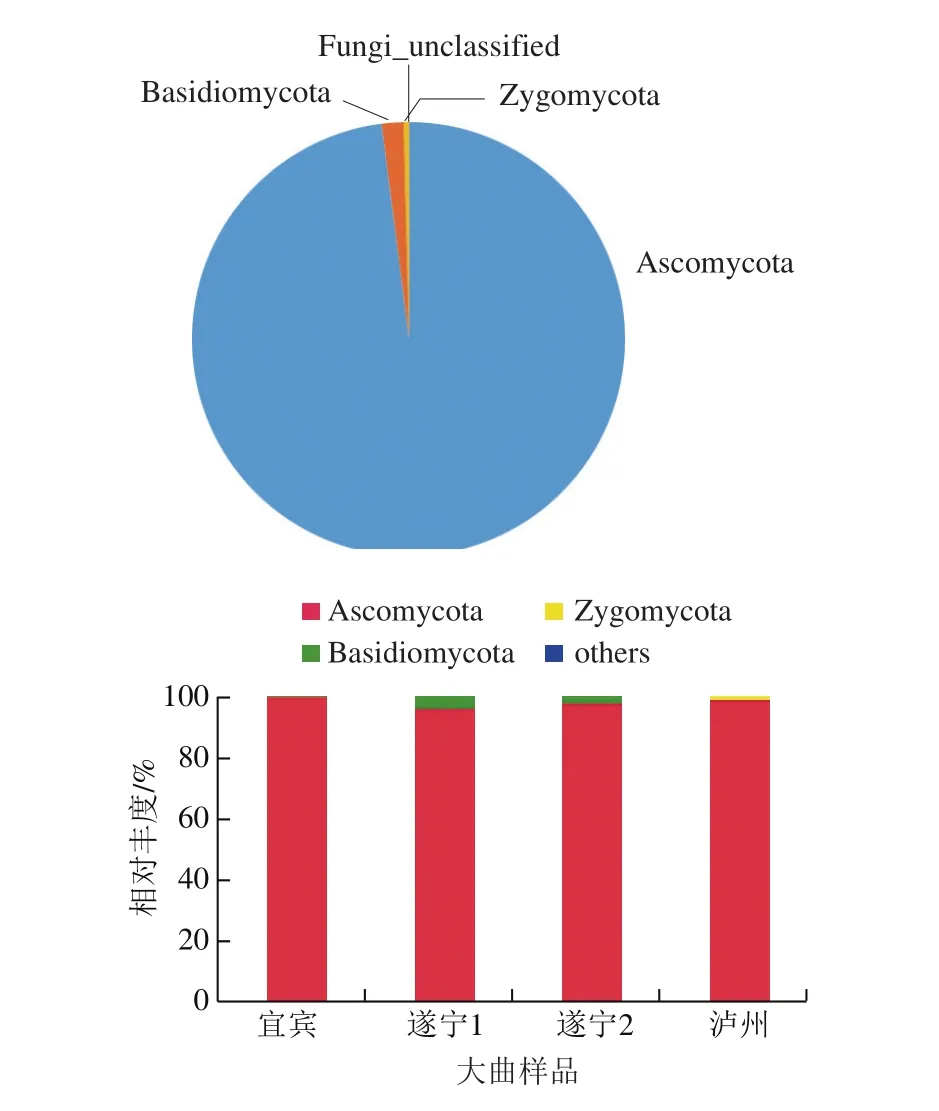
图7 大曲样品中真菌门类分布情况Fig. 7 Distribution patterns of fungi at the phyla level in Daqu samples
2.3.2 大曲样品中真菌属的分类

图8 大曲样品中真菌属分布情况Fig. 8 Distribution patterns of fungi at the genus level in Daqu samples
在属的水平上4 个曲样的OTU可归为37 个属,由图8可知,4 个大曲样品的真菌群落均不如细菌群落结构丰富。这是由于浓香型大曲在制曲过程中最高品温一般在50 ℃以上[29],而大多数真菌生长最适温度为20~30 ℃,致死温度为50~60 ℃[30],因此只有少部分耐热和嗜热真菌得以存活。4 个大曲样品中总体丰度较高的有嗜热真菌属(Thermomyces,38.55%)、曲霉属(Aspergillus,31.27%)、嗜热子囊菌属(Thermoascus,17.60%)、丝衣霉属(Byssochlamys,2.52%)、节担菌属(Wallemia,1.56%)和属级分类地位未知的散囊菌目菌属(Eurotiales_unclassified,4.73%)。酵母在4 个曲样中丰度均不高,仅在宜宾曲样中鉴定出2.74%酵母目下的Saccharomycetales_unidentified,其余如威克汉姆酵母(Wickerhamomyces)、丝孢酵母菌(Trichosporon)等虽有鉴定出但其丰度均小于1%。罗惠波等[31]运用分离培养结合分子生物学鉴定的方法对浓香型大曲中的真菌进行系统发育学分析,表明酿酒酵母(Saccharomyces cerevisiae)、德巴利氏酵母(Debaryomyces)、掷孢酵母属(Sporobolomyces)、异常威克汉姆酵母(Wickerhamomyces anomalus)等在总共29 个OTU中占比在1%~3%之间,本研究由于利用高通量测序能得到的OTU数更多,因此可推断酵母的OTU数所占比例会更小。
尽管大曲中的真菌群落多样性较细菌更为单薄,但其对出酒率,发酵生香等仍具有不可替代的作用。宜宾曲样中优势菌属为嗜热真菌属(66.25%)和嗜热子囊菌属(29.23%),该类真菌具有产纤维素酶、蛋白酶、淀粉酶、脂肪酶等酶类的能力[32],且具有较强的热稳定性,能够在白酒发酵过程中温度较高的条件下保持稳定的催化效率;其次为Saccharomycetales_unidentified(2.74%);泸州曲样各属的丰度高低依次为嗜热真菌属(61.91%)、嗜热子囊菌属(33.90%)、翘孢霉属(Emericella,1.18%)、曲霉属(1.16%)、根霉属(Rhizopus,1.12%)。遂宁1和遂宁2曲样的优势菌属均为曲霉属比例分别占到76.09%和52.49%,曲霉属是自然界分布极广的一类霉菌,是酿酒和食品加工业的重要菌种有较强的产淀粉酶和蛋白酶及代谢有机酸的能力,对白酒的产酒、生香有重要作用;此外,Eurotiales_unclassified、嗜热真菌属、节担菌属、丝衣霉属和嗜热子囊菌属均占有不同比例;通过分析发现,4 种大曲中均存在不同水平的Ascomycota_unclassified、曲霉属、隐球菌属(Cryptococcus)、Nectriaceae_unclassified、Pleosporales_unclassified、根霉属、Saccharomycetales_unidentified、嗜热子囊菌属和嗜热真菌属。弯孢属(Curvularia)和异茎点霉属(Paraphoma)只在宜宾曲样中存在。只从遂宁1和遂宁2大曲样品中鉴定出的真菌菌属有Auxarthron、Blastobotrys、Eurotiomycetes_unclassified、Fungi_unclassified、Microascaceae_unclassified、小囊菌属(Microascus)、红曲霉属(Monascus)、Saccharomycetales_unclassified、Sordariales_unidentified和篮状菌属(Talaromyces)。而背芽突霉属(Cadophora)、Sordariomycetes_unclassified和Xylariales_unclassified只存在于泸州取样中。由此可见,不同的制曲工艺、地域环境等因素均是造成不同大曲间微生物多样性差异的原因。
通过对不同样品的真菌群落结构的比较发现,遂宁的两个曲样真菌的多样性均高于宜宾和泸州的曲样,其间最大的不同在于遂宁的两个曲样中的曲霉菌属和Eurotiales_unclassified菌属远高于宜宾和泸州的曲样,而嗜热真菌属和嗜热子囊菌属的比例又远低于宜宾和泸州的曲样,结合各自的大曲制作工艺可得,宜宾和泸州的大曲发酵的最高品温均高于遂宁的曲样,由此可推断,大曲发酵中温度的控制和选择对大曲的微生物群落结构具有重要的影响。本实验结果与王彩虹[33]、董瑞丽[34]等的研究结果具有较好的一致性。
2.4 不同样品微生物群落主成分分析

图9 大曲样品的细菌(a)和真菌(b)主成分分布图Fig. 9 Principal component distribution of bacteria (a) and fungi (b) in Daqu samples
利用SPSS 20软件对各样品微生物群落结构进行主成分分析。如图9所示,在细菌群落中,共得到3 个主成分因子,PC1、PC2和PC3贡献率分别为83.6%、13.23%和3.17%,PC1上贡献率较大的OTU所代表的微生物为葡萄球菌属、糖多孢菌属、乳杆菌属和魏斯氏菌属;PC2上贡献率较大的OTU所对应的微生物为葡萄球菌属、糖多孢菌属、乳杆菌属、高温放线菌属、芽孢杆菌属,PC1和PC2成分的累计贡献率达96.83%,可较全面解释样品的差异。
在真菌群落中,共得到3 个主成分因子,PC1、PC2和PC3贡献率分别为96.13%、3.47%和0.4%。PC1上贡献率较大的微生物属为曲霉属、嗜热真菌属、嗜热子囊菌属和Eurotiales_unclassified;在PC2上丝衣霉属、曲霉属、嗜热真菌属、嗜热子囊菌属和Eurotiales_unclassified有较大的贡献率,两种主成分的累计贡献率达99.60%,可完全反映出样品真菌结构的差异。
如图9所示,在细菌群落上,遂宁1、遂宁2曲样距离相近,即该样品中细菌群落结构较宜宾和泸州曲样更相似,而宜宾曲样和泸州曲样在PC1成分方向上距离相近,而在PC2方向上距离较大,说明样品中高温放线菌属和芽孢杆菌属等微生物的丰度差异是造成两个样品差异的主要因素。同理,宜宾和泸州曲样中真菌群落结构的差异较小;而遂宁1、遂宁2曲样在PC2方向上距离较远,其差异主要体现在丝衣霉属等的相对丰度上。综合来看,宜宾、泸州曲样的微生物群落结构较相似,遂宁1和遂宁2群落结构比较相似。这可能是由于地区位置越相近,其环境微生物更加相似,因此,酿造环境对大曲中微生物群落结构的影响不可忽视。
3 结 论
通过高通量测序分析比较四川不同地区浓香型大曲中微生物群落结构的差异,发现遂宁曲样细菌和真菌的多样性均比宜宾和泸州曲样丰富。在属水平上,遂宁1和遂宁2曲样中葡萄球菌属、Kroppenstedtia、曲霉属、Eurotiales_unclassified占比较高,且比例远高于宜宾和泸州曲样。而宜宾和泸州大曲中魏斯氏菌属、高温放线菌属、嗜热真菌属和嗜热子囊菌属的比例均高于遂宁的两个曲样。通过主成分分析发现,遂宁的两个大取样品中微生物群落具有较高的相似性,而宜宾和泸州大曲样品的微生物群落结构更相似。由此可见,不同地区的大曲微生物群落结构各具特点,其间的差异性可能是由区域环境微生物的不同而造成,同时又受到大曲生产工艺的调节。本研究对了解不同地区大曲中的微生物群落结构的差异提供了大量数据,同时为进一步了解不同地区浓香型白酒之间的差异提供理论基础,将促进白酒行业的特色化发展。
