利用坛紫菜藻红蛋白制备脯氨酰内肽酶抑制肽
2019-07-26谢雪琼孙乐常张凌晶刘光明曹敏杰
谢雪琼,钟 婵,孙乐常,2,翁 凌,2,张凌晶,2,刘光明,2,曹敏杰,2,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021)
脯氨酰内肽酶(prolyl endopeptidase,PEP)也称脯氨酰寡肽酶,是一种能特异性水解低分子质量多肽链(<30 个氨基酸)羧基端脯氨酸残基的细胞内丝氨酸蛋白酶。在哺乳动物中,PEP参与组织中多种生理功能[1-2],如学习和记忆、细胞分裂与分化、信号转导、蛋白质分泌,可降解Substance P、激素样肽、神经活性肽等[3-6]。当PEP表达水平上调时,通常会导致一些神经性疾病,如阿尔兹海默症、健忘症、抑郁症和精神分裂症的发生[7]。PEP三级结构模型[8-9]显示,其催化结构域由α/β-折叠组合,其中C末端共价连接七叶-β-螺旋桨非催化域,两区域界面的空腔形成该酶的活性位点。因为β-螺旋桨结构的存在,形成了PEP只能酶切小分子质量多肽链的特点,也为PEP抑制剂(肽)的制备和设计提供了依据。目前,普拉西坦、JTP-4819[10]、S-17092[11]和KYP-2047[12]等化学合成的PEP抑制药物,在神经保护和认知增强方面均已表现良好的临床治疗效果[13]。由于化学合成药物可能有不可预估的药理副作用,近年来天然来源的PEP抑制肽受到关注。Sila等[14]发现,酸性蛋白酶水解鲃属鱼(Barbus callensis)鱼皮明胶产物可显著抑制PEP的活性。Martinez-Alvarez等[15]发现,模拟胃、肠液消化后的沙丁鱼和金枪鱼肌肉蛋白水解液也具有PEP抑制效果。Hsieh等[16]从酪蛋白钠酶解液中分离得到多种高活性的PEP抑制肽。Hellinger等[17]也从九尾属的草药中分离得到对人PEP具有抑制作用的植物源天然环肽。Manzanares等[18]发现,乳铁蛋白源PEP抑制肽PKH8和PKH11对PEP表现出抑制能力,而这种抑制还能消除神经母细胞瘤细胞中β淀粉样肽的形成。以上研究均表明,动物和植物源的生物活性肽是抑制PEP活性的潜在物质。
坛紫菜(Porphyra haitanensis)是福建省特色优势海洋藻类,具有较高的经济价值。据统计,2016年福建省紫菜养殖面积1.7万 公顷,年产量达6.6万 t[19]。紫菜含有丰富的营养成分,如蛋白质、多糖、脂类、维生素和矿物质等。藻胆蛋白是红藻和蓝藻特有的捕光色素蛋白,它包括藻红蛋白(R-phycoerythrin,R-PE)、藻蓝蛋白、别藻蓝蛋白及藻红蓝蛋白4 种色素蛋白。紫菜中R-PE含量较高,最高可达干质量的2.43%[20]。
近年来,国内外以动植物源蛋白为原料利用酶法制备生物活性肽的报道较多,特别是与高血压相关的血管紧张素转移酶抑制肽[21-26]。本课题组也利用胃、肠液蛋白酶对红毛藻R-PE分解并分离制备了2 种血管紧张素转移酶抑制肽[27]。但红毛藻原料价格昂贵,制备活性肽成本高。坛紫菜中R-PE含量丰富,且以坛紫菜为原料制备PEP抑制肽的研究还鲜有报道。此外,采用非胃、肠液蛋白酶制备的活性肽尽管在体外具有生物活性,但人体摄入经胃、肠液进一步消化后其活性会有所改变。因此,本研究拟以坛紫菜为研究对象,探讨胃、肠液蛋白酶对其消化特性,分析消化产物的PEP抑制活性,并优化制备PEP抑制肽的酶解条件,以期为坛紫菜高值化利用提供理论参考。
1 材料与方法
1.1 材料与试剂
干坛紫菜购于厦门市集美区新华都超市。
DEAE-Sepharose阴离子交换层析树脂 美国GE Healthcare公司;荧光底物succinylglcyl-L-proline 4-methylcoumaryl-7-amide(Suc-Gly-Pro-MCA) 日本Peptide Institute公司;猪胃蛋白酶、猪胰凝乳蛋白酶美国Sigma-Aldrich公司;猪胰蛋白酶 上海麦克林生化科技有限公司(中国);高纯度猪脑PEP 本实验室制备;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)用标准蛋白 美国Fermentas公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PT-2100组织捣碎机 瑞士Kinematica公司;Avanti J-26S XP高速冷冻离心机 美国Beckman公司;Lamda 35紫外分光光度计 美国Perkin Elmer公司;FP-6200荧光分光光度计 日本Jasco公司;凝胶成像仪 英国Syngene公司;ND-100微量蛋白核酸测定仪 德国NanoDrop公司;Starter 3100 pH计 美国Ohaus公司;AKTA Basic UPC 10蛋白质及多肽纯化装置 美国GE Healthcare公司;1260VL高效液相色谱仪 美国Agilent公司;恒温水浴锅 德国Memmert公司;蛋白质电泳装置 美国Bio-Rad公司。
1.3 方法
1.3.1 坛紫菜模拟胃、肠液消化
模拟胃、肠液消化实验模拟胃、肠液配制参考美国药典[28]的方法。胃液配制:1 L模拟胃液中含2 g氯化钠,用1 mol/L盐酸调pH 1.2;肠液配制:1 L模拟肠液中含6.8 g磷酸二氢钾,用1 mol/L氢氧化钠溶液调pH 7.5。
坛紫菜体外模拟胃、肠液消化实验参照黄园园等[29]的方法,胃蛋白酶(≥250 U/mg)、混合酶(即胰蛋白酶(250 U/mg)和胰凝乳蛋白酶(≥40 U/mg)质量比为1∶1)与坛紫菜粉末的比例为1∶50(m/m)。将20 g坛紫菜粉末与400 mL超纯水混合后组织捣碎机匀浆10 min,然后将匀浆液稀释50 倍后待用。模拟胃液消化:取已稀释均浆液4 mL于15 mL离心管,在37 ℃恒温水浴预热10 min后,加入0.08 mg/mL胃蛋白酶1 mL,振荡混匀,反应60 min后立即加入300 μL 0.2 mol/L碳酸钠溶液,调整pH 7.5,终止反应,该反应液为模拟胃液消化产物;模拟肠液消化:模拟胃液消化产物,继续加入1 mL含混合酶(0.08 mg/mL)的模拟肠液,37 ℃反应120 min后,在95 ℃加热5 min使混合酶失活,终止反应。测定坛紫菜模拟胃、肠液消化产物的PEP抑制活性。
1.3.2 R-PE的分离纯化
坛紫菜R-PE的分离纯化参考付晓苹[30]的方法。坛紫菜与蒸馏水按1∶20(g/mL)比例混合,经反复冻融、组织匀浆等处理以充分破碎细胞,制成坛紫菜R-PE粗提液。离心后取上清液,进行35%~50%硫酸铵盐析,沉淀复溶于20 mmol/L磷酸缓冲液(pH 5.6),并用相同缓冲液透析,将透析后的样品上样于预先用20 mmol/L磷酸缓冲液(pH 5.6)平衡好的DEAE-Sepharose阴离子交换层析柱(2.5 cm×10 cm),上样结束后用平衡缓冲液流洗层析柱直至洗脱液在波长280 nm下的紫外吸光度低于0.05,再用20 mmol/L磷酸缓冲液(含0.05 mol/L氯化钠,pH 5.6)和20 mmol/L磷酸二氢钠溶液(含0.2 mol/L氯化钠)进行线性洗脱。
纯化样品冷冻干燥后于-20 ℃贮存备用。利用Tricine-SDS-PAGE[30]和吸光度A565nm/A280nm分析样品纯度,在400~700 nm波长范围内对纯化的样品进行光吸收值扫描分析紫外-可见光吸收光谱特性。
1.3.3 蛋白质含量测定
纯化过程中,使用微量蛋白核酸测定仪测定样品在280 nm的吸光度;纯化的R-PE使用Bradford法测定其蛋白质含量,以牛血清白蛋白为标准蛋白。
1.3.4 酶法制备PEP抑制肽的条件优化
利用主要消化酶(胃蛋白酶和混合酶)分步酶解纯化的R-PE制备PEP抑制肽。在模拟胃、肠液消化的基础上,分析不同含量蛋白酶和酶解时间对PEP抑制活性的影响。
第1阶段酶解,选取胃蛋白酶和纯化的R-PE(1 mg/mL)比例(m/m)为:0.05%、0.1%、0.25%、0.5%、1%,在37 ℃对R-PE酶解60 min,测定不同水解液的PEP抑制活性,确定最适的胃蛋白酶添加量。在最适胃蛋白酶添加量下对R-PE酶解0、1、2、5、10、15、30、60 min,测定不同水解液的PEP抑制活性,以确定最佳的胃蛋白酶酶解时间。
利用以上优化的条件对R-PE(1 mg/mL)进行酶解,将水解产物进行第2阶段酶解,选取混合酶和纯化的R-PE(1 mg/mL)比例(m/m)为0.05%、0.1%、0.25%、0.5%、1%,在37 ℃恒温反应120 min,测定不同水解液的PEP抑制活性,确定最适的混合酶添加量。之后,再做进一步探究,以确定混合酶的最佳反应时间。
1.3.5 PEP抑制活性测定
参考Hellinger等[17]方法略作修改。具体方法如下:将100 μL质量浓度为40 μg/mL的PEP(28.7 U/mg)置于750 μL 25 mmol/L磷酸缓冲液(含4 mmol/L β-巯基乙醇,pH 6.0)中,加入100 μL R-PE水解液,30 ℃恒温反应15 min。加入50 μL浓度为10 μmol/L的荧光底物Suc-Gly-Pro-MCA,充分混匀,37 ℃恒温水浴反应30 min后,用1.5 mL终止液(甲醇-异丙醇-超纯水(35∶30∶35,V/V))终止反应。采用荧光分光光度计测定反应荧光底物释放的7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)的荧光强度,测定的激发波长和发射波长分别为380 nm和450 nm。对照组以100 μL 25 mmol/L磷酸缓冲液替换R-PE水解液。
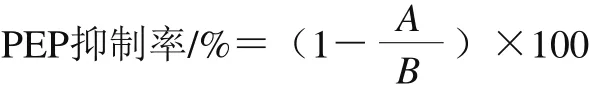
式中:A为实验组的荧光强度;B为对照组的荧光强度。
R-PE水解液的IC50测定参考Hsieh等[16]方法,并略作修改。根据以上方法,测定不同质量浓度R-PE水解液的PEP抑制率。以不同质量浓度R-PE水解液为横坐标和对应PEP抑制率为纵坐标作图分析。
1.3.6 R-PE水解液的Tricine-SDS-PAGE分析
R-PE的水解效果采用Tricine-SDS-PAGE分析,主要参考Schãgger[31]的方法。电泳结束后,用考马斯亮蓝染色液对凝胶染色,之后,用脱色液脱色至蛋白条带清晰,用凝胶记录仪记录结果。
1.3.7 R-PE水解液分子质量分布比例测定
采用高效凝胶过滤色谱法,参考伍强[27]的方法,略作修改。相对分子质量校正曲线所用标准品如下:鱼小清蛋白II,11 950 Da;50肽(HDGKGLFYNSYPDQEG KSDGTETSTNLHQKLYYHVLGTPQSEDVLCAEFP),5 617.97 Da;杆菌肽,1 422.69 Da;Gly-Gly-Arg-Tyr,451.48 Da;Tyr,181.19 Da。
色谱条件:GF-1260 Agilent HPLC,纯化系统;色谱柱为TSK gel G2000 SWXL(300 mm×7.8 mm);流动相为乙腈-水-三氟乙酸(45∶55∶0.1,V/V);紫外检测波长220 nm;进样体积10 μL(标准品)和50 μL(待测样品);流速1 mL/min;柱温25 ℃。所得数据利用GPC Offline软件进行分析,确定样品分子质量的分布比例。
1.3.8 R-PE水解液对PEP的抑制类型及抑制常数分析
参考陈清西[32]的方法,并略作修改。
抑制类型分析:分别取100 μL不同质量浓度PEP(0、5、10、20、30、40 μg/mL)置于750 μL、25 mmol/L磷酸缓冲液(含4 mmol/L β-巯基乙醇,pH 6.0)中,与100 μL不同质量浓度R-PE水解液(0、0.025、0.05、0.1 mg/mL)混合,再加入50 μL浓度为10 μmol/L的荧光底物Suc-Gly-Pro-MCA,充分混匀,在37 ℃恒温水浴反应5 min后,加入1.5 mL终止液终止反应。用荧光分光光度计测定反应荧光底物释放的AMC,由此计算反应的初速率,以PEP质量浓度对反应速率作图,分析R-PE水解液对PEP的抑制类型。
抑制常数的测定:分别取100 μL 20 μg/mL PEP置于750 μL 25 mmol/L磷酸缓冲液(含4 mmol/L β-巯基乙醇,pH 6.0)中,加入100 μL不同质量浓度R-PE水解液(0、0.025、0.05、0.1 mg/mL),再加入不同浓度荧光底物Suc-Gly-Pro-MCA(0、2.5、5、7.5、10、20 μmol/L),充分混匀,在37 ℃恒温水浴反应5 min,终止反应。计算酶促反应初速率,通过Lineweaver-Burk双倒数作图法计算R-PE水解液对PEP的抑制常数。
1.4 数据分析
本研究有关PEP抑制数据处理中,以同一组内3 个重复样品的平均变异系数为组内误差进行分析。利用SPSS Statistics 17.0计算机程序对实验数据进行方差分析。
2 结果与分析
2.1 坛紫菜模拟胃、肠液消化
坛紫菜经体外模拟胃、肠液消化后,水解产物的PEP抑制活性结果如图1所示。消化60 min后,产物中PEP抑制活性显著提高;继续经模拟肠液消化120 min后,终产物的PEP抑制活性没有明显变化。由此可知,坛紫菜中的蛋白质是PEP抑制活性肽的潜在资源,且胃、肠液,特别是胃液消化有助于提高其对PEP的抑制活性。

图1 坛紫菜模拟胃、肠液消化产物的PEP抑制活性Fig. 1 PEP inhibitory activity of P. haitanensis hydrolysates from simulated gastrointestinal digestion
2.2 R-PE的分离纯化
由表1可知,坛紫菜经硫酸铵盐析、DEAE-Sepharose阴离子交换柱层析,分离得到R-PE,纯化倍数为6.0 倍,得率达17.0%。该R-PE纯度系数(A565nm/A280nm=5.4)较红毛藻源R-PE(A565nm/A280nm=5.1)高[27],达到试剂级(>4.0)[33],但其得率较红毛藻源R-PE(43.4%)低。对纯化R-PE进行紫外光谱特性和Tricine-SDS-PAGE分析,结果如图2所示。其中,紫外-可见吸收光谱特性(图2a)与文献报道的坛紫菜源R-PE在499 nm和565 nm波长处均有最大特征吸收峰基本一致。Tricine-SDS-PAGE分析(图2b)发现纯化R-PE有3 个亚基α、β和γ,分子质量分别为21、22、32 kDa,与付晓苹[30]报道坛紫菜R-PE的SDS-PAGE结果一致。以上结果表明,通过硫酸铵盐析和DEAE-Sepharose阴离子交换柱层析等技术分离纯化可得到高纯度的R-PE。
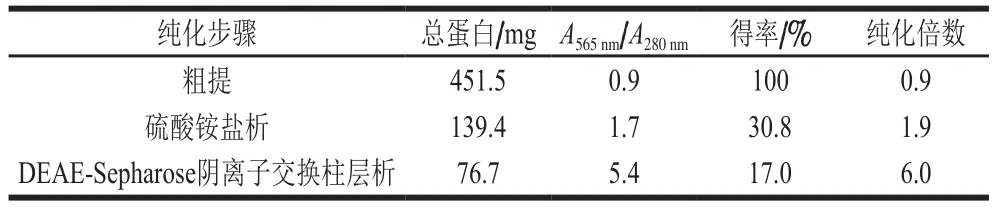
表1 坛紫菜R-PE的纯化结果Table 1 Summary of purification of R-PE from P. haitanensis
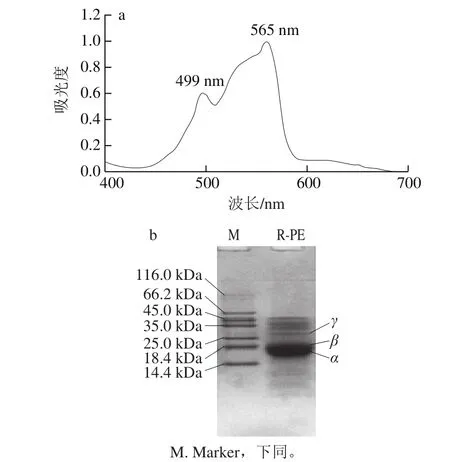
图2 坛紫菜R-PE紫外-可见光吸收光谱图(a)和Tricine-SDS-PAGE图(b)Fig. 2 UV absorption spectrum (a) and Tricine-SDS-PAGE (b) of purified R-PE from P. haitanensi
2.3 酶法制备PEP抑制肽的条件确定
2.3.1 胃蛋白酶比例及消化时间的确定
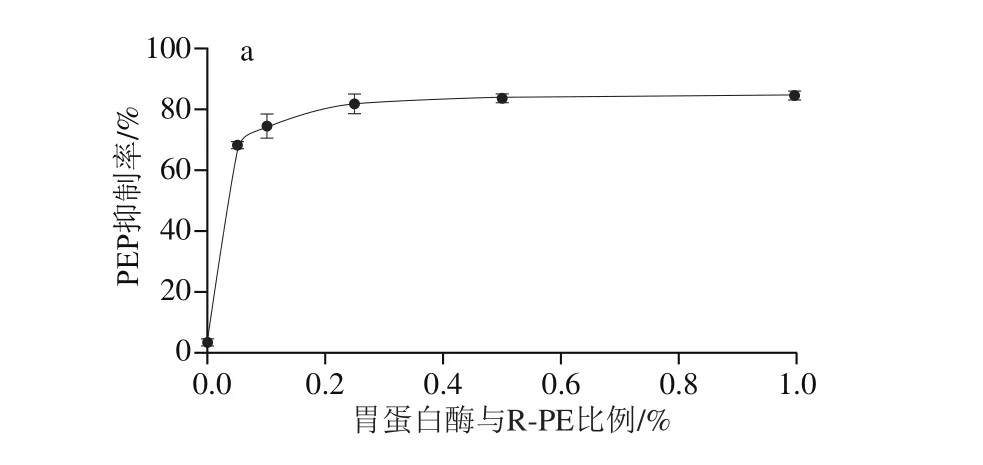
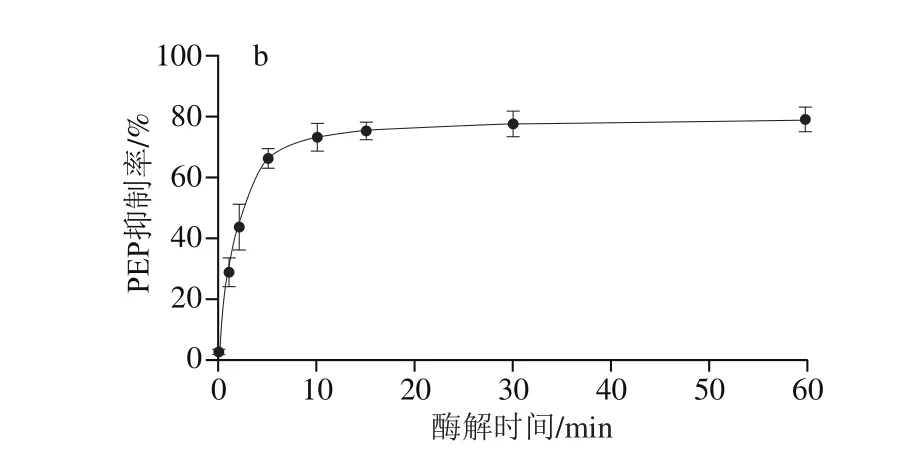
图3 第1阶段酶解胃蛋白酶添加量(a)及酶解时间(b)对R-PE水解液PEP抑制活性的影响Fig. 3 Effect of pepsin dosage (a) and digestion duration (b) on the PEP inhibitory activity of R-PE hydrolysate
由图3a可知,随着胃蛋白酶比例增加,R-PE消化产物中PEP抑制活性明显增加,当胃蛋白酶和R-PE比例为0.5%(m/m)时,其水解产物中PEP抑制活性最强。但继续增大加酶量,产物对PEP抑制活性不再增加,推测在该条件下R-PE中胃蛋白酶的酶切位点已被充分酶解,由此确定胃蛋白酶添加量为0.5%。
进一步分析酶解时间对R-PE水解产物的PEP抑制活性影响,如图3b所示,在30 min内,R-PE水解产物的PEP抑制活性随酶解时间延长而逐渐增强,且在酶解时间为30 min时R-PE水解产物中PEP抑制活性最强;继续延长时间,在30~60 min范围,酶解时间对R-PE水解液中PEP抑制活性影响较小。由此可知,利用R-PE酶法制备PEP抑制肽的第1阶段酶解条件为:胃蛋白酶与R-PE比例0.5%(m/m)、酶解时间30 min,pH 1.2,温度37 ℃。
2.3.2 混合酶比例及消化时间的确定

图4 混合酶添加量(a)及酶解时间(b)对R-PE水解液PEP抑制活性的影响Fig. 4 Effect of T + C dosage (a) and digestion duration (b) on the PEP inhibitory activity of R-PE hydrolysate
利用2.3.1节优化的酶解条件对R-PE进行第1阶段酶解后将水解产物进行第2阶段酶解,不同比例混合酶对消化产物中PEP抑制活性的影响如图4a所示,混合酶与R-PE比例为0.25%(m/m)时,终产物的PEP抑制活性最强,继续增大加酶量的水解产物对PEP抑制活性反而有下降趋势,推测模拟胃液消化产生的某些活性肽被混合酶过度降解可失去PEP抑制活性。
在R-PE中加入0.5%胃蛋白酶,酶解30 min后进行第2阶段酶解,混合酶添加量为0.25%,研究酶解时间对产物的PEP抑制活性影响,如图4b所示,当连续酶解至60 min时,终产物的PEP抑制活性最强。由此可知,利用R-PE酶法制备PEP抑制肽的第2阶段酶解条件为混合酶与R-PE比例0.25%(m/m)、酶解时间30 min、pH 7.5、温度37 ℃。
2.4 R-PE水解液的Tricine-SDS-PAGE分析
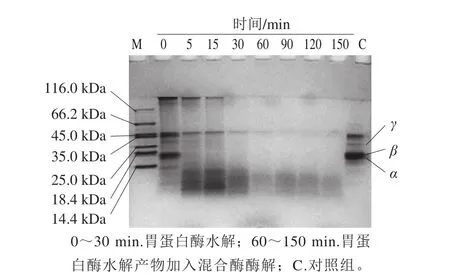
图5 R-PE水解液的Tricine-SDS-PAGEFig. 5 Tricine-SDS-PAGE pattern of R-PE hydrolysate
如图5所示,与酶解前的蛋白(泳道C)相比,胃蛋白酶和混合酶对R-PE均有明显的消化作用。在胃蛋白酶酶解5 min后,R-PE的α亚基、β亚基、γ亚基发生显著的降解;酶解5~30 min范围内,水解产物被胃蛋白酶继续降解;之后,进行第2阶段酶解,在30~60 min范围进一步被降解为更小分子的产物,而在90~150 min范围,酶解变化不明显,与图4b 60~150 min的水解产物PEP抑制活性差异不显著结果一致。
2.5 R-PE水解液的分子质量分布

表2 R-PE酶解产物的分子质量分布及所占比例Table 2 Molecular mass distribution of R-PE hydrolysate
如表2所示,由GPC软件分析可知,R-PE在酶解过程中,酶解产物的蛋白分子质量变化是一个渐进的过程。R-PE是由分子质量分别为21、22、32 kDa的3 个亚基α、β和γ组成的蛋白质,第1阶段酶解后,65.94%酶解产物的分子质量小于3 kDa;继续酶解,到第2阶段水解完毕,分子质量低于3 kDa的酶解产物的比例增至86.06%,分子质量高于5 kDa的酶解产物的比例由24.30%降至4.52%。R-PE酶解产物的分子质量分布色谱图如图6所示,比较图6a与图6b,经过第1阶段胃蛋白酶酶解的R-PE,在第2阶段经混合酶得到进一步水解,特别是对分子质量大于5 kDa产物的酶解作用效果显著。由此知,经过两步酶解的R-PE几乎被完全水解,表明利用胃蛋白酶、混合酶对R-PE进行分步酶解,可制备出低分子质量、较高活性的R-PE源PEP抑制肽。
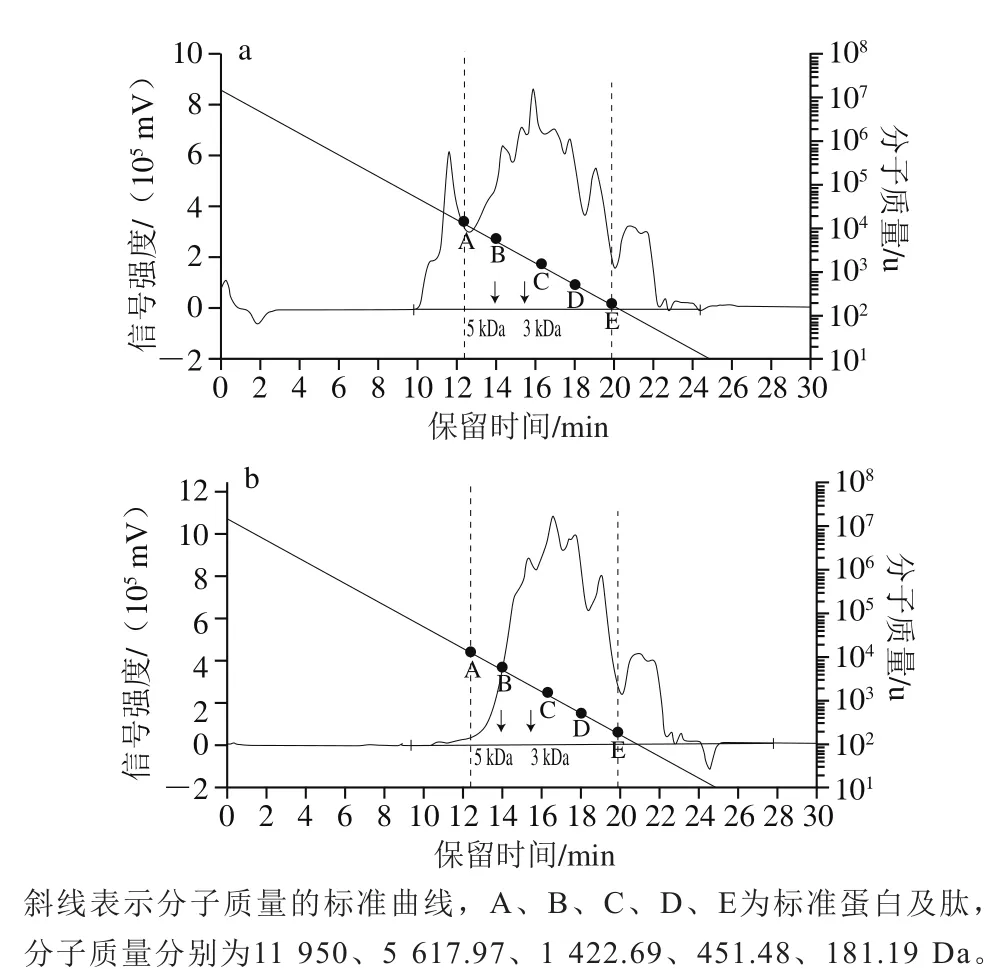
图6 胃蛋白酶(a)和混合酶(b)R-PE酶解产物的分子质量分布Fig. 6 Molecular mass distribution of peptide fractions from R-PE hydrolysate
2.6 R-PE水解液的PEP抑制活性
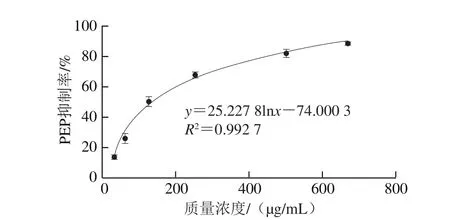
图7 不同质量浓度R-PE水解液的PEP抑制活性Fig. 7 PEP inhibitory activity of R-PE hydrolysate at different concentrations
根据PEP抑制活性的检测方法,将R-PE水解液稀释为不同浓度,分别测定对PEP的抑制率。以不同质量浓度R-PE水解液(31.25~666.67 μg/mL)为横坐标,对应的PEP抑制率(13.59%~88.40%)为纵坐标作图分析,结果如图7所示。R-PE水解液的PEP抑制活性IC50为136.35 μg/mL,低于其他动物来源的PEP抑制肽的IC50,如沙丁鱼鱼头水解液IC50(9 570±1 480)μg/mL[15]、金枪鱼鱼头水解液IC50(3 300±1 050)μg/mL[15]、酪蛋白钠水解产物IC50(770 μg/mL)[16]、乳铁蛋白源PEP抑制肽PKH11的IC50(2 100±200)μg/mL[18]。因此,经胃蛋白酶和混合酶酶解的R-PE水解产物具有更显著的PEP抑制活性。
2.7 R-PE水解液对PEP的抑制类型及抑制常数分析
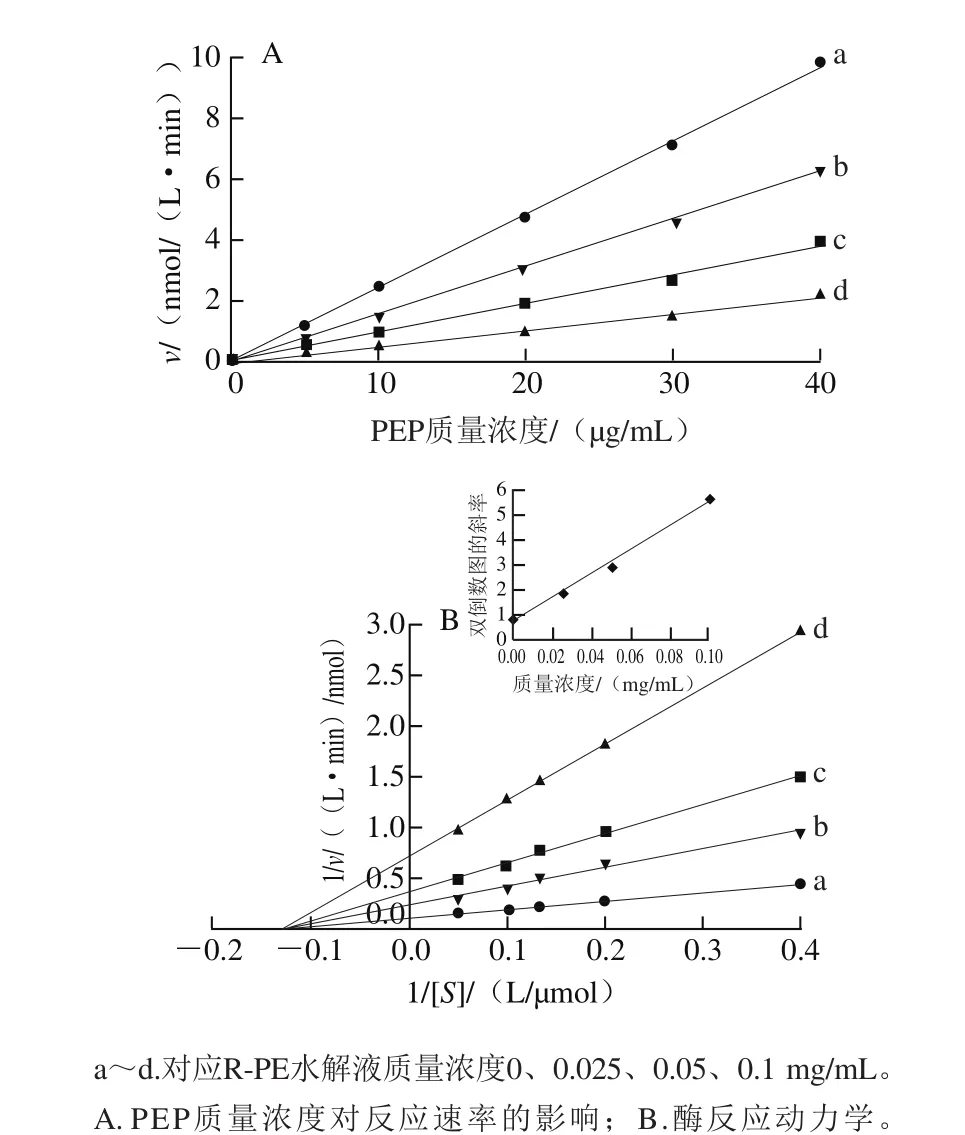
图8 R-PE水解液对PEP的抑制动力学Fig. 8 Kinetic study on inhibition of R-PE hydrolysate on PEP
图8 A显示不同质量浓度R-PE水解液(0、0.025、0.05、0.1 mg/mL)作用PEP的抑制动力学曲线均为通过原点的直线,可知R-PE水解液对PEP的抑制作用是可逆过程。如图8B所示,不同质量浓度R-PE水解液存在时Lineweaver-Burk双倒数曲线相交于X轴,说明R-PE水解液对PEP表现为非竞争性抑制。进一步运用二次作图法,以双倒数图的斜率对R-PE水解液质量浓度作图,从横轴截距可求出其抑制常数Ki为14 μg/mL。与从酪蛋白钠酶解液中分离得到9 种PEP抑制肽[20]的竞争性抑制类型不同,R-PE水解液对PEP的抑制属于可逆非竞争性抑制,说明R-PE水解液中PEP抑制肽没有与PEP酶催化区域结合而是作用于其他位点,形成中间复合体从而抑制PEP的活性。
3 结 论
本研究以福建高产的坛紫菜为原料,利用硫酸铵盐析和离子交换技术获得高纯度藻红蛋白,为对该蛋白的食品学功能分析创造了条件。利用胃、肠液消化酶分步酶解坛紫菜R-PE,并优化酶解条件获得PEP抑制肽的制备工艺。采用Tricine-SDS-PAGE验证酶解效果,凝胶过滤色谱法测得R-PE水解液中分子质量在3 kDa以下的小肽含量为86.06%。制备的R-PE酶解液通过可逆非竞争性抑制模式对PEP表现较高的抑制活性,其IC50为136.35 μg/mL。紫菜中含量丰富的R-PE是潜在的PEP抑制活性肽来源,今后有必要对PEP抑制肽进行分离纯化并解明它们的结构。本研究为坛紫菜作为功能性食品的高值化利用提供了理论参考。
