枯草芽孢杆菌壳聚糖酶在毕赤酵母中的高效表达及其酶解特性
2019-07-26杨绍青刘翊昊闫巧娟江正强
马 帅,杨绍青,刘翊昊,闫巧娟,江正强,*
(1.北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业大学工学院,北京 100083)
壳聚糖是几丁质部分脱乙酰的产物,由D-氨基葡萄糖和N-乙酰-D-氨葡萄糖以β-(1,4)-糖苷键随机连接而成的直链天然多聚物[1]。壳寡糖是壳聚糖降解的产物,聚合度(degree of polymerization,DP)一般在2~10之间,其分子质量低,水溶性好,具有许多生理活性,如抑菌性、抗氧化、抗肿瘤、降胆固醇、降血压、防感染以及控制关节炎等,广泛应用于食品、医药、农业和化妆品等领域[2]。壳聚糖酶是专一降解壳聚糖的酶类,分为糖苷水解酶(glycoside hydrolases,GH)5、7、8、46、75和80家族,包括两类:一类是内切型壳聚糖酶(EC3.2.1.132),从还原端在壳聚糖链中随机切割β-(1,4)-糖苷键,产生不同DP的壳寡糖及氨基葡萄糖;另一类是外切型壳聚糖酶(EC3.2.1.165),也称为β-D-葡萄糖胺酶,是从非还原端切割β-(1,4)-糖苷键,产生氨基葡萄糖[3]。
壳聚糖酶来源广泛,主要为细菌和真菌,少数来源于植物组织和病毒[3-4]。近年来已筛选到多株产壳聚糖酶的菌株[4-6],但是野生型菌株产酶水平低,难以满足工业生产和应用的要求,采用异源表达提高产酶水平逐渐成为研究的重点。自1991年成功从变铅青链霉菌TK-24中克隆表达了壳聚糖酶后[7],近年来已克隆出许多微生物壳聚糖酶基因,并在不同宿主中表达[8-15],但是仅少数研究实现了高水平。如Chen Xiaomei[16]和Huang Liang[17]等将烟曲霉壳聚糖酶基因分别在毕赤酵母和大肠杆菌中表达,高密度发酵后酶活力为25 000 U/mL和14 000 U/mL,这分别是壳聚糖酶在毕赤酵母和大肠杆菌分泌表达中的最高水平。
枯草芽孢杆菌(Bacillus subtilis)壳聚糖酶的基因克隆表达研究较多,但酶比活力及产酶水平大都偏低。Rivas等[18]将枯草芽孢杆菌168壳聚糖酶基因在该菌株中表达,酶比活力仅56.9 U/mg。Pechsrichuang[9]和Su Pocheng[12]等又将该基因在大肠杆菌及枯草芽孢杆菌中分泌表达,高密度发酵后酶活力分别仅为45 U/mL和208.23 U/mL。Lin等[8]将枯草芽孢杆菌NCHU-05的壳聚糖酶基因分别在大肠杆菌和枯草芽孢杆菌中表达,酶比活力分别为3 655 U/mg和3 780 U/mg。Kang Linxin等[19]将枯草芽孢杆菌HD145壳聚糖酶基因在毕赤酵母中表达,其酶比活力为9 000 U/mg,但是没有报道高密度发酵情况。
壳聚糖酶在农业生物防治、壳寡糖的制备及海产品废物处理等方面具有重要的应用价值,转化壳聚糖为壳寡糖是壳聚糖酶在工业上重要的应用之一[3]。化学法、物理法[20-21]制备壳寡糖存在工艺条件难控制、环境污染大、低寡糖产率、产品中常伴大量单糖等缺点。酶法制备壳寡糖具有条件温和、过程易控制、对环境友好、产率高单糖少等优点而成为工业生产壳寡糖的首选方法。壳聚糖酶是酶法制备壳寡糖的关键酶[3]。由于壳寡糖具有重要的应用价值,挖掘高活性壳聚糖酶并提高其产酶水平是酶法制备壳寡糖的关键和研究的热点。枯草芽孢杆菌WY-34是本实验室筛选的1 株高产甘露聚糖酶的菌株[22],前期研究从中克隆了1 个GH46家族壳聚糖酶基因并在大肠杆菌中表达[23],但不适宜工业化应用。为提高该酶工业应用前景,本研究将该酶在巴斯德毕赤酵母GS115中表达,并研究重组酶的性质和酶解特性。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌WY-34为本实验室筛选并保存;大肠杆菌DH5α 博迈德生物技术公司;表达载体pPIC9K、巴斯德毕赤酵母(Pichia pastoris)GS115 美国Invitrogen公司。
限制性内切酶EcoR I、Not I、T4 DNA连接酶 大连TaKaRa公司;TransStart Fast pfu DNA polymerase 北京全式金生物技术公司;壳聚糖(脱乙酰度75%~85%)、几丁质、乙二醇壳聚糖、羧甲基纤维素、微晶纤维素和氨基葡萄糖(GlcN) 美国Sigma公司;乙二醇几丁质日本Wako公司;壳聚糖(脱乙酰度85%)为国产分析纯;壳寡糖((GlcN)2、(GlcN)3、(GlcN)4、(GlcN)5、(GlcN)6)标准品 青岛博智汇力生物科技有限公司。
1.2 仪器与设备
MyCycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;TU-1901紫外-可见分光光度计 北京普析通用仪器设备有限公司;5 L发酵罐 上海国强生化工程有限公司;蛋白纯化系统 上海青浦沪西仪器厂;Kieselgel 60硅胶板德国E. Merck公司;LGJ-10型冷冻干燥机 北京松源华兴生物技术公司;Dionex ICS-5000 SP离子色谱系统美国Thermo Fisher公司。
1.3 方法
1.3.1 壳聚糖酶基因密码子优化及其在毕赤酵母中的表达
将枯草芽孢杆菌WY-34壳聚糖酶基因序列[23]提交DNAWorks(http://mcl.ncifcrf.gov/dnaworks/)进行密码子优化,优化后的基因序列(BsCsn46)送至生工生物工程(上海)股份有限公司合成。采用Graphical Codon Usage Analyser(http://gcua.schodel.de/)分析密码子使用偏好性和Codon Adaptation Index Calculator(https://www.biologicscorp.com/tools/CAICalculator)分析基因密码子适应指数。根据密码子优化后的基因序列和表达载体pPIC9K的多克隆位点设计上游引物BsCsn46-F:AACCGGAATTCATGGGACTGAAT AAAGATCAAAAGC(下划线为EcoR I酶切位点);下游引物BsCsn46-R:AAGAATGCGGCCGCTTA TTTGATTACAAAATTACCGTAC(下划线为Not I酶切位点)。以密码子优化后的序列为模板,PCR程序:95 ℃、2 min;95 ℃、20 s;55 ℃、20 s;72 ℃、30 s;35 个循环;72 ℃后延伸5 min。PCR产物与pPIC9K用EcoR I和Not I双酶切,采用T4 DNA连接酶16 ℃连接,构建重组表达载体pPIC9K-BsCsn46,转化大肠杆菌DH5α,阳性克隆子送至生工生物工程(上海)股份有限公司(北京测序部)测序。重组表达载体电转化毕赤酵母、重组蛋白在巴斯德毕赤酵母GS115中的分泌表达及高拷贝转化子的筛选参考Multi-Copy Pichia Expression Kit(Invitrogen)。
1.3.2 BsCsn46高密度发酵
高密度发酵方法及培养基参照Pichia Fermentation Process Guideline(Invitrogen)。简言之,筛选获得的高酶活转化子接种150 mL YPD培养基,30 ℃、200 r/min培养至OD600nm约为10,作为种子液。高密度发酵选用5 L发酵罐,工作体积为1.5 L。分批发酵及甘油流加发酵时,采用28%氨水调pH 5.0,温度30 ℃,起始搅拌转速600 r/min,通气量1.5 m3/(m3·min)。待分批培养中甘油耗尽开始流加50%甘油6~8 h,通过控制流加补料速度监控溶氧大于20%。待菌体湿质量达到200 g/L后停止流加甘油,开始流加100%甲醇,更改pH值和转速分别为6.0和800 r/min。 通过控制甲醇流加速度监控溶氧大于20%,甲醇流加速率见表1。诱导开始每12 h取样测定菌体湿质量、胞外壳聚糖酶活力及胞外蛋白含量。
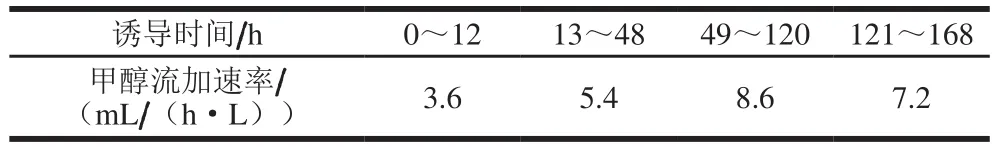
表1 诱导阶段甲醇流加补给速率Table 1 Methanol feeding rates in induction phases
1.3.3 壳聚糖酶活力及蛋白含量的测定
壳聚糖酶活力测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[24],以氨基葡萄糖为标准。500 μL 0.5 g/100 mL壳聚糖(脱乙酰度75%~85%)溶液和100 μL适当稀释的酶液混匀,于55 ℃保温10 min,加入500 μL DNS终止反应,沸水浴10 min显色。12 000 r/min离心10 min,取上清液于540 nm波长处测吸光度。酶活力定义:在上述反应条件下,反应每分钟释放1 μmoL还原糖所需的酶量定义为一个酶活力单位(U)。
蛋白含量测定参照Lowry法[25],以牛血清白蛋白为标准蛋白。
1.3.4 BsCsn46的纯化
发酵培养液10 000 r/min离心10 min,上清液采用50 mmol/L KH2PO4-NaOH(pH 8.0)缓冲液4 ℃透析12 h。透析样品经Q-Sepharose Fast Flow(1.0 cm×10 cm)强阴离子交换层析分离纯化,0.5 mL/min流速上样。层析柱预先用初始缓冲液(50 mmol/L KH2PO4-NaOH(pH 8.0))平衡。采用含有0~200 mmol/L NaCl的初始缓冲液以1.0 mL/min流速线性洗脱目的蛋白,通过测定OD280nm收集蛋白。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)检测蛋白纯度。
1.3.5 SDS-PAGE、去糖基化及壳聚糖酶酶谱分析
SDS-PAGE参照Laemmli等[26]的方法。
BsCsn46去糖基化分析采用去糖基化酶(endo-β-N-acetylglucosaminidase,Endo H),SDS-PAGE检测去糖基化结果,以不经去糖基化酶处理的样品作为对照。
壳聚糖酶酶谱参考Pechsrichuang等[9]方法稍作修改。SDS-PAGE分离胶中加入0.1 g/100 mL的壳聚糖,电泳完成后将分离胶在复性缓冲液(50 mmol/L KH2PO4-NaOH(pH 7.5),1 g/100 mL Triton X-100)中浸洗6~8 h;再将分离胶置于10 mmol/L乙酸-乙酸钠溶液(pH 6.0)中,45 ℃保温2 h。0.1 g/100 mL刚果红染色15 min,1 mol/L NaCl溶液脱色至条带清晰。
1.3.6 BsCsn46的酶学性质分析
最适pH值在3 种缓冲液(乙酸-乙酸钠 pH 3.5~6.0;MES pH 5.0~7.5;Bistris-HCl pH 5.5~7.5)条件下测定。用上述缓冲液配制0.5 g/100 mL的壳聚糖溶液,按照标准方法测定酶活力,以酶活力最高点为100%,分别计算不同pH值条件下的相对酶活力。pH值稳定性在6 种缓冲液(柠檬酸-柠檬酸三钠pH 3.0~6.0;乙酸-乙酸钠pH 3.5~6.0;NaH2PO4-Na2HPO4pH 6.0~8.0;Tris-HCl pH 7.0~9.0;CHES pH 8.0~10.0;CAPS pH 10.0~11.0)下测定,用上述缓冲液适当稀释酶液于45 ℃保温30 min,在最适条件下测定溶液残余酶活力。
用最适pH值的缓冲液配制底物,在25~80 ℃范围测定酶反应最适温度。以酶活力最高点为100%,分别计算不同温度条件下的相对酶活力。温度稳定性在20~60 ℃测定,将酶液分别在20~60 ℃保温30 min,冰水浴30 min后,测定残余酶活力。半衰期在45、50、55 ℃条件下测定,将酶液用50 mmol/L NaH2PO4-Na2HPO4溶液(pH 7.5)适当稀释后于上述温度下处理不同时间,测定溶液残余酶活力,计算不同温度下酶活力衰变至50%所需的时间。
1.3.7 BsCsn46底物特异性及水解特性
用50 mmol/L乙酸-乙酸钠(pH 6.0)缓冲液分别配制0.5 g/100 mL的壳聚糖、乙二醇壳聚糖、胶体几丁质、乙二醇几丁质、羧甲基纤维素钠及微晶纤维素溶液;按照标准方法测酶活力,考察酶对不同底物的特异性。
水解特性采用1 g/100 mL的壳聚糖(脱乙酰度85%)溶液(50 mmol/L pH 6.0乙酸-乙酸钠缓冲液),加酶量1 U/mL,45 ℃反应,间隔不同时间(0.25、0.5、1、2、4、8、12 h)取样,薄层层析法(thin-layer chromatography,TLC)分析水解产物。TLC条件:展层剂为正丙醇-25%氨水-水(3∶1∶1,V/V);显色剂为体积分数5%硫酸-甲醇溶液。
1.3.8 BsCsn46水解壳聚糖制备壳寡糖
采用3 g/100 mL壳聚糖(脱乙酰度85%,溶于0.1 mol/L乙酸溶液)溶液,加酶量6 U/mL,pH 6.0、45 ℃水解8 h,沸水浴5 min灭酶,加入适量5 mol/L NaOH溶液调pH值大于9,以沉淀未反应的壳聚糖,12 000 r/min离心15 min,上清液和沉淀分别冷冻干燥称质量。水解率及壳寡糖得率计算参考Qin Zhen等[14]方法,如式(1)、(2)所示:
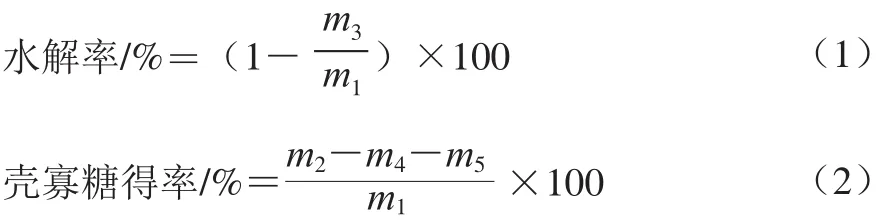
式中:m1为壳聚糖的质量;m2为上清液冷冻干燥后的质量;m3为沉淀冷冻干燥的质量;m4为乙酸的质量;m5为NaOH的质量。
1.3.9 水解产物成分分析及定量
采用基质辅助激光解吸电离飞行时间质谱(matrixassisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF MS)分析水解液的寡糖组成。水解液送北京中科百测技术服务有限公司进行质谱分析。采用AB SCIEX 4000 QTRAP系统,阳离子模式,基质为2,5-二羟基苯甲酸。
采用高效阴离子交换色谱(high-performance anionexchange chromatography,HPAEC)法对水解液的寡糖定量分析。取1 mL水解液加入等体积0.25 mol/L NaOH溶液,12 000 r/min离心10 min,上清液用于HPAEC分析。色谱柱:CarboPac PA1(4 mm×250 mm);检测器:电化学检测器(配备一个金电极和Ag/AgCl参比电极);流动相:100 mmol/L NaOH,0~25 mmol/L乙酸钠溶液线性洗脱30 min;进样量:25 μL;流速:0.5 mL/min;柱温:30 ℃。
寡糖得率计算如式(3)所示:

式中:Yn为DP 2~4的寡糖得率/%;Cn为DP 2~4的寡糖质量浓度/(mg/mL);V为水解反应总体积/mL;m为总壳聚糖的质量/mg。
1.4 数据处理
采用Origin 8.5进行数据统计和图片处理,数据均为3 次平行。
2 结果与分析
2.1 壳聚糖酶基因密码子优化及其在毕赤酵母中的高效表达
枯草芽孢杆菌壳聚糖酶基因经密码子优化将一些稀有密码子(CGG(Arg)、CGC(Arg)和GCA(Ala),在巴斯德毕赤酵母中的使用频率小于10%)替换为巴斯德毕赤酵母使用偏好的密码子,密码子适应指数由0.66提高到0.92,G+C含量由47.9%调整为51.8%,这说明优化后的序列与毕赤酵母密码子使用偏好性高度匹配。密码子优化后的基因序列(BsCsn46)已提交GenBank,登录号为MH715979。优化后的序列导入毕赤酵母中表达,转化子经遗传霉素抗性(G418)平板筛选后获得1 株高壳聚糖酶活力(414.4 U/mL)的重组菌株。该菌株在5 L发酵罐高密度发酵144 h后,胞外壳聚糖酶活力及蛋白质量浓度分别为50 370.0 U/mL和15.7 mg/mL,菌体湿质量高达428.6 g/L(图1a)。甲醇诱导过程中胞外蛋白组成的SDS-PAGE分析见图1b,随着诱导时间延长,目的条带逐渐变粗,发酵上清液中重组壳聚糖酶含量逐渐增多。
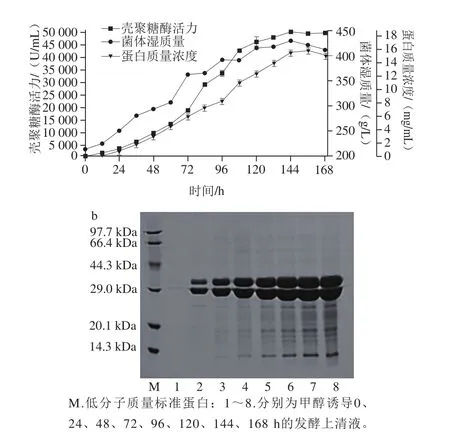
图1 BsCsn46毕赤酵母表达高密度发酵历程(a)及胞外蛋白SDS-PAGE分析(b)Fig. 1 Time course of BsCsn46 expression in P. pastoris (a) and SDS-PAGE profile of extracellular protein production (b) during high cell-density fermentation
密码子偏好、基因拷贝数和高密度发酵等是影响外源基因在毕赤酵母中表达的重要因素[27]。提高偏好密码子的使用频率及密码子适应指数是提高外源蛋白表达量的有效方法之一[27-28]。本研究通过密码子优化使得目的基因的密码子适应指数显著提高,具有在巴斯德毕赤酵母中高效表达的潜力。在一定范围内,增加基因拷贝数能够提高蛋白表达量[27]。研究通过G418抗性为筛选标记,从G418质量浓度为3 mg/mL的平板上筛选了1 株高壳聚糖酶活性的转化子,相当于12 个基因拷贝数,一定程度提高了蛋白表达量。甲醇流加策略是影响菌体密度和外源蛋白表达量的关键因素之一,适宜的甲醇流加速率是细胞形成高密度的关键[29]。根据溶氧反馈机制,采用甲醇四阶段流加策略,根据不同生长阶段溶氧变化调整甲醇流加速率,维持溶氧大于20%,避免了发酵过程中溶氧不足和甲醇累积,从而使菌体密度显著提升。在以上多种因素的共同影响下,目的蛋白的表达水平显著提高。与文献报道的壳聚糖酶基因克隆表达水平相比,该酶的表达水平远高于现有文献的重组壳聚糖酶高密度发酵水平(表2),具有很好的工业应用前景。
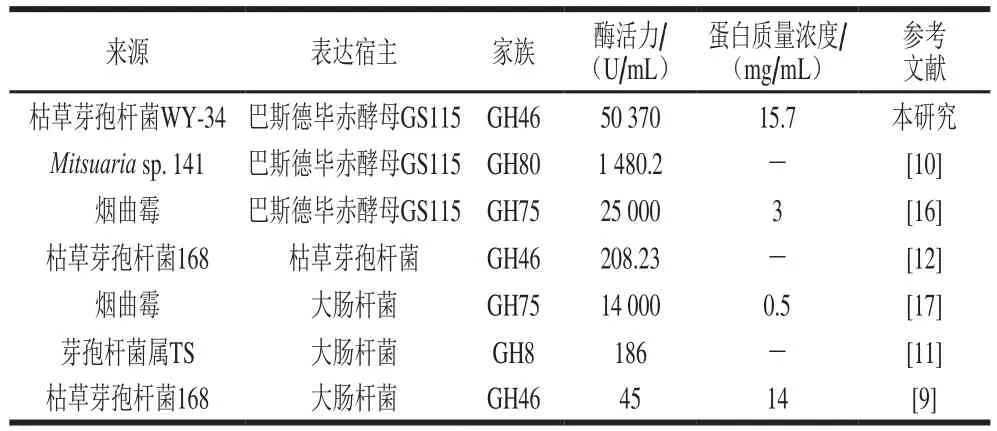
表2 壳聚糖酶基因异源表达水平Table 2 Heterologous expression levels of different chitosanases
2.2 BsCsn46的纯化
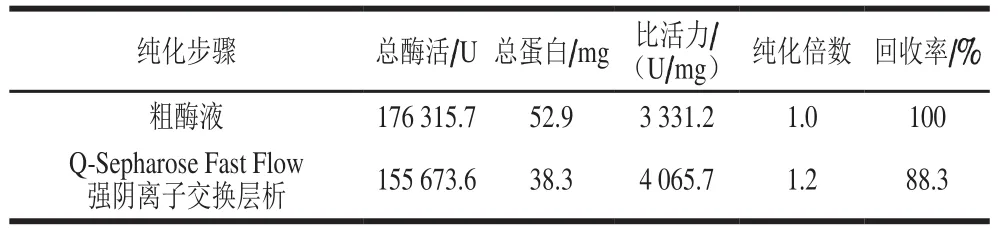
表3 BsCsn46的纯化Table 3 Purification of BsCsn46
粗酶液经一步Q-Sepharose Fast Flow强阴离子交换层析得到电泳级纯酶。纯酶比活力为4 065.7 U/mg,纯化过程中纯化倍数为1.2,酶活回收率为88.3%(表3)。如图2所示,粗酶和纯酶均有2 条明显条带,酶谱显示两条带均有壳聚糖酶活性;纯酶经Endo H处理后显示为一条带,说明重组酶发生了部分糖基化现象。纯酶经凝胶过滤法及SDS-PAGE法测得两条目的带分子质量分别为39、34 kDa及38、32 kDa,说明该酶为单亚基蛋白。
该酶具有很高的酶比活力,除枯草芽孢杆菌HD145壳聚糖酶(9 000 U/mg)[19]外,高于其他重组枯草芽孢杆菌壳聚糖酶的比活力,如大肠杆菌表达的枯草芽孢杆菌168壳聚糖酶(900 U/mg)[9]和枯草芽孢杆菌NCHU-05壳聚糖酶(3 655 U/mg)[8]、毕赤酵母表达的枯草芽孢杆菌CH2壳聚糖酶(338.1 U/mg)[30],也远高于其他重组芽孢杆菌属壳聚糖酶比活力,如毕赤酵母表达的苏云金芽孢杆菌BMB171壳聚糖酶(240 U/mg)[13]及大肠杆菌表达的芽孢杆菌属KCTC 0377BP壳聚糖酶(1 700 U/mg)[31]和芽孢杆菌属TS壳聚糖酶(555.3 U/mg)[11]。同时,研究结果远高于在大肠杆菌中表达该酶的酶比活力(1 051.8 U/mg)[23],可能是重组酶被糖基化的作用。
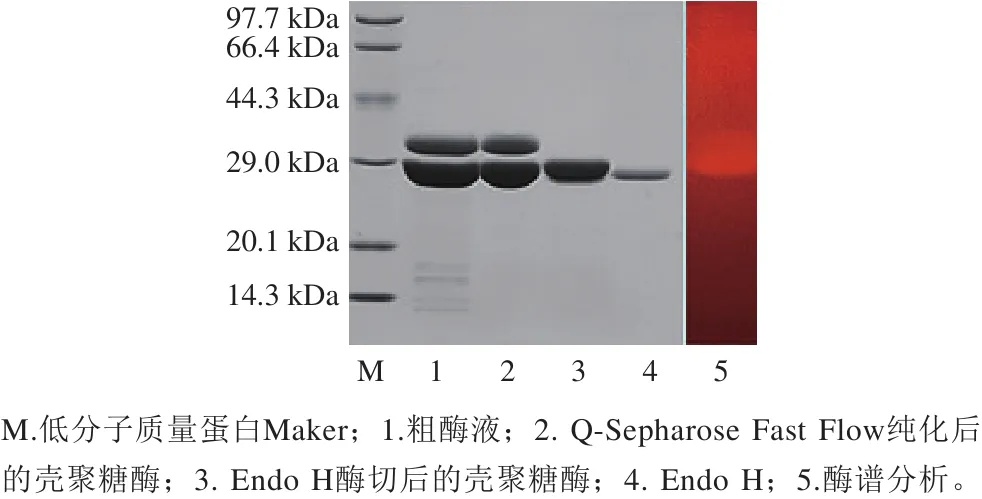
图2 BsCsn46纯化过程SDS-PAGE分析及去糖基化和酶谱分析Fig. 2 SDS-PAGE analysis of BsCsn46 purification and zymogram of deglycosylated BsCsn46
2.3 BsCsn46的酶学性质分析
BsCsn46最适pH值为6.0(图3a),在pH 4.5~10.0的缓冲液中处理30 min后,保持90%以上的残余酶活力(图3b);该酶最适温度为55 ℃(图3c),45 ℃以下处理30 min酶活力几乎没有变化(图3d);该酶在45、50 ℃及55 ℃的半衰期分别为3 468.4、91.9 min及4.9 min(图3e)。
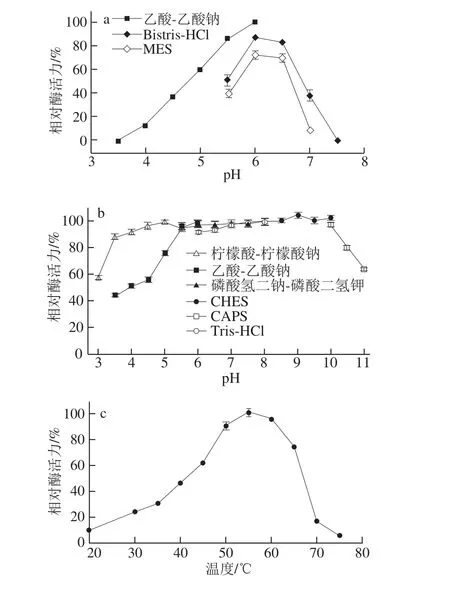
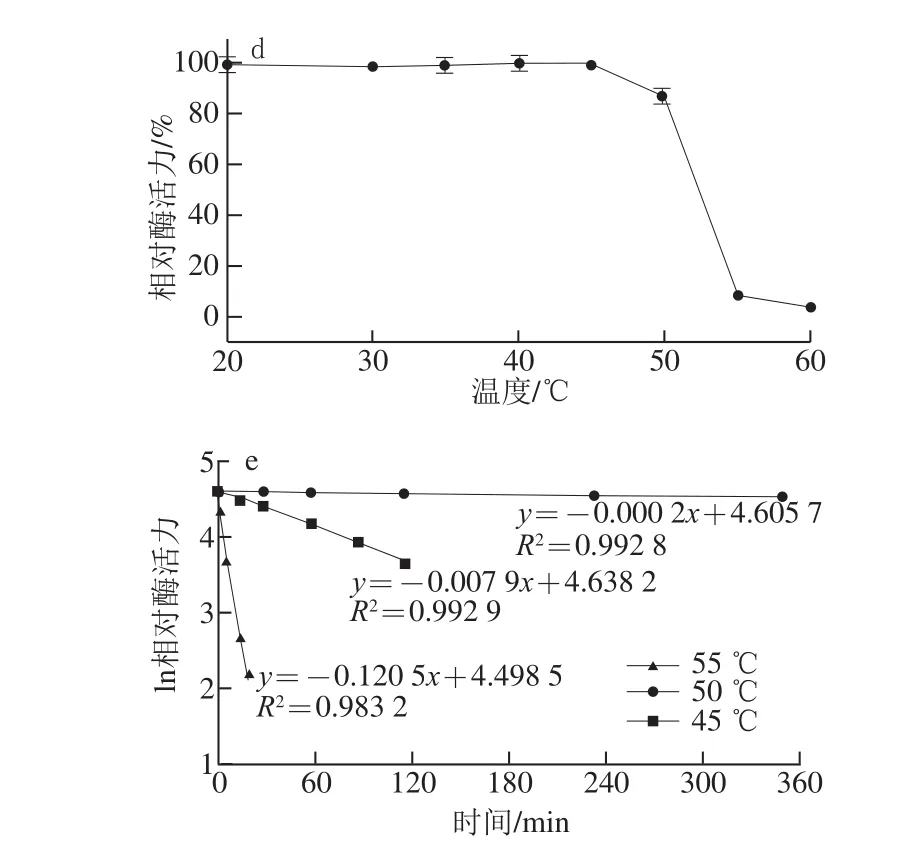
图3 BsCsn46的最适pH值(a)、pH稳定性(b)、最适温度(c)、温度稳定性(d)及半衰期(e)Fig. 3 Optimal pH (a), pH stability (b), optimal temperature (c),thermal stability (d) and thermal inactivation (e) of purified BsCsn46
微生物壳聚糖酶的最适pH值一般为弱酸性(pH 4.5~6.5),少数为弱碱性(pH 7.0~8.0),最适温度一般为30~60 ℃[3,15]。除报道的Paenibacillus sp. 1794和烟曲霉壳聚糖酶[1,16]外,大多数壳聚糖酶热稳定性较差。该酶性质和大多数壳聚糖酶相近(表4)。与该酶同源性最高的枯草芽孢杆菌168壳聚糖酶[9]相比,该酶最适温度较高,热稳定性较好;与在大肠杆菌中表达该酶的酶学性质[23]相比,该酶最适温度提高了10 ℃,热稳定性提高5 ℃,可能是该酶被糖基化修饰的结果,有研究报道糖基化能提高蛋白热稳定性[32]。
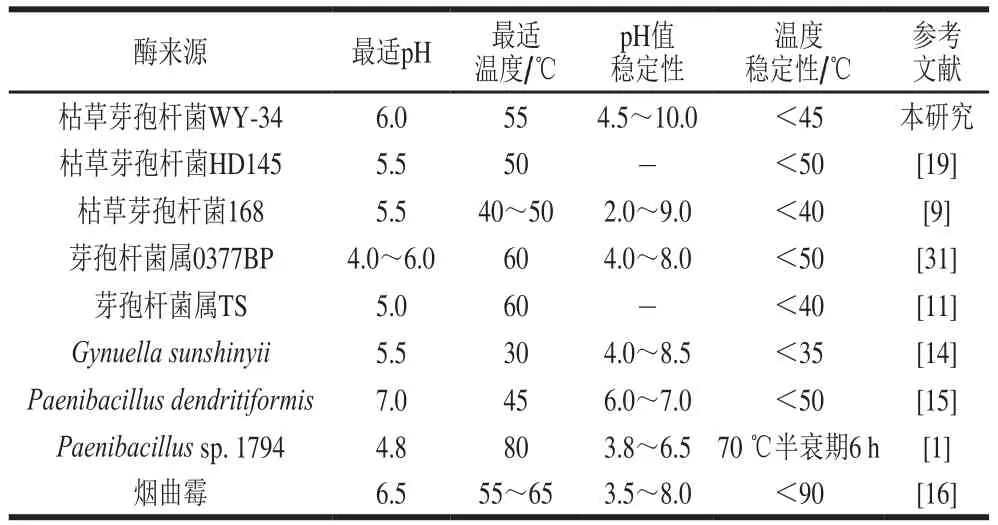
表4 BsCsn46与代表性壳聚糖酶的酶学性质比较Table 4 Comparison of the enzymatic properties of BsCsn46 with representative chitosanases
2.4 BsCsn46的底物特异性及水解特性
BsCsn46对壳聚糖的水解能力很强(4 065.7 U/mg),对乙二醇壳聚糖的水解能力很弱(4.74 U/mg),对乙二醇几丁质、胶体几丁质、羧甲基纤维素和微晶纤维素则没有水解能力,说明该酶具有严格的底物专一性。该酶水解壳聚糖终产物主要为二糖和三糖(图4)。水解0.25 h,即有三糖、四糖、五糖及少量六糖产生,随着时间延长,寡糖量逐渐增加,寡聚度逐渐变小,同时没有检测到单糖的产生,这些结果说明该酶为内切型壳聚糖酶。
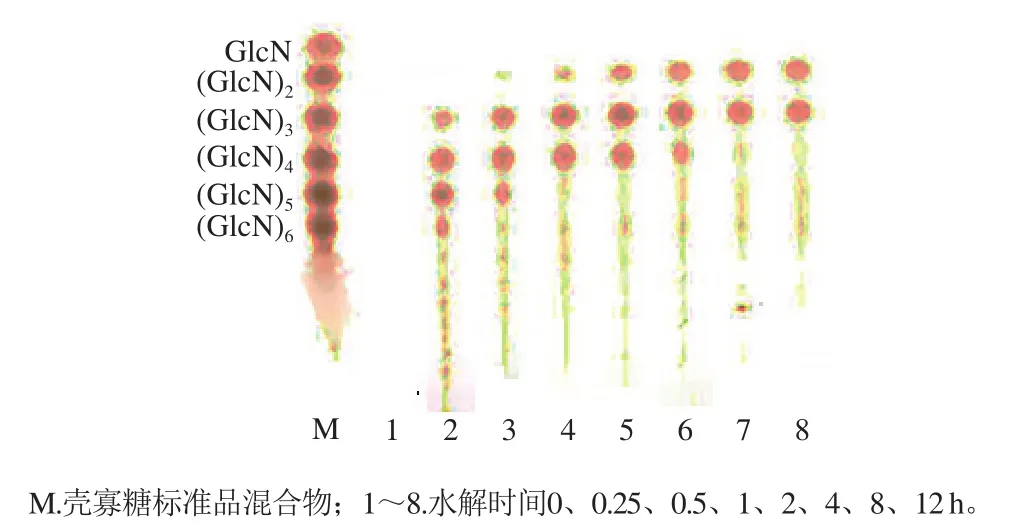
图4 BsCsn46水解壳聚糖产物TLC分析Fig. 4 TLC patterns of products from chitosan hydrolysis by BsCsn46
微生物壳聚糖酶大都专一性水解壳聚糖,但一些壳聚糖酶具有羧甲基纤维素[1]和胶体几丁质[31]的水解能力。除P. dendritiformis壳聚糖酶[15]水解壳聚糖产物为单一的壳二糖外,大多数GH46家族壳聚糖酶水解产物均为DP 2~6的壳寡糖,但是一些壳聚糖酶水解产物存在单糖[10]。该酶与多数GH46家族壳聚糖酶底物特异性和水解特性相近,专一性水解壳聚糖主要产生二糖和三糖,无单糖产生,说明其适合生产壳寡糖。
2.5 水解壳聚糖制备壳寡糖
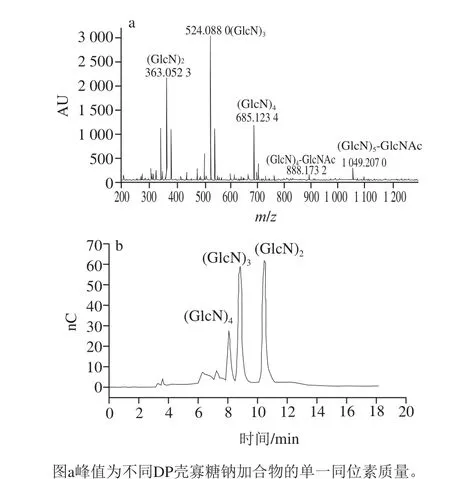
图5 BsCsn46水解壳聚糖产物的MALDI-TOF MS(a)及离子色谱(b)分析Fig. 5 MALDI-TOF MS (a) and HPAEC (b) analysis of products from chitosan hydrolysis by BsCsn46
壳聚糖经过8 h后基本水解完全,水解产物经MALDI-TOF MS分析为DP 2~6的寡糖(图5a),其中二糖、三糖和四糖为脱乙酰的壳寡糖,即(GlcN)2、(GlcN)3和(GlcN)4,五糖和六糖为带一个乙酰基的壳寡糖,即(GlcN)4-GlcNAc和(GlcN)5-GlcNAc。采用冷冻干燥法定量分析水解产物,水解率为92.8%,壳寡糖得率为90.9%。采用HPAEC法对水解主产物定量分析,主要产物为二糖、三糖和四糖(图5b),其得率为77.2%,二糖、三糖和四糖占总可溶性壳寡糖的比例分别为30.6%、46.9%和4.3%。
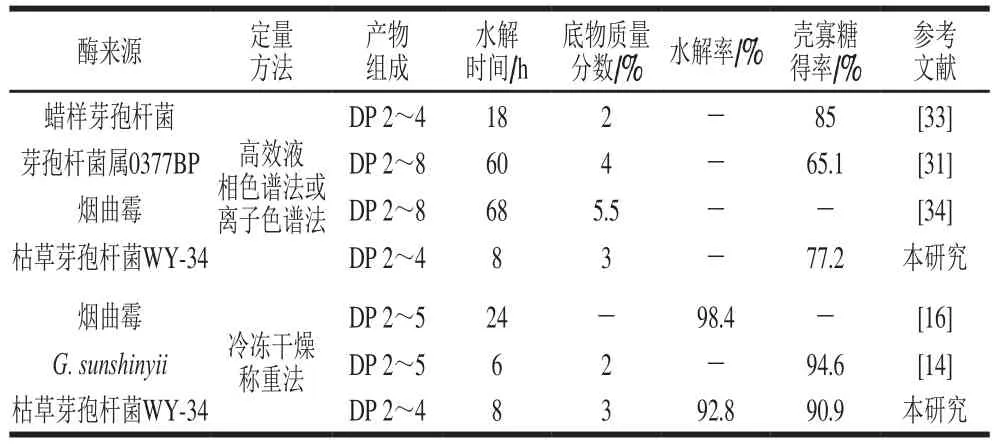
表5 代表性壳聚糖酶水解壳聚糖制备壳寡糖的比较Table 5 Comparison of chitooligosaccharide production of chitosan with representative chitosanases
几丁质类生物质是自然界含量仅次于纤维素的第二大类生物质[2],酶法转化壳聚糖为壳寡糖是目前研究的热点。如表5所示,在相同定量方法下,本研究的壳寡糖得率高于Choij等[31]的水平,低于Gao Xingai等[33]的水平,与Chen Xiaomei等[16]和Qin Zhen等[14]的壳寡糖得率基本相当。同时本研究的壳聚糖酶水解时间仅8 h,分别约为Cheng[34]、Choij[31]、Chen Xiaomei[16]和Gao Xingai[33]等的1/8、1/7、1/3和1/2。虽然比G. sunshinyii壳聚糖酶水解时间(6 h)[14]略长,但是其水解温度(30 ℃)低于本研究(45 ℃)。因此,BsCsn46在工业制备壳寡糖上具有很大潜力。
3 结 论
本研究采用密码子优化和高密度发酵技术成功将枯草芽孢杆菌壳聚糖酶基因在毕赤酵母中实现了高水平表达,经5 L发酵罐高密度发酵后胞外壳聚糖酶活力达50 370 U/mL,蛋白质量浓度为15.7 mg/mL,为文献报道的最高水平。该壳聚糖酶水解3 g/100 mL的壳聚糖时有较高的壳寡糖得率(90.9%)和水解率(92.8%),水解产物主要为壳二糖、壳三糖和少量壳四糖,表明该酶具有工业化生产壳寡糖的潜力。
