普鲁兰生物合成中底物的作用及其生理机制
2019-07-26朱灿灿王大慧卫功元
朱灿灿,陈 晨,王大慧,卫功元*
(苏州大学基础医学与生物科学学院,江苏 苏州 215123)
普鲁兰是一种由α-1,4-糖苷键连接的麦芽三糖重复单位经α-1,6-糖苷键聚合而成的水溶性直链微生物多糖[1-2]。普鲁兰安全无毒,具有可塑性、成膜性、吸附性以及耐热、耐盐和耐酸碱等优良特性,因此,在食品加工、生物医药、环境保护等领域均具有广泛的应用前景[3-7]。
作为一种高分子聚合物,普鲁兰大多是由出芽短梗霉(Aureobasidium pullulans)在好氧条件下利用简单糖类物质合成并分泌到胞外的[8]。在普鲁兰的发酵生产过程中,多糖的产量和分子质量是两个重要的过程参数,前者的大小主要取决于前体物质的供给以及出发菌株合成普鲁兰的能力,而后者则与普鲁兰的降解密切相关[9]。出芽短梗霉胞内的α-磷酸葡萄糖异构酶(α-phosphoglucose mutase,PGM)、尿苷二磷酸葡萄糖焦磷酸化酶(uridine diphosphate glucose pyrophosphorylase,UGP)和葡萄糖基转移酶(glucosyltransferase,FKS)是普鲁兰合成代谢途径中的3 个关键酶,是控制普鲁兰能否实现高效合成的瓶颈因素[10];胞外的普鲁兰降解酶(包括α-淀粉酶和普鲁兰酶等)主要参与普鲁兰的降解反应,最终影响到普鲁兰的分子质量[11-12],而分子质量的大小又将决定普鲁兰的应用范围[13]。
在普鲁兰的生物合成过程中,前体物质尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)和能量物质ATP的供给与消耗速率是影响普鲁兰产量和合成效率的关键因素,而胞内UDPG和ATP含量均与底物的种类和水平密切相关[14-15]。出芽短梗霉能利用多种简单糖类物质(如葡萄糖、蔗糖和木糖等)作为底物合成普鲁兰[2]。Sheng Long等[16]通过对胞内呋喃果糖苷酶的活性进行检测,认为蔗糖是实现普鲁兰高产较为理想的底物;薛文娇等[17]运用发酵动力学模型探讨了不同蔗糖质量浓度下普鲁兰发酵过程中的细胞生长、多糖合成和底物消耗的变化规律,发现采用50 g/L蔗糖补料分批发酵比分批发酵更为高效;Chen Yefu等[18]通过优化发酵条件,提高了由木糖和半纤维素水解液生物合成普鲁兰的产量和效率。然而,截至目前,鲜有针对出芽短梗霉利用不同糖类物质合成普鲁兰生理机制的研究报道。为此,本研究考察不同底物条件对普鲁兰分批发酵产量和分子质量的影响,并从发酵动力学、关键酶活性以及胞内物质和能量代谢等角度对普鲁兰生物合成的生理生化机制进行解析,研究结果将为具有不同应用潜力的普鲁兰的工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
A. pullulans CCTCC M 2012259由苏州大学微生物生理与代谢调控研究室保藏。
种子培养基:马铃薯200 g/L,葡萄糖20 g/L,自然pH值。
发酵培养基:葡萄糖(或蔗糖,或木糖)100 g/L,酵母粉3 g/L,(NH4)2SO40.6 g/L,K2HPO42 g/L,NaCl 1 g/L,MgSO4·7H2O 0.2 g/L,pH 3.8。
磷酸葡萄糖变位酶联免疫分析测试盒 上海皓尘生物科技有限公司;尿苷二磷酸葡萄糖焦磷酸化酶联免疫分析测试盒 上海将来实业股份有限公司;所有试剂均为国产分析纯,购自生工生物工程(上海)股份有限公司。
1.2 仪器与设备
BIOTECH-5BGZ搅拌式发酵罐 上海保兴生物设备工程有限公司;LD5-2A离心机 北京京立离心机有限公司;1525高效液相色谱(high-performance liquid chromatography,HPLC)仪 美国Waters公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;SW-CJ-2A超净工作台 吴江市龙宏净化设备有限公司;HZ-2010K恒温摇瓶柜 太仓市华利达实验仪器设备有限公司;LDZX-50KB灭菌锅 上海申安医疗器械厂。
1.3 方法
1.3.1 种子培养
将在-70 ℃超低温冰箱中保藏的菌种(1 mL)接种入装有50 mL种子培养基的三角瓶中,于30 ℃、200 r/min摇床培养24 h。
1.3.2 分批培养
按照10%(V/V)的接种量将种子接种至装有3 L发酵培养基的5 L发酵罐中,在30 ℃、400 r/min和3 L/min通气量的条件下进行分批培养。pH值采用梅特勒电极在位监测,并通过自动流加3 mol/L H2SO4或3 mol/L NaOH溶液调节pH值为3.8±0.02。
1.3.3 细胞干质量与普鲁兰产量测定
取20 mL发酵液,80 ℃水浴15 min灭活,冷却至室温后在12 000 r/min离心10 min。沉淀用蒸馏水洗涤3 次,收集细胞后于70 ℃烘干至质量恒定,计算得到细胞干质量;取离心后的上清液10 mL,加入2 倍体积无水乙醇,4 ℃处理12 h,12 000 r/min离心10 min,将沉淀于70 ℃烘干至质量恒定,计算得到普鲁兰产量。
1.3.4 无细胞提取物的制备
取5 mL发酵液,于4 ℃、12 000 r/min离心10 min,生理盐水洗涤2 次后,将湿细胞重新悬浮在5 mL 0.2 mol/L磷酸缓冲溶液(pH 7.0)中,超声破碎10 min(破碎10 s,间隔10 s),在4 ℃、12 000 r/min离心20 min后得到的上清液即为无细胞提取物,用于测定胞内物质含量和关键酶活性。
1.3.5 指标测定
发酵液中葡萄糖和木糖的测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[19];蔗糖先用6 mol/L盐酸在沸水中处理10 min,然后采用DNS法进行测定;普鲁兰分子质量的测定采用黏度法[20]。
胞内UDPG含量采用HPLC法进行测定[21]。色谱柱为Supelcosil LC-18-DB柱(4.6 mm×250 mm),流动相为40 mmol/L三乙胺-乙酸缓冲液(pH 6.0),流速1 mL/min,柱温22 ℃,检测波长254 nm。
胞内NADH和ATP的测定采用HPLC法[15]。
1.3.6 酶活性测定
普鲁兰合成能力测定采用全细胞转化法[22]。取5 mL发酵液,12 000 r/min离心10 min,将湿细胞重悬于5 mL转化液(5 g/L葡萄糖,0.2 g/L MgSO4·7H2O,pH 6.0)中,然后在30 ℃、200 r/min摇床中转化3 h。转化结束后,检测生成的普鲁兰含量。
普鲁兰降解酶系活性测定[23]。取5 mL发酵液,12 000 r/min离心10 min,将上清液与普鲁兰标准品混合后于50 ℃水浴锅中保温反应3 h。反应结束后,立即在100 ℃加热终止反应,测定反应前和反应后上清液中还原糖的浓度。在50 ℃条件下,将每分钟释放1 μmol还原糖所参与普鲁兰降解的酶量定义为1 个酶活单位(U)。
PGM活性:采用磷酸葡萄糖变位酶联免疫分析测试盒进行测定;UGP活性:采用尿苷二磷酸葡萄糖焦磷酸化酶联免疫分析测试盒进行测定,具体操作步骤参照试剂盒说明书执行;FKS活性:测定方法参见文献[15]。
1.4 数据统计分析
所有分批发酵实验数据均为3 次检测结果的平均值。Excel 2010软件作图。
2 结果与分析
2.1 不同底物对普鲁兰分批发酵的影响


图1 不同底物条件下的细胞生长和普鲁兰分批发酵过程Fig. 1 Time-course curve of cell growth and pullulan production using different sugars as substrates
不同底物(葡萄糖、蔗糖和木糖)条件下的A. pullulans CCTCC M 2012259细胞生长、普鲁兰生物合成以及分子质量的变化情况如图1所示。可以看出,出芽短梗霉细胞能够很好地利用3 种糖进行生长并合成普鲁兰,细胞干质量和普鲁兰产量分别在72 h和120 h时达到最大值,而普鲁兰最大分子质量则出现在18 h。此外,细胞利用单糖(葡萄糖和木糖)比利用蔗糖时具有更高的生长速率。然而,在发酵培养基中氮源供给一定的情况下,3 种糖作为碳源时的最终细胞干质量没有显著差异。

表1 不同底物条件下的普鲁兰分批发酵动力学参数Table 1 Fermentation kinetic parameters using different sugars as substrates
与细胞生长不同的是,底物对普鲁兰生物合成具有较大的影响。利用蔗糖可以获得更高的普鲁兰合成速率和产量,最终普鲁兰产量比利用葡萄糖和木糖时分别提高了15.5%和19.1%;而利用葡萄糖更有利于获得较高的分子质量,普鲁兰的最大分子质量和最终分子质量(120 h)均高于利用蔗糖和木糖时的水平。此外,与已有研究[15]相比,初糖质量浓度为100 g/L时的普鲁兰得率和生产强度均处于较高的水平(表1)。综合普鲁兰分批发酵过程(图1)以及其他动力学参数(表1)结果可以发现,蔗糖有利于获得更高的普鲁兰产量而葡萄糖有助于维持更高的普鲁兰分子质量。以下将分别从关键酶活性以及物质和能量代谢的角度对不同底物影响普鲁兰生物合成的生理机制进行探讨。
2.2 普鲁兰合成能力和降解酶活性
在分批发酵过程中,普鲁兰生物合成速率的高低由胞内合成酶系的能力决定[22],而普鲁兰分子质量的大小则与胞外的降解酶系活性密切相关[15,23]。为此,分别测定分批发酵前期出芽短梗霉细胞的普鲁兰合成能力和发酵后期降解酶活性,结果见图2。可以看出,无论细胞利用何种糖作为碳源,发酵前期(18 h)的细胞均具有更高的普鲁兰合成能力,而发酵后期(72 h)的胞外普鲁兰降解酶系具有更高的活性。与此同时,相较于葡萄糖和木糖,蔗糖不仅提高了普鲁兰的合成能力,而且也提升了胞外普鲁兰降解酶系的活性。

图2 不同底物条件下的普鲁兰合成能力和降解酶系活性Fig. 2 Pullulan biosynthesis and pullulan-degrading activity with different substrates
2.3 普鲁兰合成关键酶活性
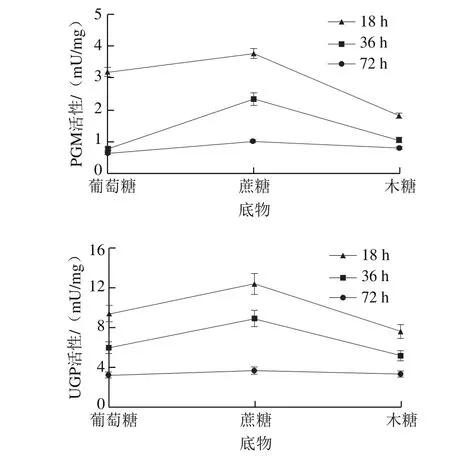

图3 不同底物条件下的普鲁兰合成关键酶活性Fig. 3 Key enzymes activities involved in pullulan biosynthesis with different substrates
PGM、UGP和FKS是普鲁兰生物合成途径中的3 种关键酶,其活性大小与普鲁兰能否高效合成密切相关[10]。为此,对不同培养阶段下的各关键酶活性进行测定,结果见图3。可以发现,不论细胞利用葡萄糖、蔗糖还是木糖,3 种关键酶均在发酵前期保持较高的活性,随后逐渐下降。此外,在普鲁兰合成期(18、36 h),蔗糖存在下的PGM、UGP和FKS活性均高于葡萄糖和木糖;至72 h时,不同底物条件下的各关键酶活性差异不大。由此可见,蔗糖比葡萄糖和木糖更有利于将3 种关键酶活性维持在较高的水平,从而促进普鲁兰的生物合成。
2.4 胞内UDPG水平
UDPG是普鲁兰生物合成的直接前体物质[1,24],胞内UDPG水平是决定普鲁兰合成速率的关键因素。出芽短梗霉细胞进入普鲁兰合成期(36、72 h)时的胞内UDPG含量见图4。可以看出,细胞在利用葡萄糖、蔗糖和木糖合成普鲁兰时,胞内UDPG在发酵前期(36 h)比后期(72 h)具有更高的水平。同时,细胞利用蔗糖后能将底物更多地转化为UDPG并积累在胞内,这为普鲁兰的进一步过量合成提供了更高的内在驱动力。

图4 不同底物条件下的胞内UDPG含量Fig. 4 Levels of intracellular UDPG with different substrates
2.5 胞内能量物质水平
在普鲁兰生物合成过程中,除前体物质UDPG以外,充足的能量供给也是普鲁兰过量合成的必要条件[15,25]。为此,测定不同培养阶段出芽短梗霉细胞内与能量代谢有关的辅因子NADH和ATP含量。图5表明,在快速生长期(18 h),细胞利用葡萄糖和蔗糖后胞内NADH和ATP含量明显高于利用木糖的结果;至36 h时,利用蔗糖的细胞其胞内NADH和ATP含量最高;而在72 h时,胞内NADH和ATP含量均处于较低水平。由此可见,在普鲁兰合成期,蔗糖可提供比葡萄糖和木糖更多的能量物质,以保障普鲁兰过量合成对ATP的需求。

图5 不同底物条件下的胞内NADH和ATP含量Fig. 5 Levels of intracellular NADH and ATP with different substrates
3 讨 论
目前已经有不少关于出芽短梗霉细胞利用不同糖类物质作为底物合成普鲁兰的文献报道[26-29]。然而,普鲁兰的合成是一个复杂的生物过程,相关生理生化机制至今仍未完全搞清楚[1,16]。普鲁兰的合成效率、产量以及分子质量等指标会随着底物的不同而发生变化[2,6],但是鲜有研究对这些差异产生的原因进行探索。为此,本实验研究底物对普鲁兰分批发酵的影响,重点对蕴含在其中的生理机制进行解析。
首先,根据普鲁兰的生物合成代谢途径,发酵培养基中的糖类物质经出芽短梗霉细胞代谢,在PGM和UGP的作用下形成前体物质UDPG,然后UDPG在FKS的作用下形成麦芽三糖,最后再在FKS的作用下跨膜聚合形成普鲁兰[30-31]。因此,在底物糖类物质充足的前提下,提高PGM和UGP活性有助于加快UDPG的合成速率;同时,较高的胞内UDPG水平和FKS活性也更有利于提高普鲁兰的合成速率,并最终提高普鲁兰产量[24]。本研究结果表明,出芽短梗霉细胞在利用蔗糖时具有更高的PGM、UGP和FKS活性,胞内UDPG水平更高,体现出细胞具有更强的普鲁兰合成能力,因此在底物浓度相同的情况下,可以获得更高的普鲁兰产量。葡萄糖和木糖也可以直接用于合成普鲁兰,然而其关键酶活性和前体物质含量均低于利用蔗糖时的水平。
其次,作为一种微生物多糖,分子质量是普鲁兰这种聚合物的重要特征之一,而分子质量的大小也是影响普鲁兰应用范围的主要因素[32]。有研究报道,在发酵后期普鲁兰分子质量的降低与普鲁兰降解酶系活性有关[22]。Manitchotpisit等[12]将普鲁兰在合成过程中的降解归功于细胞分泌的α-淀粉酶或普鲁兰酶,这种过程的最终结果不是普鲁兰的完全降解,而是普鲁兰长链中的小部分α-1,4-或α-1,6-糖苷键发生断裂,导致普鲁兰分子质量的降低。由于分批发酵过程中α-淀粉酶和普鲁兰酶活性较低[33],很难获得准确数据,因此常用普鲁兰降解酶系的活性来表示[23]。本研究结果表明,在葡萄糖存在的情况下,普鲁兰降解酶系的活性一直处于相对较低的水平;而蔗糖和木糖则有利于提高降解酶系的活性,普鲁兰在降解酶的作用下,最终的分子质量均低于利用葡萄糖时的水平。由此可见,蔗糖有利于提高普鲁兰产量和得率,但葡萄糖却有助于将普鲁兰分子质量维持在较高水平。
此外,在普鲁兰生物合成中,ATP是不可或缺的能量物质。Taguchi等[14]报道过在不添加ATP的情况下,无细胞酶液无法利用底物在胞外合成普鲁兰。在好氧发酵条件下,胞内ATP是由NADH经氧化磷酸化过程合成的,因此胞内NADH含量及其转化速率将直接影响到ATP的供给效率[15]。本研究中胞内NADH和ATP含量测定结果表明,出芽短梗霉细胞在利用蔗糖和葡萄糖时,胞内能量代谢物质的水平相对较高,特别是在普鲁兰快速合成期更为显著,这为普鲁兰的过量合成提供了充足的能量保障。而木糖作为一种五碳糖,在其参与普鲁兰合成之前,需要经历较长的代谢途径并消耗一定的能量[18],因此胞内NADH和ATP含量一直处于较低的水平,最终降低了普鲁兰的合成速率和产量。
综上,考察葡萄糖、蔗糖和木糖3 种底物对普鲁兰分批发酵的影响,发现蔗糖有利于普鲁兰的高产而葡萄糖有助于获得更高的分子质量。在分析发酵动力学参数的基础上,结合关键酶活性以及胞内物质和能量代谢水平,部分解析了不同底物影响普鲁兰生物合成的生理生化机制。研究结果增加了对普鲁兰产量和分子质量影响因素的认识,同时也为深入探究不同分子质量普鲁兰的高产提供思路。
