大肠杆菌离子束诱变结合呼吸商在线实时调控高产聚唾液酸
2019-07-26吴金勇陈祥松陆姝欢李翔宇姚建铭
吴金勇,陈祥松,余 超,陆姝欢,李翔宇,,*,姚建铭,3,,*
(1.中国科学院合肥物质科学研究院,安徽 合肥 230031;2.中国科学院大学,北京 100049;3.中国科学技术大学,安徽 合肥 230026;4.武汉中科光谷绿色生物技术有限公司,湖北 武汉 430073;5.湖北省营养化学品生物合成工程技术研究中心,湖北 武汉 430223)
聚唾液酸(polysialic acid,PSA)是由唾液酸单体以α-(2,8)和/或α-(2,9)键连接的聚合体[1-2],唾液酸单体又称为N-乙酰神经氨酸。PSA在哺乳动物中具有重要的生理功能:参与神经系统发育[3-4]、维持神经系统健康[5]、参与癌细胞的侵袭和转移[6-7]、参与细胞内外分子间相互作用[3]。PSA还具有抗黏附功能,可促进哺乳动物外壁器官(如肺、肝、睾丸和胎盘)的发育、修复和再生[5,8-9]。PSA也是一种非免疫原性、可生物降解的材料,可用于组织工程和药物缓释材料[8-9]。此外,PSA降解后的唾液酸单体已被证实是人类大脑认知发育所必需的营养元素之一[10],食用含唾液酸单体的食物可增加脑神经节苷和糖蛋白的浓度[11],也可增强早期的学习能力[12-14],母乳中含有大量唾液酸[10],因此可能对婴儿早期的脑神经发育有非常重要的作用[15]。在婴幼儿奶粉配方领域具有潜在较大的市场。
随着PSA被关注度的提高,国内外有许多单位研究开发PSA生产工艺,Wu Jianrong等[12]采用较低水平的初始磷酸盐,并控制发酵过程中pH值为6.4,最终PSA产量达到5.2 g/L,比初始产量提高了52.9%。Zheng Zhiyong等[13]采用双阶段pH值控制的策略:第1阶段pH值控制在6.4,以促进细胞生长和形成PSA,第2阶段pH值控制在7.4,促进形成较高分子质量的PSA,最终得到PSA产量达到5.65 g/L,比对照提高了2 倍。Chen Fang等[14]利用基因工程手段加强PSA合成途径中关键酶的表达并敲除竞争性途径中的相关基因,从而获得高产PSA的工程菌,在7 L发酵罐中PSA产量高达16.15 g/L。从以上研究结果来看,对PSA发酵过程优化可有效提高其产量,但最终产率还是较低。采用基因工程手段改造生产菌种效果非常显著,然而转基因微生物所生产的食品或食品添加剂并不被市场和消费者所接受。离子束注入诱变技术是20世纪80年代我国科学家Yu Zengliang等[16]提出,并迅速在生物工程领域得到应用的一项新技术[17-18],该技术采用较低能量的氮离子注入,可诱导微生物体内染色体畸变、DNA多态性变化等[17]。离子束注入由于正突变率高且不涉及转基因操作,已被业内广泛使用且相应产品也被市场所接受。例如,张丽敏等[19]通过离子束注入诱变,获得1 株突变株,PSA产量比出发菌株提高了0.3 g/L。在工艺优化方面,呼吸商(respiration quotient,RQ)在线实时调控策略在红霉素、谷胱甘肽发酵优化及放大中获得成功应用[20-21],而目前PSA发酵工艺优化主要是围绕pH值、前体或无机盐等方向开展,在线实时调控仅限于pH值、溶氧等手段。RQ能反映微生物代谢实时情况[20-21],因此有必要在PSA的发酵工艺研究中开发RQ在线实时调控策略以指导PSA的中试放大及生产。鉴于以上情况,要对现有菌株进一步进行离子束诱变以获取高产PSA的生产菌株,同时配套开发RQ在线实时调控PSA生产以推进PSA的产业化进程。
本研究采用低能氮离子束注入诱变获取不同产量的变异菌株,并研究不同产量的菌株发酵过程中RQ的变化趋势,从而得到PSA和RQ之间的初步规律,进而采用脉冲式补入玉米浆干粉以确定RQ变化的规律,根据该规律,制定不同RQ调控玉米浆干粉补料策略,在提高生物量的同时进一步提高PSA的产量,最终实现了PSA的高产,为PSA产业化提供了理论依据和实践基础。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli ATCC13027),购于美国组织培养库。
硫酸铵、磷酸二氢钾、硫酸镁均为国产分析纯;胰蛋白胨、酵母浸粉 美国Oxoid公司;玉米浆干粉山东振华生物科技有限公司;氨水 泰兴市苏荣助剂厂;葡萄糖 嘉吉生化有限公司。
1.2 仪器与设备
ZHJH-C1112C洁净工作台 上海智城分析仪器制造有限公司;FiveEasy S20 pH计 梅特勒-托利多仪器(上海)有限公司;LDZH-100KBS立式大型灭菌锅上海申安医疗器械厂;氮离子注入装置 中国科学院等离子体物理研究所;BIOTECH-50JSA全自动机磁力搅拌发酵罐 上海保兴生物设备工程有限公司;PS7000尾气分析仪 德国H&B品牌重庆川仪九厂组装;ZHWY-211C卧式恒温摇床 上海智城分析仪器制造有限公司;SBA-40C葡萄糖分析仪 中国山东科学院生物研究所;Ultimate3000高效液相色谱仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 斜面培养
斜面培养基:氯化钠5 g/L,胰蛋白胨10 g/L,牛肉膏3 g/L,琼脂粉20 g/L,pH 7.2~7.4。将保存于4 ℃冰箱的菌种,挑取1 环到准备好的固体斜面培养基上,在37 ℃恒温箱内恒温培养12 h。
1.3.2 种子培养条件
种子培养基:NaCl 10 g/L,胰蛋白胨10 g/L,酵母浸粉3.0 g/L,pH 7.2~7.4。将斜面培养活化后的种子接种两环于250 mL三角瓶中(内装50 mL 种子培养基)后,放置于摇床中培养,摇床条件为转速250 r/min,温度37 ℃,培养8~10 h。
1.3.3 摇瓶发酵培养条件
发酵培养基:葡萄糖40 g/L,玉米浆干粉20 g/L,硫酸铵3 g/L,磷酸二氢钾7 g/L,硫酸镁1 g/L,金属离子1 mL/L,维生素溶液1 mL/L,pH 7.5(灭菌前)。将活化后的种子液按10%接种量接于250 mL三角瓶中(内装50 mL发酵培养基)后,放置于摇床中培养,摇床条件为:转速350 r/min,温度37 ℃,培养72 h,每培养12 h补入葡萄糖1 g,共计补入5 次。
1.3.4 离子束诱变
大肠杆菌按照1.3.2节种子培养方法,培养结束后10 000 r/min离心5 min,取下层菌体重悬于等体积的无菌生理盐水中。经离心、重悬2~3 次,制得菌悬液,进行梯度稀释,选择合适梯度的菌悬液涂布于无菌平皿,在超净台中以无菌空气风干备用。离子注入实验在中科院离子束生物工程学重点实验室氮离子注入装置上进行。N+离子源注入注入能量15 keV,注入剂量1×1014~12×1014ion/cm2,以5 s脉冲式注入,间隔20 s,靶室真空度约10-3Pa。将每两个涂布平皿上下叠放于注入机靶台上,上层接受离子者为处理,下层未接受离子注入者为真空对照。每个剂量进行3 组平行实验,通过预实验确定存活率,按存活率决定稀释倍数,以每平板菌落100~300 个为宜,诱变结束后以2 mL无菌水洗脱,梯度稀释后,涂布于含有斜面培养基的平板上,37 ℃培养24 h,用于单菌落的挑选及致死率计算,如式(1)所示:

1.3.5 50 L发酵罐培养
全自动50 L磁力搅拌发酵罐中装30 L发酵培养基,将培养好的种子按照10%的接种量接入发酵罐中。在温度37 ℃、通气量60~90 L/min、搅拌转速300~500 r/min条件下培养时间60 h。溶氧全程控制在30%以上。通过自动流加氨水维持发酵液pH值在6.8±0.02以内。全程流加600 g/L的葡萄糖液以补充碳源,每4 h取样检测发酵液残糖,计算葡萄糖消耗速率,根据葡萄糖实际消耗速率进行控制,发酵液残糖控制不超过0.2 g/L。
1.3.6 生物量测定
取20 mL发酵液样品,10 000 r/min离心5 min,取下层菌体,置于105 ℃烘箱2 h至质量恒定,称取质量,将菌体干质量除以样品体积,即得到生物量。
1.3.7 还原糖测定
用葡萄糖分析仪测定发酵液残余葡萄糖含量。
1.3.8 PSA含量的测定
对PSA含量的测定采用间苯二酚法。
标准曲线制作:取100 mg/L唾液酸标准品0、0.1、0.2、0.4、0.8、1.6 mL于各管中,补水至2.0 mL为标准曲线各点。各管加2 mL显色剂(0.l mol/L硫酸铜溶液0.5 mL,4%间苯二酚溶液5 mL,浓盐酸80 mL,补水至100 mL混匀,临用现配)摇匀,沸水浴60 min后冰浴10 min,每管加4 mL有机相(正丁醇15 mL,加乙酸丁酯定容至100 mL),充分摇匀后置室温10 min,取上层有机相,以0 mL对照为零点,于585 nm波长处测定吸光度,并作线性回归。
样品分析:发酵液经10 000 r/min离心5 min取上清液0.1 mL,按照制作标准曲线的方法处理该样品,最后在585 nm波长处测定吸光度,根据标准曲线计算样品中PSA含量。
1.3.9 乙酸含量的测定
发酵液离心后取上清液,0.22 μm滤膜过滤后采用高效液相色谱测定,色谱柱为Aminex HPX-87H(300 mm×7.8 mm,9 μm);流动相为5 mmol/L硫酸,流动相流速0.6 mL/min;紫外检测器,波长200 nm;柱温60 ℃;进样量20 μL。
1.3.10 OUR、CER和RQ的测定
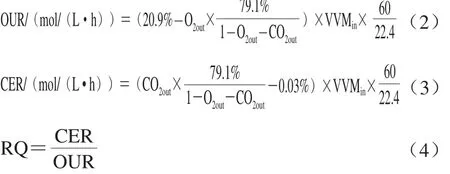
测定尾气中氧气含量(O2out)和二氧化碳含量(CO2out),并结合发酵过程通气量/发酵培养体积比(VVMin)计算氧消耗速率(oxygen uptake rate,OUR)、二氧化碳释放速率(carbon-dioxide escape rate,CER)和RQ,通气量采用热式质量流量计测定,显示值已经换算成标准状况下的数值(273.15 K,101 kPa)。OUR、CER和RQ计算如式(2)~(4)所示:
1.4 数据统计及图像处理
每个实验共设3 个平行,采用SPSS 17.0软件进行方差显著性分析,选择独立样本t检验。图表采用Excel 2007软件进行制作分析,并采用Adobe Photoshop CS5处理后输出;发酵培养过程中,OUR、CER、RQ每30 min取一个点,采用Excel 2007软件制作分析并采用Adobe Photoshop CS5处理后输出。
2 结果与分析
2.1 低能N+离子束对菌体的致死率
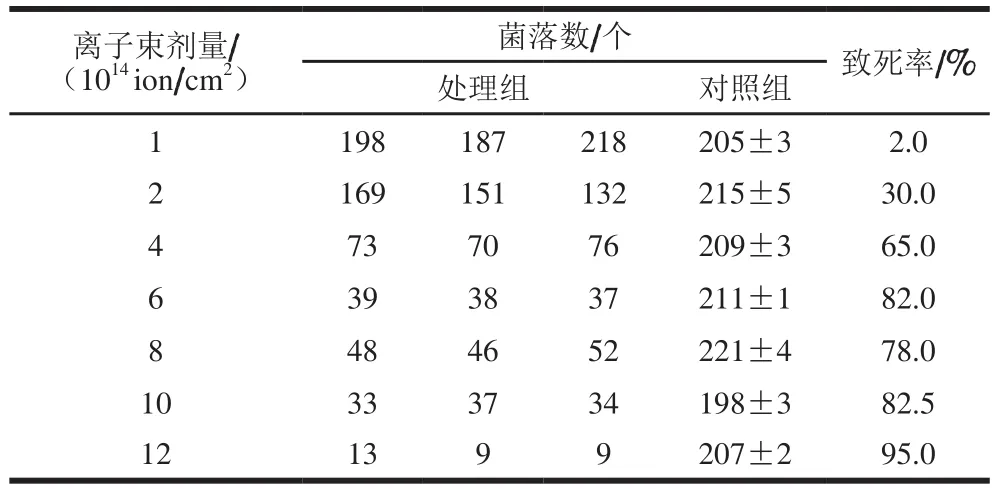
表1 不同N+离子束下大肠杆菌的致死率Table 1 Mortality rates of E. coli under different doses of N+ ion beam
如表1所示,在一定范围内,随着离子束诱变剂量的提高,大肠杆菌致死率随之迅速增加,当剂量超过6×1014ion/cm2时,致死率反而下降,当剂量增加至10×1014ion/cm2时,致死率与6×1014ion/cm2剂量的致死率接近,当剂量进一步增加至12×1014ion/cm2时,致死率达到95%。致死率的先提高后下降再提高的现象在其他文献中也有报道,为取得较好的正突变率,一般选择致死率的平台期[22-23]。因此,诱变剂量选择10×1014ion/cm2。
2.2 突变株摇瓶复筛
对平板法筛选到的146 株菌进行250 mL摇瓶发酵复筛。结果表明,25 株突变株较出发菌株PSA产量有所提高,正突变率为17.1%。PSA产量提高最多的5 株正突变株以及PSA产量出现下降的6 株摇瓶发酵结果如表2所示。
从表2可以看出,相对出发菌株来说,N149菌株PSA产量增加率最大,为36.81%,而N164菌株PSA产量下降最多,下降率为22.92%。因而选择出发菌株、N149和N164菌进一步研究,以了解3 株菌之间的差异。

表2 复筛得到11 株菌的摇瓶考察结果Table 2 Results of secondary screening of the 11 strains by in shake flask fermentation
2.3 不同突变株在发酵过程中生物量、PSA、RQ、乙酸变化趋势
通过离子束注入诱变得到了正突变和负突变的菌种,其PSA产量与对照的差异从-22.92%波动至36.81%,离散系数(标准差/平均值)达到21.56%,为研究大肠杆菌在发酵生产PSA过程中的关键控制点,分别从突变株中选取产量最高的正突变株N149和产量最低的负突变株N164在50 L发酵罐上进行发酵,并以出发菌株为对照。从而研究比较3 株不同PSA产量菌株之间的差异。
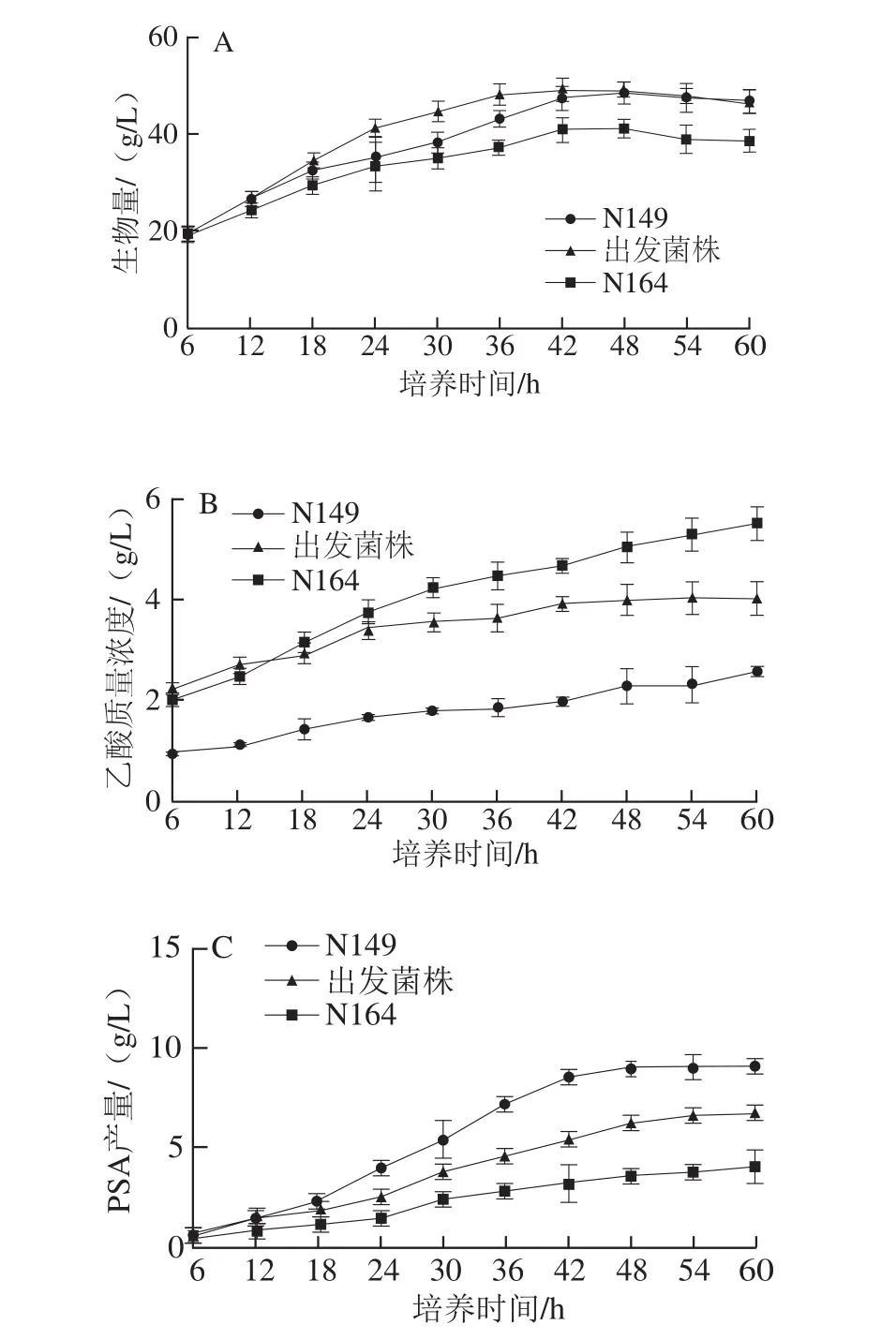

图1 不同突变株在发酵过程中生物量(A)、乙酸(B)、PSA(C)及RQ(D)变化趋势Fig. 1 Time courses of dry biomass yield (A), acetic acid (B),PSA titer (C) and RQ (D) in fed-batch fermentation by E. coli
由图1A可知,出发菌株在42 h获得最大生物量,为49.30 g/L。N149和N164在48 h时分别达到48.6 g/L和41.3 g/L。出发菌株和N149最终生物量相同,而N164生物量整体偏低。3 个菌株生物量趋势的共同特点是在48 h后不再增长,反而呈现下降趋势。Zheng Zhiyong等[13]在研究大肠杆菌产PSA的工艺时发现,生物量在20 h左右可达到最高点,随后开始出现下降趋势,该研究采取两阶段pH值调控的策略后,菌体生物量可持续增长至40 h。在Wu Jianrong等[24]的研究中,大肠杆菌生物量在36 h达到最大值,38 h时生物量就开始下降,通过添加磷酸二氢钾以及氨水结合氢氧化钾控制pH值后,生物量提高了约40%,并在42 h达到最高之后一直稳定到58 h才出现下降趋势。从这些研究来看,产PSA的大肠杆菌按照常规发酵工艺进行调控可能会较快进入衰亡期,因此大部分研究都会适当调整不同的策略控制工艺以保持菌体的活力,从而延长PSA的生产期。图1B显示,N164乙酸质量浓度最高,其次为出发菌株,最低的为N149。由图1C可看出,20 h前3 株菌PSA产量比较接近,20 h后3 株菌的PSA产量增长趋势出现差异,42 h时N164、出发菌株和N149的PSA产量差异最大,分别为3.26、5.45、8.52 g/L,3 株菌PSA产量差异极显著(P<0.01),发酵结束时,N164、出发菌株和N149的PSA最大产量分别为4.06、6.79、9.05 g/L,PSA生产速率分别为67.6、113.2、150.9 mg/(L·h)。由图1D可以看出,较优的突变株N149在0~18 h RQ维持在1.0上下波动,12~48 h RQ保持在0.7左右,而另外两株保持在1.0左右,并且PSA产量差异也较大,可以推测,PSA高速合成时,RQ最佳值可能就在0.7左右,由此看来,RQ值可能直接表征PSA的合成状态。此外,高产菌株在48 h后出现RQ回升的趋势,PSA产量在此之后并无增长。
3 株菌生物量、PSA以及乙酸产生量均有较大的差异,发酵工艺保持一致的情况下,可以推测这些差异是由于菌种本身所造成的。RQ作为很好的在线调控参数,可以反映微生物培养过程中底物的利用、产物和副产物的合成及微观代谢途径通量的变化情况[25],3 株菌培养过程中RQ在初期都在1.0左右波动,这是因为菌体在生长初期,只要有足够的氧气,葡萄糖就会进入柠檬酸循环,其反应式为:C6H12O6+6O2=6CO2+6H2O,产生的能量主要供给细胞的生长[21,25]。随着产物和副产物的合成,RQ会发生变化,本研究中,当PSA快速合成时(20~48 h),RQ从1.0逐渐降低至0.7,而其余两株菌PSA产量偏低,乙酸含量显著偏高(P<0.01),RQ显著高于高产菌的RQ(P<0.01)。有报道指出,葡萄糖被分解利用后产生乙酸,RQ值大约为1.0[26],N164乙酸产量最高可达到5.52 g/L,因此RQ显著高于N149。3 株菌发酵过程中的这些差异说明:RQ可能很大程度与PSA和乙酸、生物量增长有密切关系,当PSA快速合成过程中,RQ值在0.7左右。因此通过在线控制RQ有可能调节PSA和乙酸、生物量。
2.4 氮源添加对PSA产量和生物量的影响

图2 不同氮源的添加对大肠杆菌摇瓶发酵的生物量、PSA产量的影响Fig. 2 Effects of different nitrogen sources on dry biomass yield and PSA titer in shake flask fermentation by E. coli
3 株菌株都在48 h后出现生物量下降,PSA产量增长缓慢的趋势,这可能是发酵中后期出现营养元素不足(氮源、维生素、金属离子或生长因子),导致细胞活力下降,进而出现PSA增长缓慢的问题。为解决该问题,考虑添加新的营养物质以促进细胞生长。工业上常用的易溶于水,方便补料操作的氮源有谷氨酸钠、酵母浸膏、玉米浆干粉等。本研究以N149菌为研究对象,采用摇瓶进行氮源筛选,按照0、24、48 h三个时间点以及0.2、0.5、1 g/100 mL质量浓度(干质量/发酵体积)分别添加至发酵液中,结果如图2所示。
从图2A可以看出,添加谷氨酸钠后生物量和PSA增长趋势并不明显,说明发酵过程并不缺乏氨基态氮源。从图2B可以看出,添加酵母浸膏的批次在0、24 h时,生物量增长比较明显,并且在相同质量浓度下增长幅度都比较接近,0 h添加1 g/100 mL的酵母浸膏时生物量增长幅度最大,比对照增加了36.33%,但在48 h添加时,生物量未见提高;24 h添加1%酵母浸膏时,PSA比对照增长幅度为7.49%,说明在发酵的前中期添加酵母浸膏对生物量有较好的促进效果,在发酵后期添加酵母浸膏时,生物量增长不明显,而中后期添加酵母浸膏时PSA有小幅度增长。从图2C可以看出,在0、24 h添加玉米浆干粉时,生物量增长比较明显,生物量增长幅度最大的是0 h添加1 g/100 mL玉米浆干粉,生物量比对照增加了53.04%,但在48 h加入玉米浆干粉时,最大增长幅度为12.17%;在0、48 h添加玉米浆干粉PSA产量远不及在24 h添加玉米浆干粉PSA产量高,24 h添加1%玉米浆干粉时PSA增长幅度最大,为14.47%,说明玉米浆干粉添加的方式对PSA产量有较大的影响。
综合以上结果可知,谷氨酸钠作为氮源,是一种单独的氨基酸,添加后生物量并未见增长,说明大肠杆菌发酵过程中不缺氮源,酵母浸膏和玉米浆干粉添加后,生物量均有增加,说明两种有机氮源中营养成分对于大肠杆菌的生长有很好的促进效果。但两者对PSA产量的促进作用差异比较大,玉米浆干粉的促进效果好于酵母浸膏,可能是因为两者的氨基酸组成以及其他营养成分的差异所造成。张乐等[27]研究玉米浆和酵母浸膏对丁二酸发酵的影响,结果发现采用095K玉米浆干粉完全替换酵母浸膏时,丁二酸产量从28.45 g/L提高到29.43 g/L,进一步分析了玉米浆干粉组分差异,添加影响较大的4 种氨基酸和2 种维生素后,丁二酸产量进一步提高到了32.56 g/L,说明有机氮源中的氨基酸组成和维生素对目标产物的影响非常大。本实验发现玉米浆干粉对大肠杆菌生长和PSA合成有较好的促进作用,因此选择玉米浆干粉作为氮源进一步研究流加策略。
2.5 玉米浆干粉对大肠杆菌发酵过程RQ的影响
为了解玉米浆干粉对大肠杆菌发酵过程中代谢的影响,采用50 g/L的玉米浆干粉溶液分别在20 h和40 h加入到发酵液中,累计最终质量浓度为10 g/L。如图3A所示,OUR在12 h前快速增长,并在17 h达到最大值0.23 mol/(L·h),随后开始逐步下降,CER则在7 h达到最大值,随后保持相对稳定至发酵结束;RQ在10 h前保持在1.0上下波动,随后开始下降并维持在0.7左右波动,41 h后开始上升至0.9左右。图3B显示了两次添加玉米浆干粉后的OUR、CER和RQ的变化,从整体趋势上来看,两次添加玉米浆干粉导致CER和OUR出现较为明显的增加,RQ也相应从0.7提高至0.9。出现这种变化的原因可能是添加玉米浆干粉后,细胞获得足够多的营养因子后进一步生长,从而导致氧的消耗速率提高,二氧化碳的产生量也加大,反映在OUR曲线上看就是不再下降,而是维持平稳趋势。从RQ来看,添加玉米浆干粉后,RQ从0.7慢慢升高至0.9,可能是菌体的代谢发生了变化,生长和PSA生产同时进行。这一现象表明,RQ与细胞生长以及PSA生产有很强的相关性,因此有可能是调控PSA合成的理想实时在线参数。

图3 发酵过程不添加玉米浆干粉(A)和添加玉米浆干粉(B)对OUR、CER和RQ的影响Fig. 3 Time courses of OUR, CER and RQ in fed-batch fermentation by E. coli in control (A) and with batch feeding of corn steep powder (B)
2.6 在线RQ调控流加玉米浆干粉策略比较
由于PSA是在细胞内表达,然后通过细胞膜转运系统转出胞外[28],细胞的数量在一定程度上影响着PSA的产量,因此可考虑进一步提高细胞密度。根据摇瓶实验结果显示,玉米浆干粉既可提高生物量也可以提高PSA产量,然而添加时机和添加量对PSA产量影响大,因此需要在生物量的增长和PSA合成之间进行平衡。PSA产量较高的菌种在发酵过程中,RQ维持在0.7左右。而玉米浆干粉补入对RQ影响又比较显著,可以采用流加玉米浆干粉提高生物量的同时通过控制玉米浆干粉流加速率对RQ进行调控,从而取得高生物量的同时也能提高PSA产量。
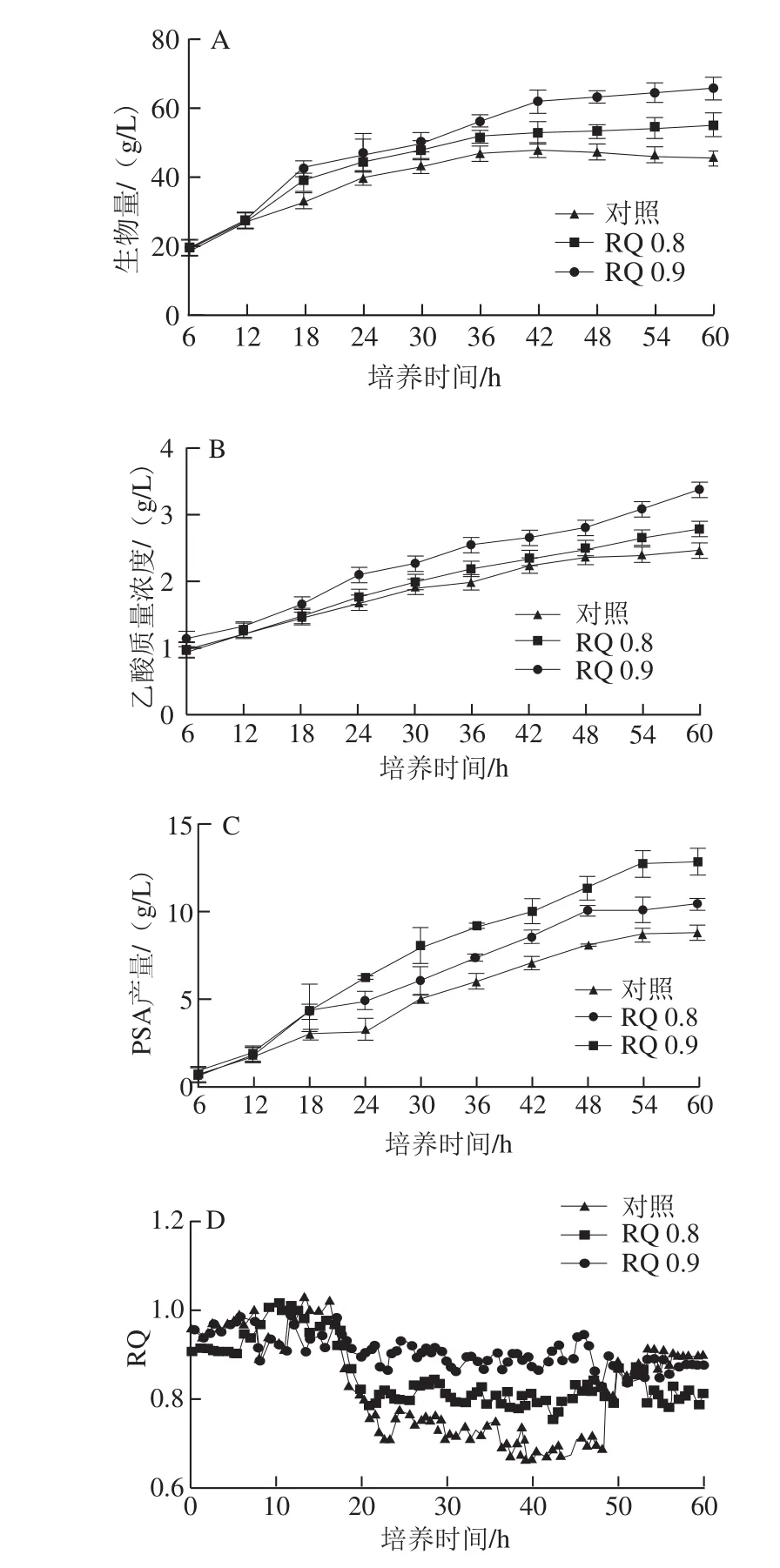
图4 不同策略下生物量(A)、乙酸(B)、PSA产量(C)及RQ(D)变化趋势Fig. 4 Time courses of dry biomass yield (A), acetic acid (B), PSA titer (C)and RQ (D) in fed-batch fermentation by E. coli using different strategies
从图4A可见,流加玉米浆干粉的两个批次生物量增长明显高于对照,当RQ控制在0.9时,生物量最高可达到65.7 g/L,RQ控制在0.8时,生物量最高可达到55.2 g/L,分别是对照生物量的1.45 倍和1.22 倍。图4B显示,RQ控制在0.9时,乙酸整体质量浓度高于RQ控制在0.8的批次和对照。可能是因为这株大肠杆菌乙酸的产生是本底表达,只要有碳源利用就会产生乙酸。计算乙酸对菌体的得率发现,对照组、RQ 0.8、RQ 0.9的批次乙酸/生物量分别为0.055、0.051、0.052,这3 组数据都比较接近,说明生物量的提高也会带来乙酸质量浓度的提高。因此,流加玉米浆干粉对乙酸的产生无显著影响(P>0.05)。图4C显示,RQ 0.8、RQ 0.9的批次在60 h分别达到12.83、10.42 g/L,比对照分别提高了45.30%、18.01%。图4D显示了不同策略下RQ的实际变化曲线,可以看出,流加玉米浆干粉可有效实时在线控制RQ,随着玉米浆干粉流加量的提高,RQ也会提高。这可能是流加玉米浆干粉后,刺激了细胞的生长,使得部分细胞快速生长,而细胞在快速生长阶段RQ控制在1.0,因此流加玉米浆干粉后RQ会适当提高。
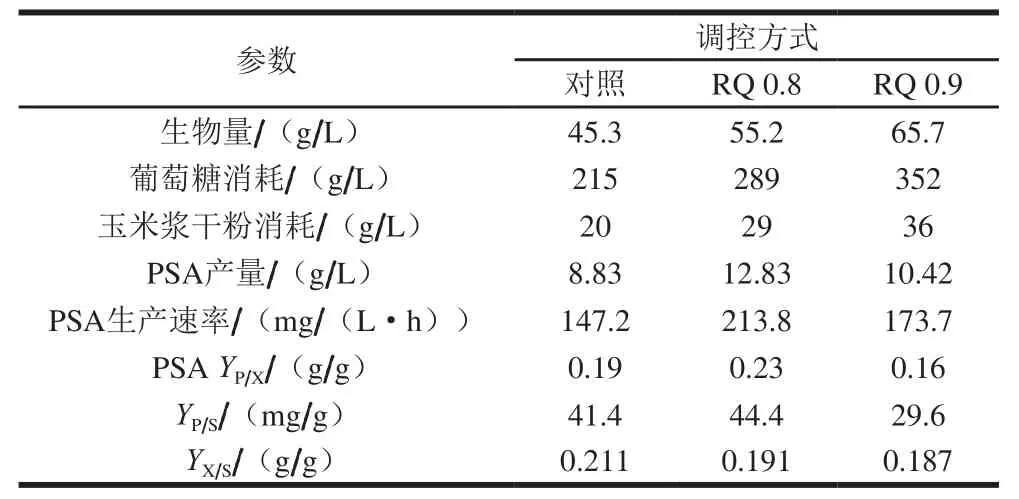
表3 不同调控方式下菌体生物量及PSA产量和速率参数Table 3 Dry biomass yield and calculation of PSA yield and rate parameters in three fermentation modes
瞿亮等[29]采用RQ在线控制葡萄糖流速,以刺激脂肪酸的合成,DHA产量提高了12.19%。程奔等[30]也采用RQ在线实时控制葡萄糖流速以提高酵母的生物量。所不同的是已报道文献控制的是葡萄糖流速,而本研究控制的是氮源流速。控制氮源的最主要优势在于维持细胞的生长活力,以持续稳定地进行目标产物的合成。然而,其中较大的技术难点在于氮源一旦过量则会导致整个代谢途径的变化,使得细胞的生长占据主要地位。付旭东等[31]在大肠杆菌合成PSA前期停止补充氨水并补入适量蛋白胨,最终PSA产量有所提高,此结果和本研究具有一致性。当玉米浆干粉补入量提高后,PSA产量得到很好的提高,如表3所示,与对照相比,RQ 0.8的批次玉米浆干粉用量增加了9 g/L,PSA产量提高了45.30%。随着玉米浆干粉用量继续增加PSA产量反而比RQ 0.8批次降低18.78%。可见,玉米浆干粉的用量对PSA影响非常大。实际上,由于RQ 0.9补入的玉米浆干粉偏多,导致细胞过度生长,生物量高达65.7 g/L,尽管PSA产量比对照提高了,但是葡萄糖转化量(YP/S)大大降低,仅29.6 mg/g,比对照降低了28.50%,对于工业化生产来说,原料成本将大幅度提高。由此可见,玉米浆干粉的流加策略对PSA产量及生产成本会有很大的影响。而RQ在线实时监控则可以随时了解菌体的代谢状况,并据此对补料进行实时调控,从而能稳定PSA的生产,这对PSA工业化生产将具有重大的意义。

表4 大肠杆菌工艺调控方式及PSA产率与文献结果的比较Table 4 Comparison of PSA productivity of E. coli using the strategy presented in this study with literature data
采用离子束诱变大肠杆菌产PSA的研究甚少,其中张丽敏等[19]采取离子束诱变处理得到高产PSA菌株的产量提高率为24.00%,但并没有进一步研究发酵工艺。Chen Fang等[14]采用基因改造加强了PSA合成途径并敲除竞争性途径中的相关基因,PSA产量提高率达到85.00%。如表4所示,本研究通过离子束诱变得到的菌株PSA产量提高率为36.81%,采用RQ在线调控流加玉米浆干粉后,PSA产量提高率相对出发菌株的PSA提高率达到了88.95%。最终产量达到12.83 g/L,高于大部分文献报道的PSA产量。尽管本研究所采用的离子束诱变技术应用于PSA菌株筛选已有文献报道,但筛选得到的菌株产量提高了36.81%,相对已有报道的产量提高率24.00%有所提高,此外,本研究基于诱变得到的不同菌株进行了深入研究,得到了工艺调控的思路,且采用RQ调控玉米浆补料的方式在PSA生产中鲜见应用,具有一定的新颖性。采用RQ在线实时调控玉米浆干粉补料工艺的产量提高率为45.30%,和其他研究相比不高,但RQ是从代谢角度反映菌体在发酵过程中的实时变化情况,因此可以用于指导PSA的中试放大,并且在PSA生产过程中可实时监控菌体代谢情况,具有很好的工业应用价值。
3 结 论
本研究采用低能离子束注入诱变结合RQ在线实时调控PSA生产的策略,诱变得到1 株PSA产量最高为3.94 g/L的突变株,通过RQ在线实时调控流加玉米浆干粉使得PSA产量达到12.83 g/L,比对照提高了45.30%,比出发菌株的产量提高了88.95%。低能离子束注入诱变产生的菌株PSA产量最低和最高之间的差异可达到77.48%(P<0.01),通过比较产量差异极大菌株的RQ变化规律可了解高产菌株在RQ上的表现性状,从而制定相应的工艺调控策略。在PSA生产期,流加玉米浆干粉将RQ控制在0.8左右是一种易于实现的控制策略,既能促进细胞生长,也能提高PSA产量。与传统诱变选育高产菌株的研究相比,本研究特别利用了产量较低的菌株作为参照,通过尾气分析不同菌株的RQ变化规律,得到低产和高产菌株的RQ差异,进而在后续工艺调控上应用RQ控制策略,最终实现了PSA产量的大幅度提高,因此本研究提出的离子束注入诱变结合RQ在线实时补料的思路对于其他发酵工艺产品具有一定的借鉴意义,此外,在PSA产业化放大也具有很好的参考价值。
