大肠杆菌高效表达屎肠球菌纤维素结合域谷氨酸脱羧酶的条件优化
2019-07-26杨胜远张晓宁甄嘉仪
杨胜远 林 谦 张晓宁 甄嘉仪
(1.岭南师范学院化学化工学院,广东 湛江 524048;2.玉林师范学院生物与制药学院,广西 玉林 537000)
谷氨酸脱羧酶(glutamate decarboxylase,GAD,EC4.1.1.15)可专一地催化L-谷氨酸(L-glutamic acid,L-Glu)α-羧基发生脱羧作用,在γ-氨基丁酸 (γ-aminobutyric acid,GABA)生物合成和手性物质DL-谷氨酸(DL-glutamic acid,DL-Glu)的拆分方面具有重要作用[1-3]。由于乳酸菌具有较好的安全性,在发酵食品中已广泛应用,乳酸菌GAD受到了极大关注,已发现Lactobacillusrhamnosus[4]、Lactobacillusparacasei[5]、Lactobacillussakei[6]、Lactobacillusbrevis[7]、Streptococcussalivariusssp.thermophilus[8]、Pediococcuspentosaceus[9]、Enterococcusfaecium[10]和Lactobacillusplantarum[11]等微生物均具有GAD。然而,GAD通过催化L-Glu发生脱羧而消耗质子,改善微生物细胞微环境pH,从而消除酸对细胞的不利影响,即GAD的主要生理功能是提高微生物的耐酸能力[12-13]。因此,野生株GAD通常表达量不高,远不能满足工业用酶需求。同时,游离酶易受杂蛋白干扰,不能回收利用,是造成应用成本居高不下的重要原因。固定化酶可克服游离酶的缺点,但固定化酶制备方法的实用性、酶活回收率、稳定性和成本等问题也严重制约着固定化酶的应用。因此,通过基因工程技术构建工程菌高效表达GAD,特别是在GAD中引入对特定载体具有特异吸附的亲和标签,实现低成本固定化酶生产,将是解决工业用酶的重要途径。GAD基因工程菌的构建和GAD的固定化已成为研究的焦点[14-18]。
纤维素在商业上可以以多种不同的形式存在,来源丰富,价格低廉,化学惰性,对大多数蛋白质非特异性亲和力低,是一种优质的载体。大多数纤维素降解酶包含3个结构域:纤维素结合结构域(cellulose-binding domain,CBD)、柔性连接区域和催化结构域[19-21],因此可利用CBD与纤维素发生特异和不可逆结合的特性,将CBD开发为亲和标签,构建融合蛋白,与纤维素亲和吸附制备固定化酶[21-25]。如能构建并高效表达出纤维素结合域谷氨酸脱羧酶(cellulose-binding domain-glutamate decarboxylase,CBD-GAD)融合酶,通过纤维素进行固定化,将对GAD的应用推广具有很好的促进作用。
在前期研究中,笔者[26]已经获得了酶学性质良好的、GAD活性较高的屎肠球菌(Enterococcusfaecium)野生菌株,并成功构建了可表达屎肠球菌CBD-GAD的工程菌大肠杆菌(Escherichiacoli)GDMCC60445。由于宿主菌E.coli自身存在gadB基因,可表达自身GAD,对CBD-GAD表达以及CBD-GAD活力测定均存在严重干扰。然而,关于如何通过针对性的测定CBD-GAD融合酶的酶活而不是GAD总酶活,探索出适宜CBD-GAD融合酶的高效表达条件,尚鲜见报道。田口试验设计法是日本田口玄一在费歇尔多元配制法试验设计的基础上开发的试验技术,通过对两批次试验结果的均值分析和信噪比分析,能较好地预测和优化工程条件。本试验拟以固定化酶特异性评价CBD-GAD酶活的方法,采用田口试验设计法对大肠杆菌高效表达屎肠球菌CBD-GAD条件进行探讨,以期为相关酶工程研究提供借鉴和理论依据。
1 材料与方法
1.1 材料与试剂
E.coliGDMCC60445:本试验自行构建的可表达屎肠球菌CBD-GAD融合酶的工程菌株,作为专利菌种保藏于广东省微生物菌种保藏中心;
γ-氨基丁酸(质量分数≥99%)、异硫氰酸苯酯(phenylisothiocyanate,PITC)和5′-磷酸吡哆醛(pyridoxal 5′-phosphate,PLP):美国Sigma公司;
乙腈、乙酸、三乙胺:色谱纯,美国TEDIA公司;
氨苄青霉素(Ampicillin,Amp):钠盐,美国药典级,生工生物工程(上海)有限公司;
其他试剂:生化试剂或分析纯试剂,市售;
再生无定形纤维素(regenerated amorphous cellulose,RAC):参照文献[27]制备;
LB培养基(Luria-Bertani):参照文献[28]配制,略有改变,配方为胰蛋白胨10 g/L、酵母膏 5 g/L、NaCl 10 g/L、L-谷氨酸一钠(monosodium glutamate,MSG)10 g/L、Amp 0.1 g/L,pH 7.0;
NB(nutrient broth,营养肉汤)培养基:参照文献[28]配制,略有改变,配方为牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L、MSG 10 g/L、Amp 0.1 g/L,pH 7.0;
TYG(Tryptone-Yeast extract-Glucose)培养基:参照文献[29]配制,略有改变,配方为胰蛋白胨5 g/L、酵母膏5 g/L、葡萄糖10 g/L、MSG 10 g/L、Amp 0.1 g/L,pH 7.0;
PSB(peptone-sucrose-beef extract)培养基:参照文献[10]配制,略有改变,配方为蛋白胨15 g/L、牛肉膏10 g/L、蔗糖 12.5 g/L、乙酸钠6 g/L、MSG 10 g/L、吐温80 1.0 g/L、Amp 0.1 g/L,pH 7.0;
上述培养基按照配方配制,分装于规格250 mL三角瓶,每瓶120 mL,121 ℃灭菌20 min,冷却并于临用前加入Amp。
1.2 仪器与设备
高效液相色谱仪:1200 Series型,配置G1354A四元梯度泵、G1316A 柱温箱、G1314B可变波长紫外检测器、Chemstation工作站,美国安捷伦公司;
恒温震荡培养箱:HZQ-F100型,金坛市精达仪器制造有限公司;
台式高速冷冻离心机:TGL16M型,盐城市凯特实验仪器有限公司;
冷冻水浴恒温振荡器:SHA-2型,江苏省金坛市三和仪器有限公司;
电子分析天平:AUW120型,日本Shimadzu公司。
1.3 方法
1.3.1 粗酶液提取与RAC-CBD-GAD制备 将E.coliGDMCC60445发酵液120 mL于4 ℃、8 500 r/min 离心15 min,收集菌体,加入30 mL生理盐水,搅拌分散洗涤菌体,再次离心收集菌体,然后加入pH 8.0、50 mmol/L Tris-HCl 缓冲液10 mL,冰水浴中400 W超声波破碎细胞(工作5 s,冷却5 s,全程50 min)。将细胞破碎液于8 500 r/min、4 ℃离心15 min,上清液即为粗酶提取液。取8 mL粗酶提取液与0.6 g湿RAC混合,30 ℃、50 r/min 振荡15 min,滤出液体,即可获得RAC固定化CBD-GAD(表示为RAC-CBD-GAD),然后采用pH 8.0、50 mmol/L Tris-HCl缓冲液40 mL分5次洗涤RAC-CBD-GAD,再采用生理盐水40 mL分5次洗涤RAC-CBD-GAD,抽滤去除洗涤液,即为纯RAC-CBD-GAD。
1.3.2 GAD活力测定 为了减少CBD-GAD制备过程的损失和宿主菌E.coli自身基因组表达的GAD的影响所造成的误差,本试验通过测定RAC-CBD-GAD活力评价CBD-GAD融合酶的表达情况。
将RAC-CBD-GAD 0.2 g与pH 4.8、0.25 mol/LL-Glu溶液(溶于0.2 mol/L乙酸盐缓冲液,含0.2 mmol/L PLP)10 mL混合,40 ℃、80 r/min水浴振荡反应30 min,立即吸取反应液0.5 mL与无水乙醇0.5 mL混合终止反应,8 500 r/min离心15 min,取上清液采用HPLC测定GABA。
GAD活力单位定义为:在上述测定条件下1 min生成1 μmol GABA所需要的酶量为1个酶活单位(U)。以单位质量RAC-CBD-GAD所具有的GAD酶活(U/g)或以GAD酶活最高的试验组RAC-CBD-GAD平均酶活为100%计算相对酶活(%)表示。
1.3.3 HPLC测定GABA 参照文献[29]进行测定。HPLC色谱条件为:ZORBAX Eclipse XDB C18(4.6 mm×250 mm,5 μm)色谱柱;检测波长254 nm;进样量20 μL,柱温25 ℃。
1.3.4 种子液的制备 吸取-25 ℃甘油保藏E.coliGDMCC60445菌种1 mL,接入LB培养基,37 ℃、120 r/min 振荡培养12 h。
1.3.5 RAC添加量对CBD-GAD固定化的影响 将粗酶提取液8 mL分别与0.2,0.4,0.6,0.8,1.0 g RAC进行固定化制备RAC-CBD-GAD,并测定其活力。根据RAC-CBD-GAD最大总酶活对应的RAC用量乘以安全系数3确定试验所需RAC用量,以保证吸附载体充裕,最大限度吸附回收CBD-GAD。
1.3.6 不同培养基对CBD-GAD表达的影响 分别取E.coliGDMCC60445种子液2 mL接入120 mL LB培养基、NB培养基、TYG培养基、PSB培养基,37 ℃、120 r/min振荡培养24 h。收集细胞,制备RAC-CBD-GAD并测定其活力。
1.3.7 MSG添加量对CBD-GAD表达的影响 分别取E.coliGDMCC60445种子液2 mL接入MSG添加量分别为0.0,2.5,5.0,7.5,10.0,12.5 g/L的120 mL、pH 5.5的LB培养基,37 ℃、120 r/min振荡培养24 h。收集细胞,制备RAC-CBD-GAD并测定其活力。
1.3.8 Amp对CBD-GAD表达的影响 按种子液制备方法,将E.coliGDMCC60445在不含Amp的LB培养基中连续转接5批次作为种子液,然后吸取2 mL接入120 mL 不含Amp的LB培养基,37 ℃、120 r/min振荡培养24 h。收集细胞,制备RAC-CBD-GAD并测定其活力。以含0.1 g/L Amp的LB培养基按照同样操作作为对照。
1.3.9 培养基初始pH值对CBD-GAD表达的影响 分别取E.coliGDMCC60445种子液2 mL接入120 mL 初始pH 分别为5.0,5.5,6.0,6.5,7.0,7.5,8.0的LB培养基,37 ℃、120 r/min振荡培养24 h。收集细胞,制备RAC-CBD-GAD并测定其活力。
1.3.10 培养温度对CBD-GAD表达的影响 分别取E.coliGDMCC60445种子液2 mL接入120 mL LB培养基,分别于31,34,37,40,43 ℃,120 r/min振荡培养24 h。收集细胞,制备RAC-CBD-GAD并测定其活力。
1.3.11 转速对CBD-GAD表达的影响 分别取E.coliGDMCC60445种子液2 mL接入120 mL LB培养基,在37 ℃分别于0,80,100,120,140 r/min振荡培养24 h。收集细胞,制备RAC-CBD-GAD并测定其活力。
1.3.12 发酵时间对CBD-GAD表达的影响 分别取E.coliGDMCC60445种子液2 mL接入120 mL LB培养基,37 ℃、120 r/min分别振荡培养12,24,36,48,60 h。收集细胞,制备RAC-CBD-GAD并测定其活力。
1.3.13 田口试验设计 结合单因素试验结果选择LB培养基,以pH、胰蛋白胨和酵母膏为考察因素,采用Minitab 15软件选择田口试验设计法进行优化。以两批次重复试验的结果作为响应值,采用田口试验分析的望大法分析均值和信噪比,从而确定各因素的最优水平。根据单因素试验结果,各组试验培养基中均未添加MSG和Amp,NaCl添加量均为10 g/L。规格为250 mL三角瓶装液量120 mL,121 ℃灭菌20 min。
1.3.14 数据处理与分析 利用IBM SPSS Statistics 19.0软件采用单因素方差分析(ANOVA)的最小显著差数法(LSD)进行统计分析。图表中英文字母相同表示两组间差异不显著(P>0.05),英文字母不同表示两组间差异显著(P<0.05)。
2 结果与分析
2.1 RAC添加量对CBD-GAD固定化的影响
当大肠杆菌存在外源酶的同工酶时,由于酶活测定无法区分同工酶的各自活力,对外源酶的高效表达条件研究造成非常大的困扰,无从确定优化的结果是有利于自身的天然酶表达还是有利于外源酶的表达。虽然在理论上,可采用宿主菌作为对照,以工程菌表达的同工酶的总酶活扣除宿主菌表达的天然酶的酶活,作为工程菌表达的外源酶的酶活,但是转化了外源酶的重组质粒后,质粒对宿主菌天然酶基因的表达是否具有影响尚未知,因此以宿主菌作为对照,研究外源酶的表达条件并不可取。由于RAC对含有CBD的融合酶具有很强的特异性吸附性能,因此本试验先采用RAC将CBD-GAD与大肠杆菌自身的GAD天然酶和其他杂蛋白分离,再通过测定固定化酶RAC-CBD-GAD活性,可解决E.coli的GAD天然酶对酶活力测定的干扰。但是,由于表达条件优化中不同条件下CBD-GAD的量存在差异,因此必须具有充足的RAC以保证能最大限度地将不同批次的粗酶液CBD-GAD完全吸附。
从图1可见,当0.2 g RAC与8 mL CBD-GAD粗酶液混合,RAC-CBD-GAD总酶活已达最大值,继续增加RAC,RAC-CBD-GAD总酶活基本恒定,与0.1 g RAC试验组差异显著(P<0.05),而与其他各组差异不显著(P>0.05)。结果说明0.2 g RAC已能将8 mL CBD-GAD粗酶液的CBD-GAD完全吸附。为了能保证RAC充足,试验预设安全系数为3,即选择0.6 g RAC用于8 mL 粗酶液CBD-GAD的固定化。

图1 RAC添加量对CBD-GAD固定化的影响Figure 1 Effect of amount of RAC on the immobilization of CBD-GAD
2.2 培养基对CBD-GAD融合酶表达的影响
从图2可知,以LB、NB、TYG、PSB培养基发酵的E.coliGDMCC60445均可表达CBD-GAD融合酶,其中以LB培养基发酵表达CBD-GAD最高,与其他试验组差异极显著(P<0.01);与LB培养基相比,NB、TYG、PSB培养基获得的RAC-CBD-GAD相对酶活仅分别为(74.14±2.46)%,(0.95±0.22)%,(78.04±6.74)%。结果表明,LB培养基更适宜E.coliGDMCC60445表达CBD-GAD。
2.3 MSG添加量对CBD-GAD表达的影响
由图3可见,MSG添加量为0.0~12.5 g/L时RAC-CBD-GAD活力基本一致,无显著性差异(P>0.05),说明MSG对E.coliGDMCC60445表达CBD-GAD融合酶无影响。因此,选择不添加MSG。

图2 不同培养基对CBD-GAD融合酶表达的影响Figure 2 Effect of different medium on the expression of fusion CBD-GAD

图3 L-谷氨酸钠对CBD-GAD融合酶表达的影响Figure 3 Effect of addition amount of MSG on the expression of fusion CBD-GAD
MSG是GAD催化反应底物,可以在GAD催化下发生脱羧作用而减轻质子对细胞的危害,因此为了通过MSG的诱导或抗酸作用而提高GAD的表达,常在培养基中添加MSG[10,30-31]。本试验表明MSG对E.coliGDMCC60445工程菌产CBD-GAD无影响,其原因可能是本试验构建的E.coliGDMCC60445工程菌采用胁迫诱导型启动子PrpoS,MSG对其无诱导作用,同时培养条件为弱酸环境,对E.coli细胞影响不大,通过MSG脱羧抗酸的生理效应不显著。
2.4 Amp对CBD-GAD表达的影响
基因工程菌容易丢失质粒,通常需要在培养基中添加与工程菌抗性标记相对应的抗生素以防止质粒丢失[25,31-33]。然而抗生素价格昂贵,应用成本高,风险大,不利于工业应用。E.coliGDMCC60445工程菌携带AmpR抗性标记,图4对E.coliGDMCC60445工程菌是否需要在培养基中添加Amp以确保CBD-GAD正常表达进行了考察。结果显示E.coliGDMCC60445工程菌连续在无Amp的种子培养基中连续转接5批次,并在无Amp的培养基中发酵,其表达CBD-GAD的能力与添加Amp的对照组一致,无显著性差异(P>0.05)。结果表明,E.coliDH5α-LNSF02工程菌性能稳定,培养基不需添加氨苄青霉素。

图4 氨苄青霉素对CBD-GAD融合酶表达的影响Figure 4 Effect of ampicillin on the expression of fusion CBD-GAD
2.5 培养基初始pH值对CBD-GAD融合酶表达的影响
图5显示,培养基的初始pH对CBD-GAD的表达影响较大。培养基初始pH为5.5和6.0时,RAC-CBD-GAD相对酶活较大,随着培养基初始pH降低或增高,RAC-CBD-GAD相对酶活均逐渐下降。虽然统计分析结果表明,pH 5.5试验组与pH 6.0试验组之间无显著性差异(P>0.05),但RAC-CBD-GAD相对酶活的平均值最高,因此选择培养基的初始pH为5.5。

图5 初始pH对CBD-GAD融合酶表达的影响Figure 5 Effect of initial pH value on the expression of fusion CBD-GAD
E.coli通常在中性环境生长较好,但本试验表明培养基的初始pH为5.5时更有利于CBD-GAD的表达,说明CBD-GAD的表达与宿主菌的生长并不协同,在偏酸性条件下更利于胁迫诱导型启动子PrpoS发挥作用,启动CBD-GAD的表达。
2.6 培养温度对CBD-GAD融合酶表达的影响
由图6可见,培养温度低于37 ℃时,RAC-CBD-GAD的相对酶活随着温度的升高而增大,当超过37 ℃,活力迅速下降,各试验组间差异极显著(P<0.01)。结果表明,E.coliGDMCC60445表达CBD-GAD融合酶的最适培养温度为37 ℃,与E.coli适宜生长温度一致。因此,选择培养温度为37 ℃。
2.7 摇床转速对CBD-GAD融合酶表达的影响
从图7可见,随着摇床转速的增加,RAC-CBD-GAD相对酶活逐渐增加,当超过120 r/min时,继续提高转速,RAC-CBD-GAD活力趋于平稳,120 r/min试验组与140 r/min 试验组差异不显著(P>0.05)。因此,选择摇床转速为120 r/min。

图6 培养温度对CBD-GAD融合酶表达的影响Figure 6 Effect of culture temperature on the expression of fusion CBD-GAD

图7 摇床转速对CBD-GAD融合酶表达的影响Figure 7 Effect of rotation speed on the expression of fusion CBD-GAD
2.8 发酵时间对CBD-GAD表达的影响
图8显示,发酵24 h,RAC-CBD-GAD活力最大,继续延长发酵时间,RAC-CBD-GAD活力略有下降;36~60 h 内趋于平稳,各试验组差异不显著(P>0.05)。由于发酵培养不是同步培养,部分菌体因进入衰亡期而自溶,而CBD-GAD融合酶为胞内酶,试验中只收集细胞进行提取酶,从而造成细胞自溶释放到发酵液中的CBD-GAD未被收集,可能是发酵24 h后检测的RAC-CBD-GAD活力略有下降的原因。选择发酵时间为24 h。
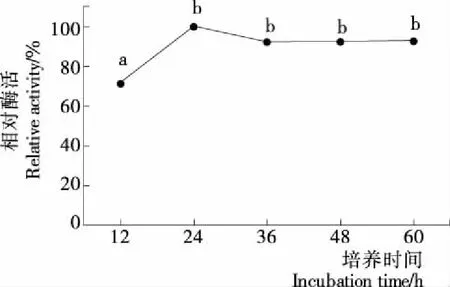
图8 发酵时间对CBD-GAD融合酶表达的影响Figure 8 Effect of fermentation time on the expression of fusion CBD-GAD
2.9 田口试验结果
因素和水平选择详见表1,试验设计和试验结果详见表2。因素水平的均值和信噪比分析结果详见图9~12和表4~6。

表1 试验因素与水平Table 1 Factors and levels table
表2田口试验设计及结果
Table 2Taguchi design matrix with the experimental values of RAC-CBD-GAD activity
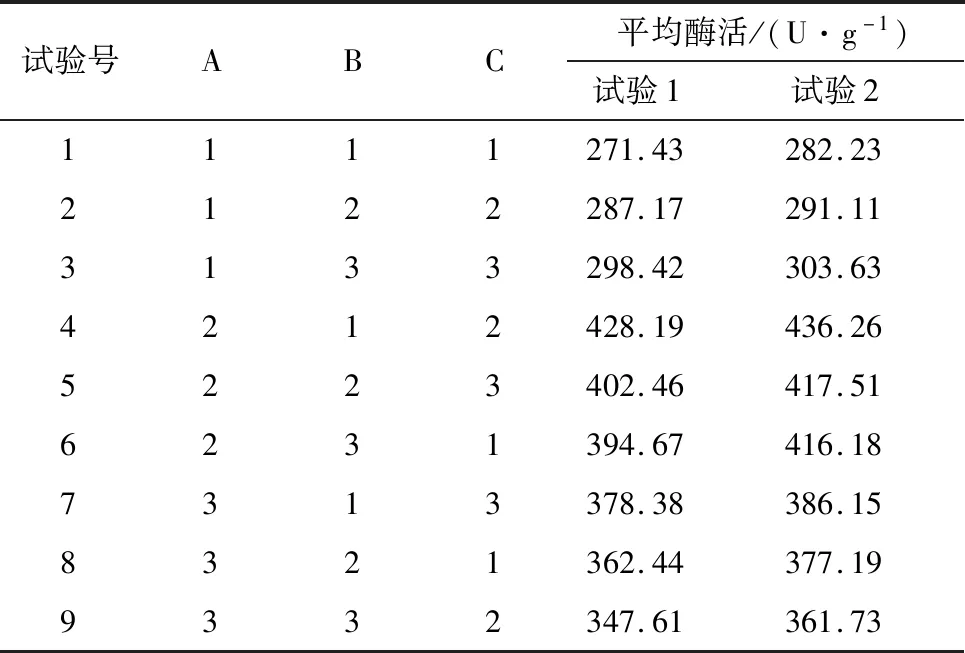
试验号ABC平均酶活/(U·g-1)试验1试验21111271.43282.232122287.17291.113133298.42303.634212428.19436.265223402.46417.516231394.67416.187313378.38386.158321362.44377.199332347.61361.73

图9 均值残差正态概率图Figure 9 Normal probability plots of mean residuals
图10 信噪比残差正态概率图Figure 10 Normal probability plots of the residuals of signal-to-noise ratio
图9、10显示,各因素的均值残差和信噪比残差与模型拟合较好,为正态分布。表3、4表明各因素的均值响应情况为A>C>B,其中A为显著因素(P<0.05),B和C为不显著因素(P>0.05)。表5、6表明各因素的信噪比响应情况也为A>C>B,其中A为显著因素(P<0.05),B和C为不显著因素(P>0.05)。
根据均值和信噪比分析结果,确定显著性因素(A)为位置因子,不显著因素(B、C)为散度因子。由图11选择均值最大的水平作为位置因子水平,即A2;由图12选择可使散度最小化的水平作为散度因子的水平,即B1、C3。因此,各因素和水平的最优组合为A2B1C3。
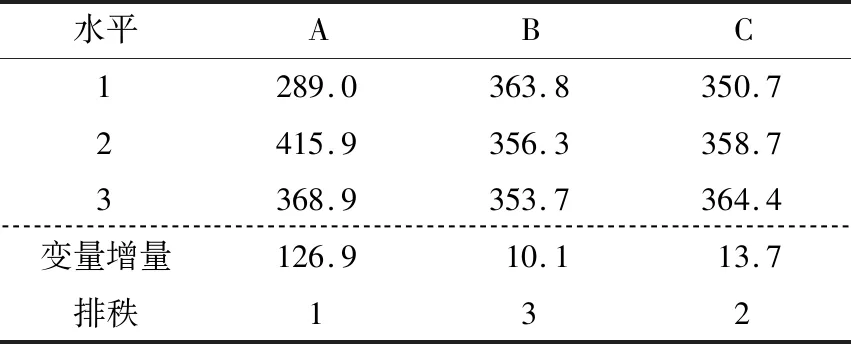
表3 因素水平的均值响应分析Table 3 Mean value response of the selected factor levels
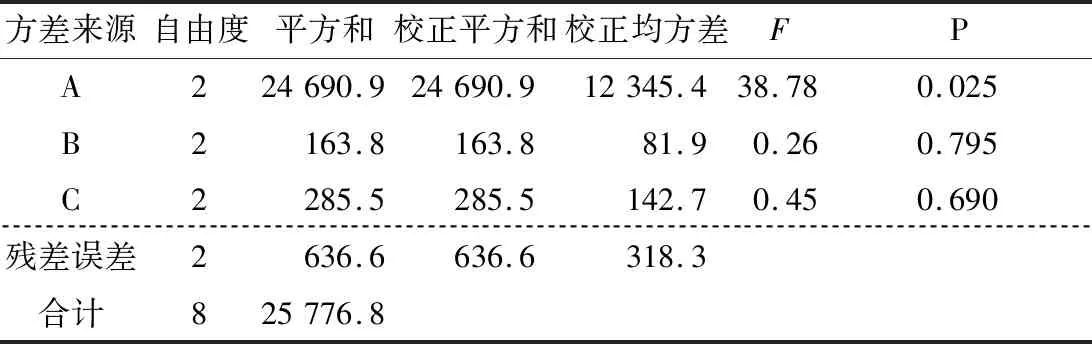
表4 均值方差分析Table 4 Analysis of variance of mean value
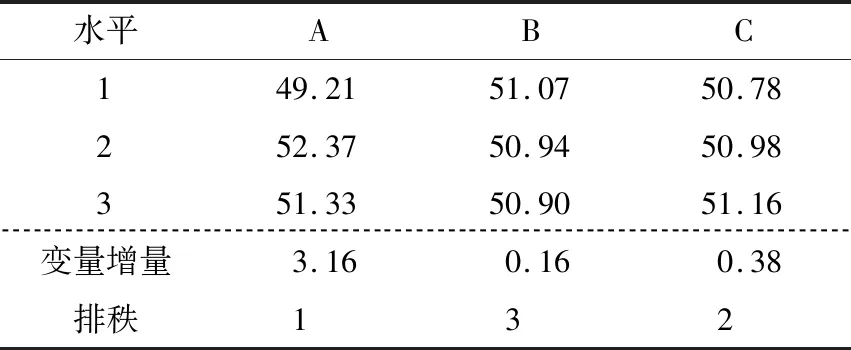
表5 因素水平的信噪比响应分析Table 5 Response of signal-to-noise ratio of the selected factor levels
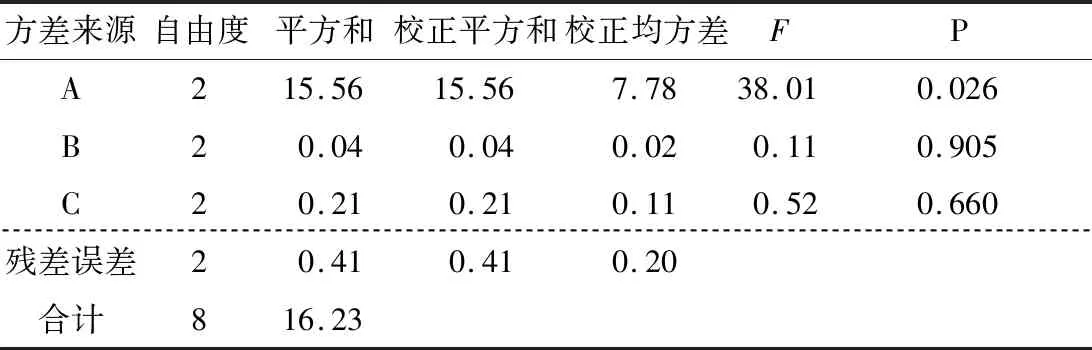
表6 信噪比方差分析Table 6 Analysis of variance of signal-to-noise ratio
结合非考察的因素NaCl,即可获得E.coliGDMCC60445表达屎肠球菌CBD-GAD融合酶的适宜LB培养基(称为改良LB培养基)组成为:胰蛋白胨8 g/L、酵母膏 6 g/L、NaCl 10 g/L,pH 5.5。
2.10 验证实验
采用软件“预测田口结果”功能以最优水平A2B1C3进行预测,预测在优化条件下获得的RAC-CBD-GAD酶活为(428.21±7.50)U/g。经以改良LB培养基作为发酵培养基进行验证实验,结果RAC-CBD-GAD酶活为(419.79±10.37)U/g,与预测值差异不显著(P>0.05),即验证试验结果与预测值相符。当以初始LB培养基进行发酵时,RAC-CBD-GAD酶活为(322.31±13.08)U/g,与改良LB培养基试验组差异极显著(P<0.01)。结果表明,优化后的改良LB培养基较初始LB培养基发酵产CBD-GAD的能力提高了(30.28±3.22)%。

图11 均值主效应图Figure 11 The main effects plot of means

图12 信噪比主效应图(信噪:望大)Figure 12 The main effects plot of signal-to-noise ratio (SN:larger-the-better)
3 结论
在构建基因工程菌表达外源酶的研究中,当宿主菌也可表达外源酶的同工酶时,由于同工酶的催化反应相同,很难区分各自的酶活力,对外源酶的表达条件研究带来了极大困难。本试验通过利用RAC特异性吸附CBD-GAD,将CBD-GAD与宿主菌E.coli自身基因表达的杂蛋白和天然GAD分离,避免了E.coli天然GAD和杂蛋白的影响,试验结果可真实反映CBD-GAD表达情况。
E.coliGDMCC60445表达CBD-GAD的适宜培养基为改良LB培养基,其组成为胰蛋白胨8 g/L、酵母膏 6 g/L、NaCl 10 g/L、pH 5.5;适宜的培养条件为温度37 ℃、摇床转速120 r/min、培养时间24 h。培养基组成少、成本低、配制简便,具有较好工业化应用前景。
