玉米醇溶蛋白负载叶黄素纳米粒的制备与表征
2019-07-26高建伟GAOJianwei
焦 岩 韩 赫 常 影 李 冲 高建伟GAO Jian-wei
(1.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006;2.黑龙江省玉米深加工理论与技术重点实验室,黑龙江 齐齐哈尔 161006)
玉米醇溶蛋白(Zein)来自于玉米淀粉加工的副产物玉米黄粉中[1]。Zein的氨基酸组成具有特殊性,因Zein分子中有 50%以上的疏水氨基酸使其具有两亲性,并具有独特的自组装特性。以Zein为载体不仅能够通过包埋与载运植物香精、功能油脂而提高功能性成分的稳定性,而且能够起到增加溶解性和控释性等方面的作用。应用反溶剂法可以制备Zein纳米粒,其原理为利用溶剂的极性变化改变Zein的构象,并辅助机械方法制备成纳米结构体系[2]。例如,Chuacharoen等[3]制备了玉米醇溶蛋白负载β-胡萝卜素纳米粒,提高了β-胡萝卜素的化学稳定性和在胃肠液环境下的抗氧化活性,效果优于β-胡萝卜素乳化液;玉米醇溶蛋白还可用于番茄精油的微胶囊壁材,可以防止番茄红素在储存过程中的降解,并防止番茄红素在胃液环境中过多的释放[4];Hu等[5]采用超临界二氧化碳法制备叶黄素/玉米醇溶蛋白纳米粒,可对叶黄进行有效包埋并显示出良好的控释效果。因此,玉米醇溶蛋白可以作为有效活性成分的载体,用于体内外输送和提高其稳定性能。
叶黄素属于类胡萝卜素。叶黄素可以保护视网膜色素上皮细胞(RPE)免受光氧化,并减少年龄相关性黄斑变性疾病(AMD),还可预防心脑血管疾病、减少辐射损伤和减少癌症等多种疾病的发生[6-8]。但是叶黄素化学结构不稳定,容易受到光、热、氧化等作用而被降解,而且叶黄素水溶性低,不易被体内消化吸收,限制了叶黄素在食品和医药领域的应用[9]。
研究[10]表明,玉米醇溶蛋白可以与活性物质通过自组装作用形成纳米复合物,改善稳定性和生物活性。本试验拟通过玉米醇溶蛋白的载体作用将叶黄素进行包埋与组装,制备成纳米结构体系,并解析其结构表征,旨在为拓展叶黄素在食品和医药领域的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
叶黄素:纯度≥95%,上海源叶生物科技有限公司;
玉米醇溶蛋白:美国Sigma公司;
无水乙醇、石油醚、NaH2PO4、Na2HPO4:分析纯。
1.2 仪器与设备
透射电子显微镜:F30型,美国FEI公司;
粒径分析仪:Nano-Zs90型,德国新帕泰克有限公司;
电子天平:JA2003型,上海良平仪器仪表有限公司;
旋转蒸发仪:RE2000E型,西安太康生物科技有限公司;
紫外分光光度计:UV2450型,日本岛津公司;
磁力加热搅拌器:CJJ-931型,常州万达升实验仪器有限公司;
离心机:TDL-5-A型,上海安亭科学仪器厂;
微型旋涡混合器:WXH型,上海跃进医疗器械厂;
傅里叶变换红外光谱仪:Spectrum One型,美国PE公司。
1.3 方法
1.3.1 玉米醇溶蛋白负载叶黄素纳米粒(Zein-Lutein)的制备 采用反溶剂法制备Zein-Lutein纳米粒[11]。将叶黄素晶体加入到85%乙醇溶液中超声溶解得到叶黄素原液,取等体积的玉米醇溶蛋白乙醇溶液按一定比例混合,将叶黄素原液和玉米醇溶蛋白混合溶液磁力搅拌混合均匀,然后在3 000 r/min下离心5 min,取上清液注入到等体积磷酸盐缓冲液中,调整pH并在一定温度下搅拌水合,然后经旋转蒸发除去乙醇,得到Zein-Lutein纳米粒溶液。
1.3.2 叶黄素标准曲线的制作及含量的测定 将梯度浓度的叶黄素制备成标准液,在最大吸收波长445 nm处测定吸光值,制作叶黄素标准曲线如图1所示。
经过绘制标准曲线计算得到叶黄素的含量与吸光值关系的标准方程为y=0.176 3x+0.004 4(R2=0.999 1)。表明叶黄素的含量与吸光值呈良好的线性关系[12]。
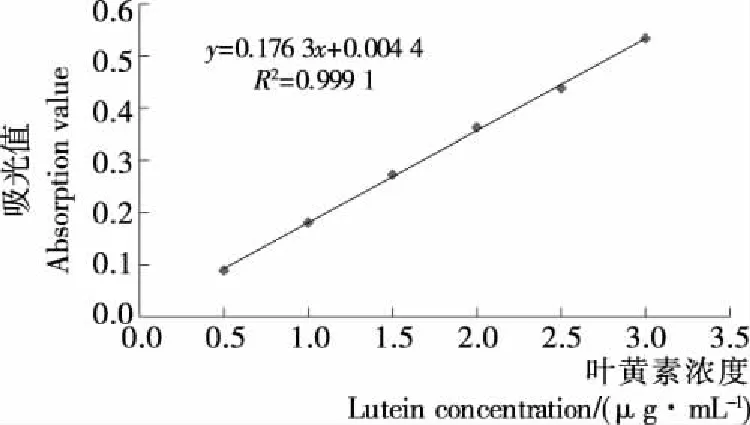
图1 叶黄素标准曲线Figure 1 The standard curve of Lutein
1.3.3 包封率的测定 取3.0 mL上述方法制备的Zein-Lutein溶液,加入3 mL石油醚震荡混匀1.0 min,在3 000 r/min 离心转速下离心5.0 min,重复试验操作3次,回收上清溶液在445 nm处测吸光值,根据标准曲线计算叶黄素溶液浓度,并根据式(1)计算包封率[13-14]。
(1)
式中:
EE——包封率,%;
C——黄素溶液浓度,μg/mL;
M——叶黄素总量,μg;
V——Zein-Lutein纳米粒的总体积,mL。
再者,农村小学的语文师资条件也是有限的,大多孩子小学毕业后,连汉语拼音都不过关,更别说其他方面的语文能力了。于是乎,这样的语文学习能力,便直接影响了对初中语文的学习。
1.3.4 玉米醇溶蛋白负载叶黄素纳米粒 (Zein-Lutein)制备单因素试验
(1)水合时间对Zein-Lutein制备效果的影响:将玉米醇溶蛋白与叶黄素按质量比20∶1混合均匀,3 000 r/min离心5 min,取上清液注入到等体积pH 4.0磷酸盐缓冲液中,在50 ℃下搅拌水合30,60,90,120,150,180 min,然后经旋转蒸发除去乙醇,得到Zein-Lutein纳米粒溶液。按上述方法测定包封率,研究水合时间对叶黄素包封率的影响。
(2)温度对Zein-Lutein制备效果的影响:将玉米醇溶蛋白与叶黄素按质量比20∶1混合均匀,3 000 r/min离心5 min,取上清液注入到等体积pH 4.0磷酸盐缓冲液中,在40,45,50,55,60,65 ℃下搅拌水合120 min,然后经旋转蒸发除去乙醇,得到Zein-Lutein纳米粒溶液。按上述方法测定包封率,研究温度对叶黄素包封率的影响。
(3)玉米蛋白与叶黄素质量比对Zein-Lutein制备效果的影响:将玉米醇溶蛋白与叶黄素分别按质量比5∶1,10∶1,15∶1,20∶1,25∶1混合均匀,3 000 r/min离心5 min,取上清液注入到等体积pH 4.0磷酸盐缓冲液中,在55 ℃下搅拌水合120 min,然后经旋转蒸发除去乙醇,得到Zein-Lutein纳米粒溶液。按上述方法测定包封率,研究玉米蛋白与叶黄素质量比对叶黄素包封率的影响。
1.3.5 玉米醇溶蛋白负载叶黄素纳米粒制备正交试验
在单因素试验的基础上选取水合时间、温度和玉米醇溶蛋白与叶黄素质量比3个主要的影响因素,以包封率为指标,采用正交试验设计,分别对Zein-Lutein纳米粒制备工艺进行优化。
1.3.6 Zein-Lutein粒径和电位的测定 取上述方法制备的Zein和Zein-Lutein样品溶液,适当调整浓度后取1.0 mL 置于Nano-90粒径分析仪样品池中进行分析,得到Zein和Zein-Lutein的粒径和电位分布图谱[15]。
1.3.7 透射电子显微镜(TEM)观察 通过TEM观测Zein和Zein-Lutein纳米颗粒的形态和结构。将2 μL样品放置在具有碳膜的400目的铜格栅上,并用红外灯烘干载Zein和Zein-Lutein纳米颗粒的铜格栅,15 min后通过TEM进行观察其形态和微观结构[16]。
1.3.8 傅里叶红外光谱(FT-IR)分析 将叶黄素和Zein-Lutein纳米样品溶液在真空冷冻干燥机中进行干燥。收集干燥样品在FT-IR中压片,在4 000~500 cm-1波数范围测定红外光谱,并对不同样品的红外光谱图进行分析比较[17]。
1.3.9 数据分析 所有试验均进行3次平行试验,数据分析采用 SPSS 10.0和Excel软件进行处理。
2 结果与分析
2.1 Zein-Lutein纳米粒的制备单因素试验
2.1.1 水合时间对Zein-Lutein制备效果的影响 由图2可以看出,随着水合时间的延长,Zein与Lutein结合程度增加,导致对叶黄素包封率增大,Zein与Lutein充分水合120 min后形成的纳米粒对叶黄素的包封率达到最大,且能够均匀分散在水中形成纳米分散体系,当水合时间继续增加时,包封率趋于平稳,因此水合时间120 min时效果最佳。

图2 水合反应时间对包封率的影响Figure 2 Effects of hydrolyzed reaction time on entrapment efficiency
2.1.2 温度对Zein-Lutein制备效果的影响 由图3可以得出,随着制备温度升高Zein对Lutein包封率增大,在40~55 ℃时增加的趋势比较明显,当温度超过55 ℃时包封率变化呈下降趋势。因为Zein在加热的条件下对Lutein能够较好包埋形成纳米结构,当温度超过55 ℃时,蛋白质开始变性且容易聚集,且高温会导致叶黄素发生损失,使得对叶黄素的包封率下降,因此55 ℃为最适温度。

图3 制备温度对包封率的影响Figure 3 Effects of prepared temperature on entrapment efficiency
2.1.3 玉米蛋白与叶黄素质量比对Zein-Lutein制备效果的影响 由图4可知,随着Zein与Lutein的质量比增大,叶黄素包封率增大,质量比为15∶1时包封率达到最高,当Zein用量继续增加时,包封率不再增加,是因为过量的Zein在溶液中容易聚集,导致对Lutein包封效率略有下降,因此Zein与Lutein质量比为15∶1时效果最佳。

图4 玉米蛋白与叶黄素质量比对包封率的影响Figure 4 Effects of Zein and Lutein ratio on entrapment efficiency
2.2 正交试验
按上述方法进行正交试验,优化Zein-Lutein制备的最佳条件,正交试验设计及分析结果如表1和表2所示。

表1 正交试验设计表Table 1 The orthogonal array design

表2 正交试验结果Table 2 Orthogonal array experimental results
从表2可知,玉米醇溶蛋白对叶黄素包封率影响因素大小顺序为C(玉米醇溶蛋白与叶黄素质量比)>A(水合时间)>B(温度),最优组合为A2B1C2。将A2B1C组合进行了3次平行验证实验,得到的平均包封率为80.23%,小于正交试验A3B1C3组合中的81.0%,说明A3B1C3组合优于A2B1C2组合。因此可确定玉米醇溶蛋白与叶黄素质量比为20∶1,水合时间150 min,水合温度50 ℃条件下玉米醇溶蛋白对叶黄素的包封率最大,制备效果最佳。
2.3 Zein-Lutein粒径和电位分析
2.3.1 Zein-Lutein粒径分析 采用Nano-Zs 90粒径分析仪测得Zein和Zein-Lutein的粒径大小分布如表3所示,可以看出Zein粒径大小分布,颗粒度大小在171.0~741.9 nm范围内的比例分别为:0.4%,2.0%,5.2%,9.3%,13.5%,16.4%,17.1%,15.1%,11.1%,6.1%,2.0%。平均粒径为(482.20±8.25)nm。而Zein-Lutein颗粒度大小范围主要分布在198.0~859.2 nm范围(表4),比例分别为:1.3%,4.1%,8.1%,12.1%,15.1%,16.4%,15.5%,12.7%,8.7%,4.6%,1.5%,平均粒径为(398.3±5.42)nm。由上述粒径的测定结果可知,Zein与Zein-Lutein纳米粒粒径分布具有一致性,均在纳米级范围内,且分布比较集中和均匀(如图5所示)。Zein-Lutein颗粒大小分布变化较小,但所形成的纳米颗粒粒径略有减小,可能是Zein和叶黄素二者通过吸附和疏水部位紧密结合,减小了醇溶蛋白间的疏水性聚集作用,形成纳米颗粒后在水中分散性有所改善,因此形成的纳米粒径有所减小[18]。

表3 Zein粒径分布百分比Table 3 Percentage of particle size of Zein

表4 Zein-Lutein粒径分布百分比Table 4 Percentage of particle size of Zein-Lutein

图5 Zein和Zein-Lutein的粒径分析图Figure 5 Particle size distribution of Zein and Zein-Lutein
2.3.2 Zein-Lutein电位分析 纳米粒子电位分析可反映出包埋前后电势电位的变化。从图6可知,玉米醇溶蛋白颗粒的平均电势为(43.70±2.56)mV,而Zein-Lutein纳米粒的平均电势为(44.30±2.53)mV,电势电位略有升高,说明带有正电荷的叶黄素与Zein的结合后,所形成的纳米粒带电荷量增加,进而说明Zein与Lutein能够有效结合,形成对叶黄素的包埋作用。
2.4 透射电子显微镜(TEM)结果与分析
采用H-7650透射电子显微镜对Zein和Zein-Lutein微观结构进行分析。如图7所示,Zein呈球形颗粒状态,大小分布比较一致,由于其疏水性较强在溶解液中呈聚集态,蛋白颗粒较大。当Zein对Lutein进行包埋以后,能够形成Zein-Lutein纳米复合体结构,且粒径变小,大小分布不均匀,与Nano粒径分析仪测得结果一致。说明脂溶性叶黄素能够与疏水性玉米醇溶蛋白结合,形成对叶黄素包埋的体系,同时改善了叶黄素的溶解分散性,有效地减小了叶黄素的降解和损失[19]。

图6 Zein和Zein-Lutein的电势电位分布Figure 6 Zeta potentiometric of Zein and Zein-Lutein

图7 Zein和Zein-Lutein的透射电子显微镜图Figure 7 Transmission electron microscope (TEM) of Zein and Zein-Lutein
2.5 傅里叶红外光谱(FT-IR)解析
由图8(a)可知,叶黄素在2 957 cm-1波数处有O—H伸缩振动吸收峰,在2 920,2 848 cm-1波数处有C—H伸缩振动吸收峰,在1 715 cm-1波数处有C═C伸缩振动吸收峰,此红外光谱为叶黄素分子基团的特征吸收光谱[20]。图8(b)显示出玉米醇溶蛋白的红外特征吸收光谱:分别在3 406 cm-1波数处有O—H振动吸收峰,1 656 cm-1处有酰胺Ⅰ带—NH弯曲振动,2 920 cm-1波数处有C—H伸缩振动吸收峰,在1 115 cm-1波数处有C—O伸缩振动的红外特征吸收峰[21]。叶黄素经玉米醇溶蛋白包埋后[图8(c)],分别在2 957,2 918,2 848,1 715 cm-1波数有特征伸缩振动吸收峰,该特征光谱证明了在玉米醇溶蛋白负载的纳米粒中存在叶黄素结构。而且在3 406 cm-1波数处O—H伸缩振动,2 920 cm-1波数处C—H伸缩振动和1 115 cm-1波数处有C—O伸缩振动吸收峰分别明显增强。且在3 406 cm-1处的O—H伸缩振动峰移至3 422 cm-1处,在1 115 cm-1处的C—O伸缩振动吸收峰移至1 118 cm-1处。上述结果表明,叶黄素与玉米醇溶蛋白结合以后,并未明显改变Zein的二级结构,而是二者通过O—H键和C—O等疏水性基团相互作用结合在一起,加强了叶黄素与Zein分子间的相互作用而形成纳米结合体结构[22]。因此,叶黄素与玉米蛋白是以包埋方式结合而形成的纳米结构体系。

图8 叶黄素、Zein和Zein-Lutein的红外光谱图Figure 8 Fourier transform infrared spectroscopy (FT-IR)of Zein-Lutein
3 结论
本研究对反溶剂法制备玉米醇溶蛋白负载叶黄素纳米粒的工艺进行了探讨,并对其结构表征进行了初步解析。得到了玉米醇溶蛋白负载叶黄素纳米粒的最佳制备工艺条件为:玉米醇溶蛋白与叶黄素质量比20∶1,水合时间150 min,温度50 ℃,此条件下玉米醇溶蛋白对叶黄素的包封率最大为81.0%。通过粒径分析仪测得所制备的玉米醇溶蛋白负载叶黄素纳米粒粒径分布在198.0~859.2 nm,平均粒径为398.3 nm,平均电势为44.3 mV;TEM显示叶黄素充分被包裹在Zein内部而形成纳米球形结构,在水溶液体系中分散性提高;通过Zein载入叶黄素后的FT-IR光谱特征证明了叶黄素能够以氢键和疏水性作用嵌入Zein中形成纳米结合体,并通过包埋作用对叶黄素进行负载和保护,此纳米体系中Zein的二级结构未发生明显改变。因此,可将可食性的玉米醇溶蛋白作为有效载体制备玉米醇溶蛋白负载叶黄素自组装纳米粒,对叶黄素进行包埋和保护,可提高叶黄素的稳定性和分散性,有助于保护叶黄素的生物活性和吸收利用率[23]。
