修复剂调控铅镉污染棉田对土壤微生物多样性的影响①
2019-07-26安梦洁王开勇王海江鄂玉联孟春梅
安梦洁,王开勇,王海江,鄂玉联,孟春梅
修复剂调控铅镉污染棉田对土壤微生物多样性的影响①
安梦洁,王开勇*,王海江,鄂玉联,孟春梅
(石河子大学农学院,新疆石河子 832000)
为探讨重金属铅(Pb)、镉(Cd)污染下棉粕腐植酸和聚丙烯酸钾修复剂对土壤微生物多样性的影响,采用田间桶栽试验,进行了棉粕腐植酸、聚丙烯酸钾以及两者复合施用修复污染棉田土壤的研究,通过高通量测序分析了土壤微生物多样性的变化,并利用傅里叶红外光谱进行了土壤化学结构的修复响应分析。结果表明:与未施用修复剂处理相比,施用棉粕腐植酸和聚丙烯酸钾减少了表层土壤Pb、Cd含量,其中两者复合处理可分别减少62.6% 和52.3%;改变了土壤微环境进而影响了土壤微生物多样性,不同处理共发现土壤细菌25 个门,69个纲,149个目,273个科,442个属,其中优势菌门主要为变形菌门、酸杆菌门、芽单胞菌门和放线菌门。聚丙烯酸钾处理增加了土壤中变形菌门的相对丰度,棉粕腐植酸和复合修复处理增加了酸杆菌门和芽单胞菌门的相对丰度。由此可见,铅镉复合污染土壤中微生物多样性丰富,优势菌群相对稳定,聚丙烯酸钾和棉粕腐植酸通过改变土壤微环境进而影响菌群丰度。
铅镉污染;腐植酸;聚丙烯酸钾;高通量测序;傅里叶红外光谱
铅(Pb)、镉(Cd)在土壤中具有不可降解性、积累性和不可逆性,对人类健康和土壤生态环境安全存在着巨大风险[1-2]。新疆是全国最大的棉花生产基地,化肥施用量年增长率为11%,居全国首位,化肥用量在750 ~ 900 kg/hm2,由化肥带入的重金属含量虽然不高,但长期的累积和施肥的单一性,均会导致重金属含量超过新疆土壤表面背景值(Pb 19.4 mg/kg,Cd 0.12 mg/kg)[3],造成退化棉田土壤修复缓慢。
土壤微生物的数量和活性与土壤功能密切相关,因此常常被用作土壤修复和退化的评价指标[4-5]。同时,土壤微生物的存在还会对土壤物理化学结构产生重要的影响。有研究表明,重金属污染土壤中细菌数量发生明显改变[6],主要是因为微生物重要的代谢过程受到重金属的影响[7]。
众多环境修复剂都可以降低土壤重金属复合污染带来的影响。以往的研究主要围绕着修复剂调控下重金属复合污染土壤中重金属含量、团粒结构和养分含量[8-9]等方面开展。其中,对土壤微生物菌落特征的影响,主要研究了微生物数量。不同类群微生物对重金属敏感性不同[10-12],敏感性大小通常是放线菌>细菌>真菌[13]。
腐植酸是结构复杂的多元有机复合体,能和金属离子通过吸附、交换和络合等作用合成有机-金属络合物,吸附稳定性强,对土壤中金属离子的迁移、转化、生物活性起着重要作用[14]。聚丙烯酸盐对多种重金属具有较强和稳定的吸附能力,在外加重金属污染土壤上,可以显著降低土壤中重金属的有效性[9]。但目前环境修复剂对微生物菌落特征的影响和土壤化学响应尚不清楚。为更全面地阐述聚丙烯酸钾和棉粕腐植酸在重金属污染土壤上的修复作用,本研究进一步探讨了聚丙烯酸钾和棉粕腐植酸对重金属污染土壤微生物多样性的影响。本研究分析了铅镉污染棉田中施用聚丙烯酸钾和棉粕腐植酸修复剂后土壤Pb、Cd的含量及其分布特征,利用Illumina平台高通量测序技术分析了土壤中微生物的群落结构变化,及通过傅里叶红外光谱分析了土壤中化学结构的变化,进而探究了聚丙烯酸钾和棉粕腐植酸修复土壤重金属污染过程中微生物种群的变化特征,并结合土壤化学结构特征变化分析其修复响应,为更好地做好土壤重金属污染调控工作提供了基础数据。
1 材料与方法
1.1 研究区概况
试验在新疆石河子大学农学院实验站 ( 45°19′ N,86°3′E)进行。实验站海拔 450.8 m,年平均气温 7.5 ~ 8.2℃,日照时数 2 318 ~ 2 732 h,无霜期147 ~ 191 d,年降雨量 180 ~ 270 mm,年蒸发量 1 000 ~ 1 500 mm,属典型的温带大陆性气候。试验区土壤为灌溉灰漠土,质地为重壤,耕层土壤全氮 0.89 g/kg,有效磷20 mg/kg,速效钾250 mg/kg,碱解氮60 mg/kg,pH 8.2,有机质13.25 g/kg,Cd 0.06 mg/kg。
1.2 试验设计
试验为桶栽试验,供试作物为棉花“新陆早60”。通过室内试验筛选Cd、Pb污染浓度,桶栽试验设置人为添加超过国家《农用地土壤环境质量标准GB 15618—2016》中耕地pH>7.5含量限值(Cd 0.6 mg/kg,Pb 200 mg/kg)3倍量的重金属Cd、Pb(试验后的污染土壤进行长期监测)。修复材料为棉粕腐植酸(自主研发:总腐植酸35 g/L)和聚丙烯酸钾。采用完全随机区组试验设计,设置4个处理(表1),每处理重复3次。
试验过程中,原状土按土层装于塑料桶(长× 宽×高= 2 m × 2 m × 80 cm)中,并埋回实验站大田,保持大田群体效应。选用氯化镉和乙酸铅,按照0 ~ 30 cm土层计算,以溶液的形式加入供试土壤中,充分混匀后一次性浇灌农田灌溉水保持土壤湿润。于2016年5月初播种,出苗后定苗;6月14日第一次灌水,灌水周期为10 d。全生育期共灌水9次,修复材料(棉粕腐植酸和聚丙烯酸钾)每次随水施入,2016年9月底收获。全生育期施尿素345 kg/hm2、复合肥(17-17- 17)555 kg/hm2、聚丙烯酸钾4.8 kg/hm2、棉粕腐植酸150 kg/hm2。

表1 试验设置
1.3 取样与测定
1.3.1 取样 在棉花各生育时期(苗期、蕾期、花期、铃期、吐絮期)采集0 ~ 20、20 ~ 40 cm土样,每个小区采3点混合并用“四分法”缩分获得1个土样。土样自然风干后过 2 mm 筛,放入塑料袋中保存备用测定Pb、Cd含量。吐絮期的一部分土样在4℃下运输1 h,过2 mm筛进行彻底均匀化并从样品中除去根和植物碎屑,储存在–80℃以备DNA提取,一部分土样常温储存用于傅里叶红外光谱(FTIR)分析。
1.3.2 土壤微生物总DNA提取 土壤总DNA基因组采用DNA提取试剂盒进行提取,使用琼脂糖凝胶电泳对 DNA 的浓度和质量进行检验。所有样品基因组 DNA 提取和 16S rDNA 扩增与测序工作委托北京百迈客生物科技有限公司完成。
1.3.3 高通量测序 高通量测序采用通用引物 (338F/806R) 对土壤细菌 16S rRNA 基因的 V3 ~ V4 区扩增,修饰后的通用引物含有不同的 Tag 标签用以区分不同样品[15]。根据PE reads之间的重叠关系,将Hiseq测序得到的双端序列数据拼接成一条序列Tags,同时对Reads的质量和拼接的效果进行质控过滤。
1.3.4 微生物多样性指数计算
Shannon-Wiener指数计算公式为:
'=-∑P(lnP) (1)
Simpson指数计算公式为:
= 1-ΣP2(2)
式中:P指种的个体数占群落中总个体数的比例。
ACE 指数计算公式为:

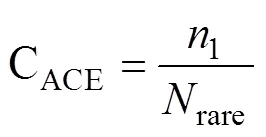

式中:n表示含有条序列的 OTU 数目;rare表示含有“abund”条序列或者少于“abund”的 OTU 数目;abund表示多于“abund”条序列的 OTU 数目;“abund”为“优势”OTU 的阈值,本研究取值 10。
Chao1 指数计算公式为:
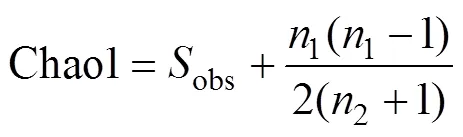
式中:chao1表示估计的 OTU 数;obs表示实际 OTU 数;1表示只有 1 条序列的 OTU 数目;2表示只有 2 条序列的 OTU 数目。
1.3.5 土壤重金属含量的测定 土壤通过微波消解后采用石墨炉原子吸收分光光度法进行总Cd和总Pb测定(GB/T 17141—1997)。实验仪器为PinAAcle 900H 原子吸收光谱仪 (PHDS15010901)。
1.3.6 FTIR测试 红外光谱分析采用BRUKER EQUINOX55型红外光谱仪,分束片KBr,分辨率4 cm–1。
1.4 数据处理
数据处理和绘图用 Microsoft Excel 2016软件进行。方差分析和主成分分析采用SPSS 16.0 统计分析软件进行。比较不同处理间差异采用单因素方差分析。
2 结果与分析
2.1 修复剂对土壤重金属含量的影响
图1为棉花各生育时期不同土层土壤中Cd的含量。从图1中可以看出,各处理在20 ~ 40 cm土层中的Cd含量普遍低于0 ~ 20 cm土层,且在吐絮期修复效果最好。在0 ~ 20 cm土层,与T2处理相比,棉花苗期T6和T8处理Cd含量减少了41.2% 和39.2%,蕾期减少了37.5% 和45.0%,花铃期减少了58.2% 和62.6%,吐絮期减少了56.8% 和61.6%;在20 ~ 40 cm土层,T4、T6和T8处理土壤Cd含量部分高于T2处理,说明修复材料的施入增加了重金属Cd向土壤下层迁移的能力。
图2为各生育时期不同土层土壤中Pb的含量。各处理在0 ~ 20 cm土层和20 ~ 40 cm土层中的Pb含量变化趋势与Cd含量大体一致。在0 ~ 20 cm土层,T4、T6、T8处理各生育时期中Pb含量均低于T2处理,其中T8处理降低幅度最大,较T2处理在各生育期分别降低了54.0%、52.3%、19.2% 和45.3%;在20 ~ 40 cm土层,T4、T6、T8处理中土壤Pb含量大部分高于T2处理,且增加幅度大于Cd含量,说明修复材料促进重金属Pb迁移的能力大于Cd。
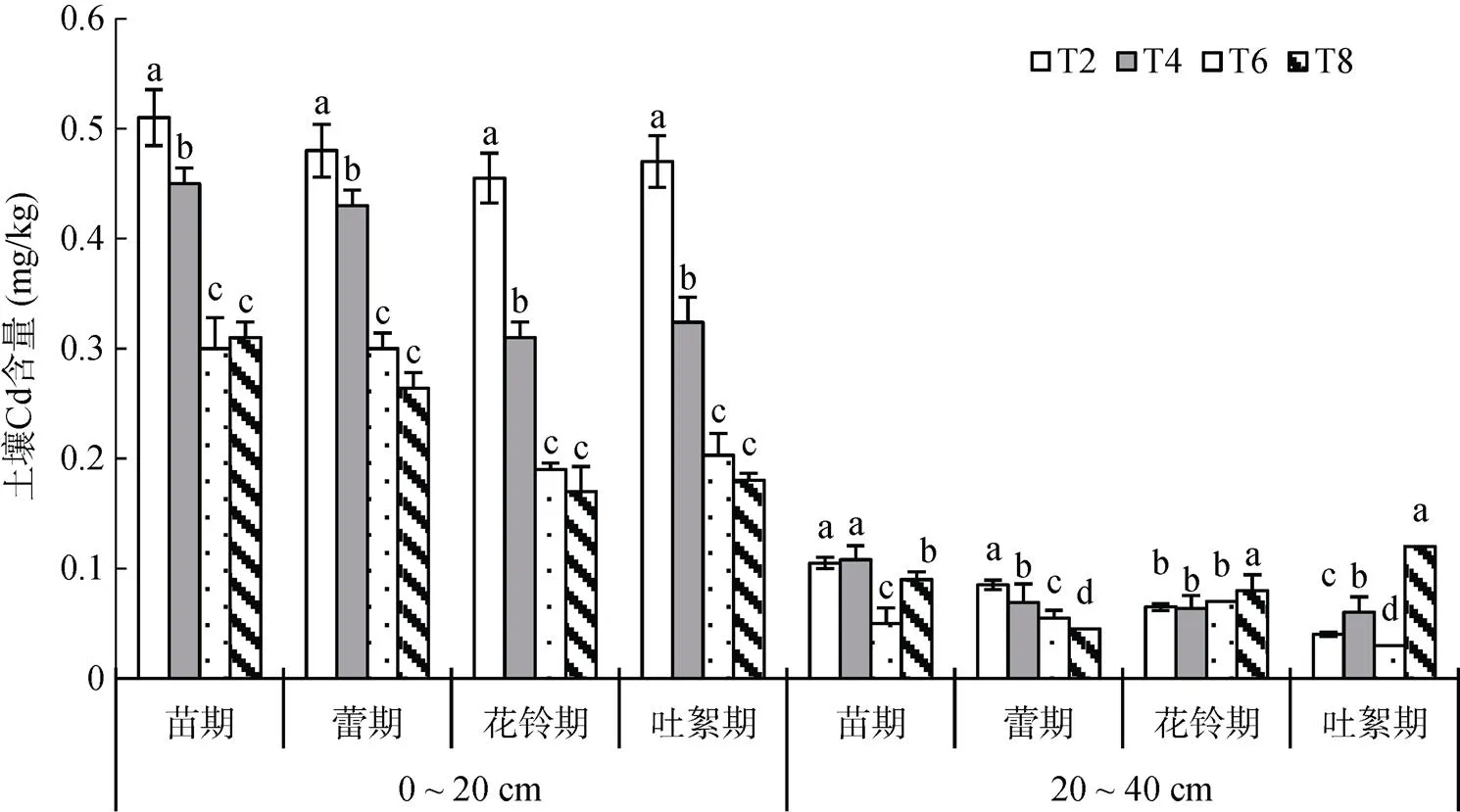
(图中小写字母表示同一土层同一时期不同处理间差异显著(P<0.05),下同)
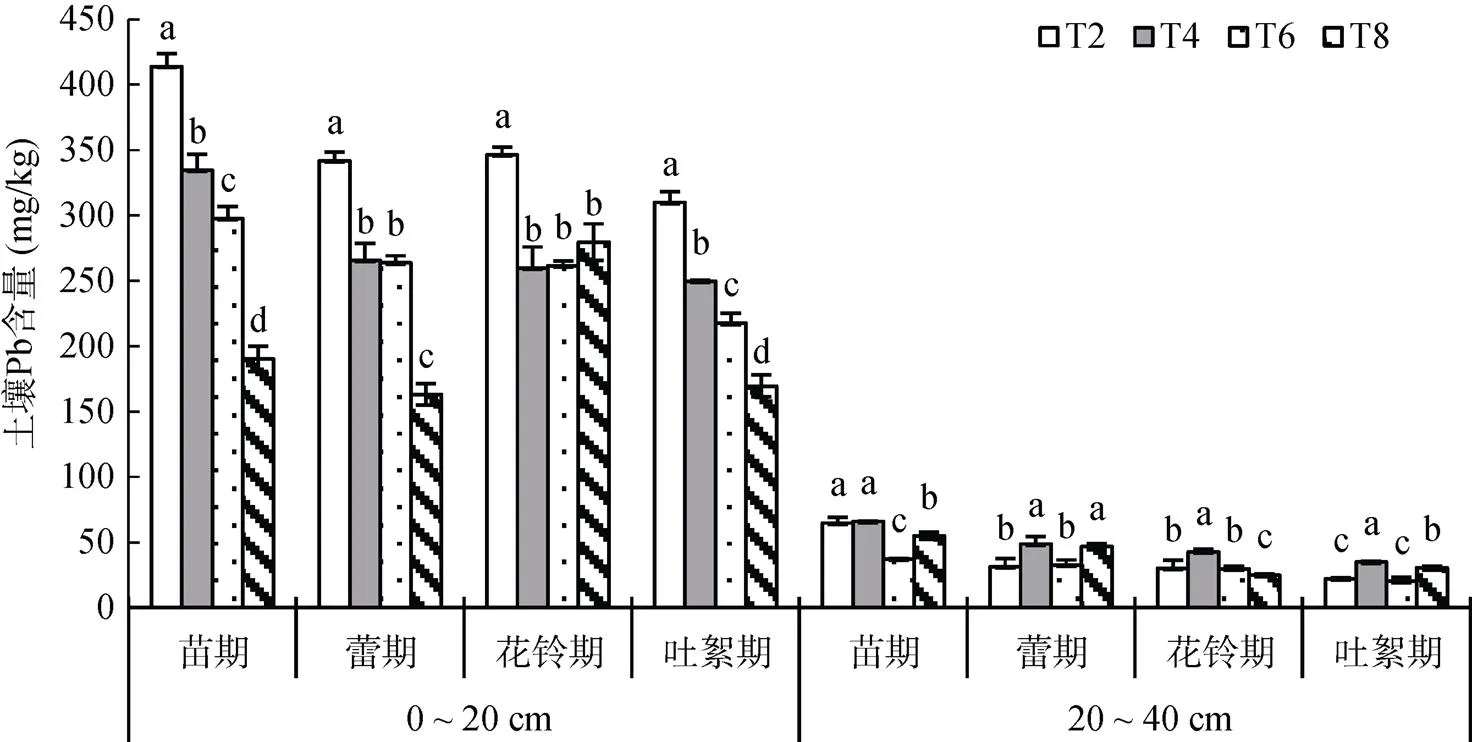
图2 棉花各生育时期不同土层土壤中Pb的含量
2.2 修复剂与重金属污染土壤混合物的红外光谱
利用红外光谱可以推断和半定量测定分子的官能团特征,进一步验证有机化合物的结构组成。图 3显示,各处理下土壤的混合物红外光谱曲线具有大致相似的特征,只在某些特征峰的吸收强度上有一定的差异(表2)。从图3可以看出,各处理在3 000 cm–1以上有吸收峰,说明表面有不饱和基团的存在。与T2处理相比,T4、T6、T8处理在2 920 cm–1和2 850 cm–1附近的波谷消失,2 920 cm–1附近的波谷为亚甲基(CH2)的碳氢(C-H)反对称伸缩振动谷,2 850 cm–1附近吸收峰为CH2的C-H对称伸缩振动[16]。1 620 ~ 1 650 cm–1处是缔合态伯酰胺面内弯曲振动(δN-H)的吸收带,其中1 634 cm–1左右的峰值为酰胺化合物的吸收Ⅰ带(包括-CONH-中的C-O伸缩振动)[17]。1 402 ~ 1 440cm–1处是羧酸根离子(COO-)的特征吸收峰,是由于羧酸中C-O伸缩振动引起的;在1 032 cm–1附近为酯类-C-O-C-、CH、C-C、C-O多糖键的伸缩振动吸收带[18]。693 cm–1附近的吸收峰与羟基的弯曲变形振动有关;521 cm–1附近的吸收峰表现为Si-O-Mg、Si-O-Al键的弯曲振动[19];467 cm–1附近的吸峰表现为Si-O-Si的弯曲振动[20]。
由表2可见,在2 920、2 850、1634、1433、1 032 cm–1处,土壤混合物吸收峰的吸光度在施用修复材料处理下较高,重金属处理下降低,其中T4处理的吸光度最高,因此这些峰也可作为鉴定重金属污染土壤的标志之一。
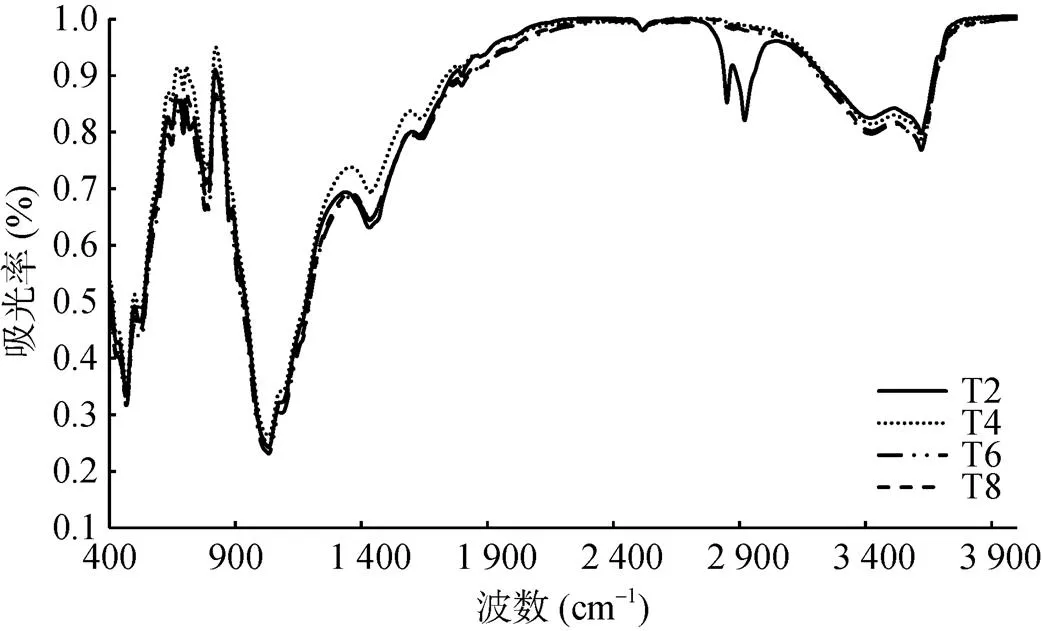
图3 修复材料与重金属污染土壤的混合物FTIR测试结果
2.3 修复剂对重金属污染土壤微生物多样性的影响
2.3.1 土壤微生物复杂度 Alpha 多样性表示的是对单个处理土壤微生物多样性进行分析。表 3显示,各处理土壤微生物群落多样性变化规律不明显,各处理间群落丰富度无明显差异,无法结合多样性指数对群落多样性进行准确分析。
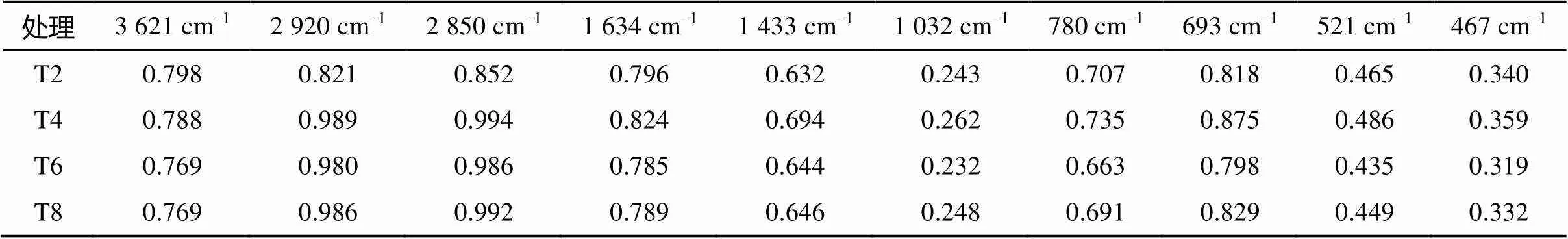
表2 不同处理修复材料与重金属污染土壤混合物红外光谱主要吸收峰的相对强度(半定量)
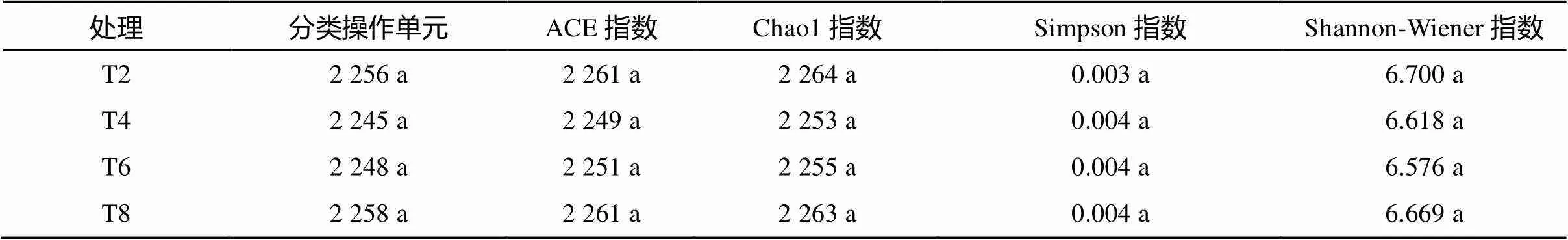
表 3 不同处理土壤微生物多样性指数统计表
注:表中同列小写字母不同表示不同处理间差异显著 (<0.05),下表同。
2.3.2 土壤细菌群落组成 土壤细菌种类繁多, 数量最多,多样性特征较为明显。图4分别为本研究4个处理在门、纲、目、科、属水平上的相对丰度直观展示图。在门和纲水平上的优势种是变形菌门(纲)(Proteobacteria)、酸杆菌门(纲)(Acidobacteria)和芽单胞菌门(纲)(Gemmatimonadetes),目和科水平上优势种是芽单胞菌目(科)(Gemmatimonadales)和鞘氨醇单胞菌目(科)(Sphingomonadaceae),其中鞘氨醇单胞菌目(科)属于变形菌门(Proteobacteria)[21]。
在门水平上,T2、T4、T6、T8处理中物种相对丰度不同,T2处理中拟杆菌门(Bacteroidetes)、芽单胞菌门、变形菌门相对丰度较T4、T6、T8处理低,绿弯菌门(Chloroflexi)和放线菌门(Actinobacteria)相对丰度较T4、T6、T8处理高。在纲水平上,与T4、T6、T8处理相比,T2处理α-变形菌纲(Alphaproteobacteria)和β-变形菌纲(Betaproteobacteria)相对丰度较低,δ-变形菌纲(Deltaproteobacteria)相对丰度较高。在目水平上,与T4、T6、T8处理相比,T2处理鞘脂单胞菌目相对丰度较低。在科水平上,与T4、T6、T8处理相比,T2处理芽单胞菌科和鞘脂单胞菌科相对丰度比例较低。在属水平上,T2、T4、T6、T8处理鞘氨醇单胞菌属()相对丰度分别为4.30%、5.29%、6.34%、5.60%,菌属相对丰度分别为1.56%、1.59%、1.45%、1.59%。
Fig. 4 Changes in relative abundance of bacterial under different treatments
2.3.3 土壤微生物物种丰度聚类热图 如图5所示,基于OTU 结果用不同颜色变化来表示分类信息和处理间差异。图左侧的聚类树为物种聚类树;上方的聚类树为处理聚类树;中间热图对应的值为每一行物种相对丰度经过标准化处理后得到的值(值越高颜色越接近红色,值低则接近蓝色)。由图5可以看出,不同处理间差异较大,T2处理中含量较高的门包括放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、绿弯菌门(Chloroflexi)和硬壁菌门(Firmicutes),T4处理中含量较高的门包括BRC1、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和广古菌门(Euryarchaeota),T6处理中含量较高的门包括绿细菌门(Chlorobi)、TM7和WCHB1-60,T8处理中含量较高的门包括硝化螺旋菌门(Nitrospirae)、WS6、浮霉菌门(Planctomycetes)、纤维杆菌门(Fibrobacteres)和TM6。从图5中还可以看出,T4和T8处理的相似性较近,聚为一类;T2处理位于较远的聚类分支上,且T2处理与其他组在颜色分布上相差较大。
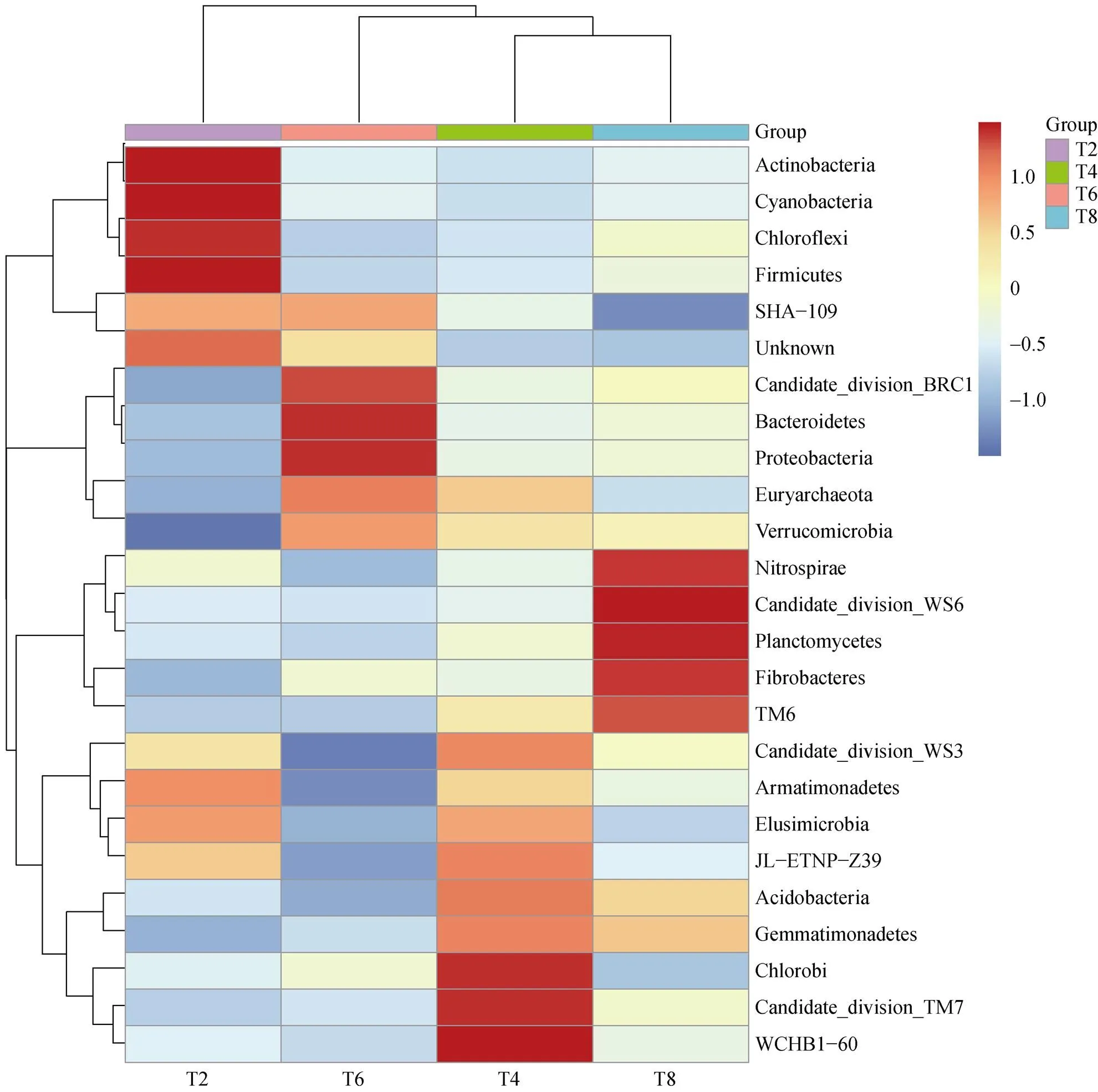
图5 各处理门水平丰度聚类热图
3 讨论
Pb、Cd的迁移能力较弱,试验表明修复剂的施用降低Cd含量的效果优于Pb含量,即Pb的迁移能力强于Cd,并且土壤0 ~ 20 cm土层的修复效果明显优于20 ~ 40 cm土层。在碱性土壤环境下,聚丙烯酸盐带有阴性电荷,有很好的保水性、吸水性,还有很强的吸附能力,自身所带羧基等强亲水基团,对水分子和重金属离子同时具有很强的吸附、络合能力[9]。腐植酸中的羟基、羧基功能团能与土壤中的金属阳离子发生结合反应,提高土壤保水能力,具有改良土壤效果[22]。在本研究中自主研发的棉粕腐植酸使铅镉复合污染土壤中羧酸、酯类多糖、酰胺化合物等增加,降低了土壤Pb、Cd含量,减轻了其环境的毒害作用。
本研究在铅镉复合污染土壤中施加聚丙烯酸钾和棉粕腐植酸,能改变土壤微生物种群结构和土壤Pb、Cd含量,这与前人的研究相同[23-24]。为探讨棉粕腐植酸和聚丙烯酸钾对土壤微生物多样性的影响,本研究利用高通量测序,对4个处理细菌群落在门、纲、目、科、属分类层次上的分布特征分析显示,4个处理拥有共同的常见绝对优势菌群,而相对比例较低的细菌群落多样性各不相同,有显著的差别。本研究中细菌菌群的这种多样性分布特点,论证了一种经典物种多度分布模式,即物种在地球上的分布并非是均匀的,几乎所有的群落都呈现出大量的稀有种和少数常见种[25-26]。不同处理共发现25 个门,69个纲,149个目,273个科,442个属,其中优势菌门主要为变形菌门、酸杆菌门、芽单胞菌门和放线菌门。聚丙烯酸钾和棉粕腐植酸能影响这些细菌的相对丰度。在25个门的细菌中,与不加修复材料的铅镉复合土壤相比,棉粕腐植酸提高了16个门细菌丰度,聚丙烯酸钾提高了11个门细菌丰度,修复材料复合施用提高了14个门细菌丰度。在优势菌门中,聚丙烯酸钾提高了变形菌门相对丰度,棉粕腐植酸的酸杆菌门和芽单胞菌门相对丰度较高。
FTIR测试分析和高通量测序表明环境修复剂的施用改变了土壤微环境,土壤微环境和土壤微生物之间互相影响互相制约。其中2 850 cm–1和2 920 cm–1处吸收峰的光谱值和Simpson指数呈极显著正相关(<0.01),说明修复剂增加了细菌群落均匀度。有研究表明,在水稻田中变形菌门(Proteobacteria)中的微生物耐重金属[6],而在本研究中发现棉田绿弯菌门(Chloroflexi)和放线菌门(Actinobacteria)中的微生物对Cd较不敏感。放线菌门是一种没有细胞核的原核生物,能促使土壤中的动物和植物遗骸腐烂,绿弯菌门是兼性厌氧生物,在光合作用中不产生氧气,不能固氮。FTIR分析和高通量测序表明,碳氢键的形成为绿弯菌门(Chloroflexi)和放线菌门(Actinobacteria)提供了良好的环境,有利于提高其丰度。而修复材料的施用降低了土壤Pb、Cd的有效性,破坏了碳氢键,进而减少了绿弯菌门和放线菌门的丰度。与此同时,T4和T8处理使土壤中羧酸、酯类多糖、酰胺化合物等增加,增加了酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)的丰度,它们在生态系统中具有重要作用。T6处理增加了变形菌门(Proteobacteria)丰度,变形菌门可以利用光合作用储存能量,具有固氮功能。总之,棉粕腐植酸和聚丙烯酸钾的添加改善了土壤重金属含量及土壤化学结构,提供了微生物生命活动和繁殖所需的环境条件。
4 结论
1)在Pb、Cd复合污染的土壤中,2 920 cm–1和2 850 cm–1处波谷表明土壤表面与金属离子相互作用形成碳氢键,聚丙烯酸钾和棉粕腐植酸能有效降低土壤表层Pb、Cd含量,其中对Cd的最大减少量有62.6%,Pb、Cd向下的迁移能力提高。
2)在碱性Pb、Cd污染土壤条件下,细菌的丰度总体较高,施用修复剂使微生物多样性存在一定差异,即少数的常见菌群相对比例较高。不施用修复剂时放线菌门丰度较高,平均含量达到19.10%;聚丙烯酸钾修复剂增加了变形菌门丰度,平均比例高达 39.89%;棉粕腐植酸增加了酸杆菌门和芽单胞菌门丰度,平均比例分别高达19.76% 和15.30%。修复剂通过碳氢键机理影响土壤微环境进而改变了土壤微生物均匀度。
[1] 黄银华, 李铖, 李芳柏, 等. 广州市农业表层土壤镉和铅多尺度空间结构[J]. 土壤, 2015(6): 1144–1150
[2] 宋金茜, 朱权, 姜小三, 等. 基于GIS的农业土壤重金属风险评价研究—— 以南京市八卦洲为例[J]. 土壤学报, 2017, 54(1): 81–91
[3] 中国国家环境保护局. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社, 1990: 330–482
[4] Elzobair K A, Stromberger M E, Ippolito J A, et al. Contrasting effects of biochar versus manure on soil microbial communities and enzyme activities in an Aridisol[J]. Chemosphere, 2015, 142:145–152
[5] Gołębiewski M, Dejasikora E, Cichosz M, et al. 16S rDNA pyrosequencing analysis of bacterial community in heavy metals polluted soils[J]. Microbial Ecology, 2014, 67(3): 635–647
[6] He H D, Li W C, Yu R Q, et al. Illumina-based analysis of bulk and rhizosphere soil bacterial communities in paddy fields under mixed heavy metal contamination[J]. Pedosphere, 2017, 27(3): 569–578
[7] 钟松雄, 何宏飞, 陈志良, 等. 水淹条件下水稻土中砷的生物化学行为研究进展[J]. 土壤学报, 2018, 55(1): 1– 17
[8] 武成辉, 李亮, 雷畅, 等. 硅酸盐钝化剂在土壤重金属污染修复中的研究与应用[J]. 土壤, 2017, 49(3): 446–452
[9] 曲贵伟. 聚丙烯酸盐对重金属污染修复作用的研究[D]. 沈阳: 沈阳农业大学, 2011
[10] Xu X, Zhou Z, Hu S, et al. Response of soil bacterial communities to lead and zinc pollution revealed by Illumina MiSeq sequencing investigation[J]. Environmental Science & Pollution Research International, 2017, 24(1): 666
[11] Haller L, Tonolla M, Zopfi J, et al. Composition of bacterial and archaeal communities in freshwater sediments with different contamination levels (Lake Geneva, Switzerland)[J]. Water Research, 2011, 45(3):1213–1228
[12] Brito E M S, Barrón M D L C, Caretta C A, et al. Impact of hydrocarbons, PCBs and heavy metals on bacterial communities in Lerma River, Salamanca, Mexico: Investigation of hydrocarbon degradation potential[J]. Science of the Total Environment, 2015, 521/522: 1–10
[13] 孙铁珩, 周启星, 李培军. 污染生态学[M]. 北京: 科学出版社, 2001
[14] 蒋煜峰, 袁建梅, 卢子扬, 等. 腐殖酸对污灌土壤中Cu、Cd、Pb、Zn形态影响的研究[J]. 西北师范大学学报(自然科学版), 2005, 41(6): 42–46
[15] Li A J, Hou B L, Li M X. Cell adhesion, ammonia removal and granulation of autotrophic nitrifying sludge facilitated by N-acyl-homoserine lactones[J]. Bioresource Technology, 2015, 196: 550–558
[16] 宁永成. 有机化合物结构鉴定与有机波谱学(第二版)[M]. 北京: 科学出版社, 2000
[17] 洪庆红, 李丹婷, 郝朝运. 应用FTIR直接测定法鉴定大豆的品种[J]. 光谱学与光谱分析, 2005, 25(8): 1246–1249
[18] 宁永成. 有机波谱学谱图解析[M]. 北京: 科学出版社, 2010
[19] 王玉, 张一平, 陈思根. 中国6种地带性土壤红外光谱特征研究[J]. 西北农林科技大学学报:自然科学版, 2003, 31(1): 57–61
[20] 吴瑾光. 近代傅里叶变换红外光谱技术及应用[M]. 北京: 科学技术文献出版社, 1994
[21] 胡杰, 何晓红, 李大平, 等. 鞘氨醇单胞菌研究进展[J]. 应用与环境生物学报, 2007, 13(3): 431–437
[22] 曾宪成, 马献发, 李伟彤, 等. 简述腐植酸在土壤重金属污染修复中的作用[J]. 腐植酸, 2016(6): 3–8
[23] 李丽君, 张强, 白光洁, 等. 改良剂与油菜对土壤重金属有效态的影响[J]. 水土保持学报, 2014, 28(1): 246–252
[24] 曲贵伟, Amarilis de Varennes, 依艳丽. 聚丙烯酸盐对长期重金属污染的矿区土壤的修复研究(II)——对土壤微生物数量和土壤酶活性的影响[J]. 农业环境科学学报, 2009, 28(4): 653–657
[25] Magurran A E, Magurran A E. Measuring biological diversity[J]. Journal of the Limnological Society of Southern Africa, 2004, 29(2): 285–286
[26] Mcgill B J, Etienne R S, Gray J S, et al. Species abundance distributions: Moving beyond single prediction theories to integration within an ecological framework[J]. Ecology Letters, 2007, 10(10): 995–1015
Effects of Remediation on Microbial Diversity of Soil Polluted by Pb and Cd
AN Mengjie, WANG Kaiyong*, WANG Haijiang, E Yulian, MENG Chunmei
(Agricultural College of Shihezi University, Shihezi, Xinjiang 823000, China)
A tub experiment was conductedto investigate the effects of humic acid and potassium polyacrylate on soil biological diversity under heavy metal lead (Pb) and cadmium (Cd) pollution, in which 600 mg/kg of Pb and 1.8 mg/kg of Cd were added into all tubs (T2), then 10 g/kg of cottonseed meal humic acid (T4), 2 g/kg of polyacrylic acid potassium (T6), the combination of T4 and T6 (T8) were added into the tubs, respectively. Soil microbial biodiversity was analyzed by high-throughput sequencing and the remediation response was studied by Fourier transform infrared spectrum. The results showed that the contents of Cd and Pb in the topsoil were reduced in the treatments of T4, T6 and T8, the maximum reduction occurred in T8, which were 62.6 % for Cd and 52.3% for Pb, respectively, thus, it changed soil micro-environment and thus affected soil microorganisms. The bacteria in the four treatments covered 25 phyla, 69 classes, 149 orders, 273 families and 442 genera, and Proteobacteria, Acidobacteria, Gemmatimonadetes and Actinobacteria were the dominant bacteria. T6 increased the total number of Proteobacteria, while T4 and T8 increased Acidobacteria and Gemmatimonadetes. It can be concluded that the microbial diversity was very rich and the dominant bacterial community was relatively stable in Cd and Pb polluted soil. Potassium polyacrylate and cottonseed meal humic acid affected composition abundance of bacterial flora by changing soil microenvironment.
Lead and cadmium pollution; Humic acid; Potassium polyacrylate; High-throughput sequencing; Fourier transform infrared spectrum
国家国际科技合作专项(2015DFA11660)、国家科技支撑计划项目(2014BAC14B030-2)、国家重点研发计划项目(2016YFC 0501406)、国家自然科学基金项目(31560169)和石河子大学国际科技合作项目(GJHZ201802)资助。
(wky20@163.com)
安梦洁(1993—),女,新疆乌鲁木齐人,硕士研究生,主要从事土壤环境与生态研究。E-mail: 1505744711@qq.com
X53
A
10.13758/j.cnki.tr.2019.03.018
