鹿红方对氧糖剥夺模型心脏干细胞自噬和抗凋亡能力的影响
2019-07-26
心脏干细胞(cardiac stem cells,CSCs)移植治疗缺血性心肌病具有广阔的应用前景,但移植细胞的高凋亡率是影响干细胞疗法疗效的重要原因。如何提高干细胞在缺血、缺氧环境的生存率成为目前研究的热点。干细胞领域相关研究显示,在多种应激状态下,适当自噬可提高干细胞抗凋亡能力[1-3]。多种化学物质通过改善应激状态下干细胞自噬,可提高细胞抗凋亡能力[4]。本研究探讨中药复方鹿红方(LHF)对氧糖剥夺模型CSCs自噬和CSCs抗凋亡能力的影响。
1 材料与方法
1.1 实验材料
1.1.1 CSCs及实验药物 CSCs购自Lonza公司;鹿红方由上海中医药大学附属曙光医院制剂室提供,由鹿角片、红花、仙灵脾、补骨脂、女贞子、山萸肉、沉香按15∶9∶30∶20∶15∶30∶6 比例配制。鹿红方水提物制备方法如下:将药材置不锈钢锅中,加适量水浸泡1 h,置于电磁炉上,先用大火煮沸后,再用小火保持微沸煎煮1 h,18层纱布过滤,滤液备用;另外再加适量水同法再煎煮1次,18层纱布滤过,合并两次药液,于60 ℃旋转蒸发仪减压浓缩至干,在60 ℃真空干燥,干膏称重,再碾为均匀细粉,备用。
1.1.2 主要实验试剂 DMEM/F12培养基、IMDM培养基、胎牛血清、无血清培养基均购自美国GIBCO公司;细胞计数试剂盒(cell counting kit-8,CCK-8)试剂盒购自上海易色公司;自噬抑制剂3-MA购自美国Sigma公司;GAPDH抗体购自天津三箭公司;Beclin-1、LC3-Ⅱ兔抗购自英国Abcam公司。
1.1.3 主要实验仪器 三气培养箱购自日本松下公司;水浴恒温摇床购自上海汉诺公司;CO2细胞培养箱购自美国Thermo公司;超净台,购自美国BioX公司;多功能酶标仪T0-3型购自瑞士Tecan公司;-80 ℃冰箱购自日本Sanyo公司。
1.2 CSCs氧糖剥夺模型制备 氧糖剥夺模型制备参考Wohnsland 等[5]报道方法并加以改进,简述如下:取1 mL冻存CSCs(1~10)×107,常规复苏后转移至无血清培养基,并置于37 ℃三气培养箱中,设置气体比例:N2∶CO2为95%∶5%。将此混合气体以流速10 L/min通过三气培养箱,至测氧仪检测箱中氧气体积分数为3%时停止通气。氧糖剥夺持续时间为1.5 h。

1.4 实验分组及干预方式 将CSCs随机分为对照组(正常培养)与氧糖剥夺造模组(缺血缺氧)。将造模组分为模型组(不予有效干预措施)、3-MA组(给予自噬阻断剂)、LHF200组(给予LHF 200 μg/mL)和LHF200+3-MA组(给予LHF 200 μg/mL+自噬阻断剂)。3-MA为自噬抑制剂,用于阻断自噬过程。各组干预方式见表1。

表1 实验分组及造模和干预方式
1.5 检测指标及方法
1.5.1 光镜及CCK-8法检测CSCs活细胞数量 首先光镜下观察各组CSCs形态,之后将待测CSCs细胞悬液接种于96孔培养板中(104细胞/孔)。加入CCK-8试剂10 μL,混匀后37 ℃,5%CO2培养箱孵育1.5 h,测定450 nm处OD值。酶标仪读取待测样品和空白参照在450 nm处OD值。将各待测样本OD值记为测量值,空白参照OD值作为空白值,终值=测量值-空白值;通过判定OD值反映活细胞数量。
1.5.2 Western Blot检测CSCs自噬相关蛋白的表达 采用Western blot法测定各组CSCs表达自噬相关蛋白Beclin-1、LC3-Ⅱ水平,测定方法按照相关研究[7]进行,具体如下:蛋白用SDS-PAGE提取分离,然后转膜至聚乙烯二氟膜上。孵育一抗,稀释比如下:Beclin-2 1∶1 000;LC3-Ⅱ为 1∶100;过夜,室温下孵育二抗1 h。最后采用灰度值半定量法分析蛋白表达量。
1.5.3 RT-PCR检测CSCs自噬相关蛋白基因的表达 应用RT-PCR法检测Beclin-1及LC3-Ⅱ基因表达。操作根据说明书进行,按照相关研究[7]进行,具体如下:应用TRIzol法提取总RNA。用TRIzol RNA提取剂(Invitrogen)提取核酸蛋白复核物,核酸蛋白复合物经氯仿抽取、异丙醇中沉淀,75%乙醇清洗及RNase-free水中纯化后离心。将GAPDH表达水平作为内控,以iScript cDNA Synthesis Kit (Bio-Rad Laboratories,Hercules,Calif)反转录总RNA。用XX amplification;根据目的基因序列信息设计并合成PCR检测引物,序列见下表2。PCR条件如下:预变性95 ℃ 2 min,1个循环,60 ℃下退火20 s,之后72 ℃下延伸20 s,样本共进行40次循环,SYBR Green法荧光定量PCR分析各基因表达,最后使用2-△△Ct法进行各基因表达的相对定量。

表2 RT-PCR检测引物序列

2 结 果
2.1 光镜下各组CSCs形态观察 正常组可见细胞数目较多,形态呈较规则梭形,悬浮细胞少;模型组可见细胞数量较少,大部分细胞皱缩,悬浮细胞较多,提示大量细胞凋亡坏死;3-MA组与模型组接近;LHF200组与模型组及3-MA组比较,细胞密度上升,形态相对稳定,皱缩细胞少,悬浮的凋亡细胞数较少,提示凋亡细胞减少;LHF200+3-MA组可见细胞凋亡较LHF200组增加。详见图1。

1为正常组;2为模型组;3为3-MA组;4为LHF200组;5为LHF200+3-MA组
2.2 CCK-8检测各组CSCs活细胞OD值 对照组与各造模组CSCs活细胞OD值比较,差异有统计学意义(P<0.001),各造模组CSCs活细胞OD值显著降低,表明在氧糖剥夺模型下,细胞发生大量凋亡; LH200F组和模型组比较,CSCs活细胞OD值显著增高,差异有统计学意义(P<0.001),提示鹿红方可减少缺血缺氧状态下CSCs凋亡;LHF200+3-MA组与LHF200组比较,CSCs活细胞OD值下降,差异有统计学意义(P=0.03)。详见表3。

表3 CCK-8检测各组CSCs活细胞OD值(±s)
与对照组比较,1)P<0.001;与模型组比较,2)P<
0.01;与LHF 200组比较,3)P<0.05
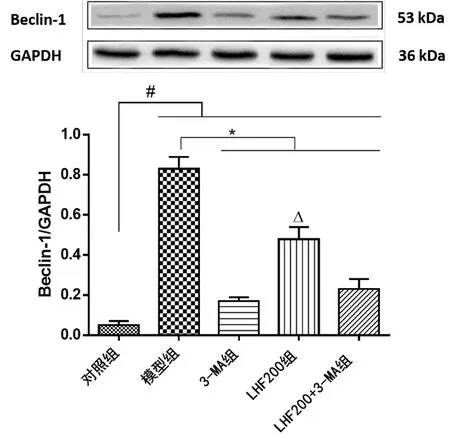
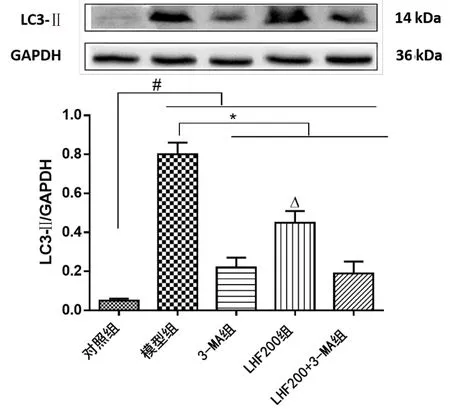
2.3 Western Blot蛋白检测 模型组与对照组比较,Beclin-1和LC3-Ⅱ蛋白表达显著升高(P<0.001),表明氧糖剥夺模型可促进CSCs自噬关键蛋白Beclin-1和LC3-Ⅱ表达;3-MA组与模型组比较,Beclin-1和LC3-Ⅱ表达显著降低(P<0.001);LHF200组Beclin-1和LC3-Ⅱ蛋白表达与模型组比较显著降低(P<0.001),显著高于3-MA组和LHF200+3-MA组(P<0.001)。详见图2、图3。
与对照组比较,#P<0.001;与模型组比较,*P<0.001;与3-MA组比较,△P<0.001
图2各组Beclin-1蛋白表达比较
与对照组比较,#P<0.001;与模型组比较,*P<0.001;与3-MA组比较,△P<0.001
图3各组LC3-Ⅱ蛋白表达比较
2.4 RT-PCR基因表达检测 与对照组比较,模型组Beclin-1 mRNA和LC3-Ⅱ mRNA表达显著升高(P<0.001),表明氧糖剥夺模型可促进CSCs自噬的发生,这与Western Blot检测蛋白表达结果一致;与模型组比较,3-MA组Beclin-1 mRNA和LC3-Ⅱ mRNA表达显著降低(P<0.001),提示3-MA可阻断自噬;LHF200组与模型组比较,Beclin-1 mRNA和LC3-Ⅱ mRNA表达显著降低(P<0.001),提示LHF可调节CSCs缺血、缺氧应激条件下自噬,防止过度自噬,这与Western Blot检测蛋白表达结果一致。详见图4、图5。
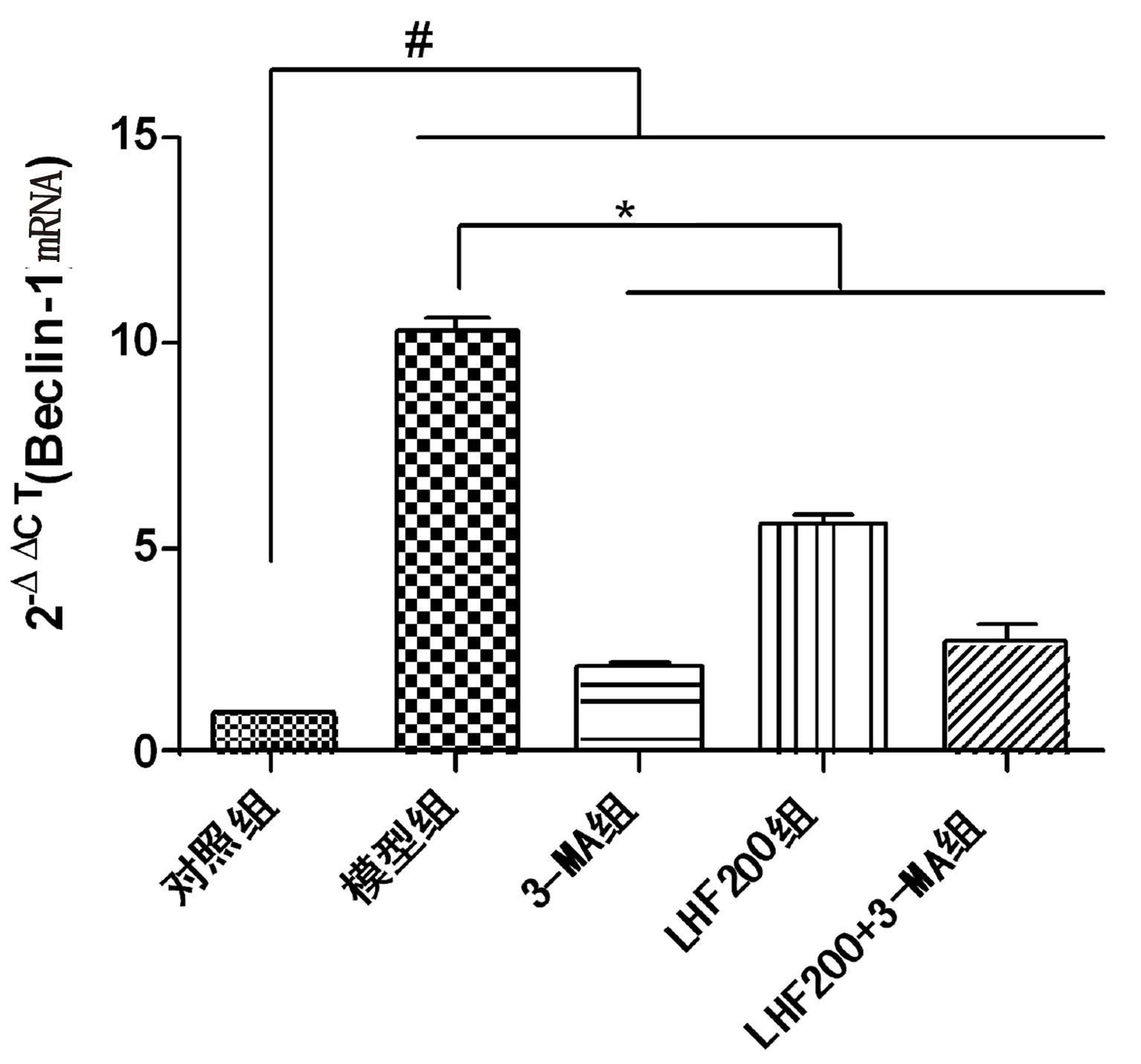
与对照组比较,#P<0.001;与模型组比较,*P<0.001
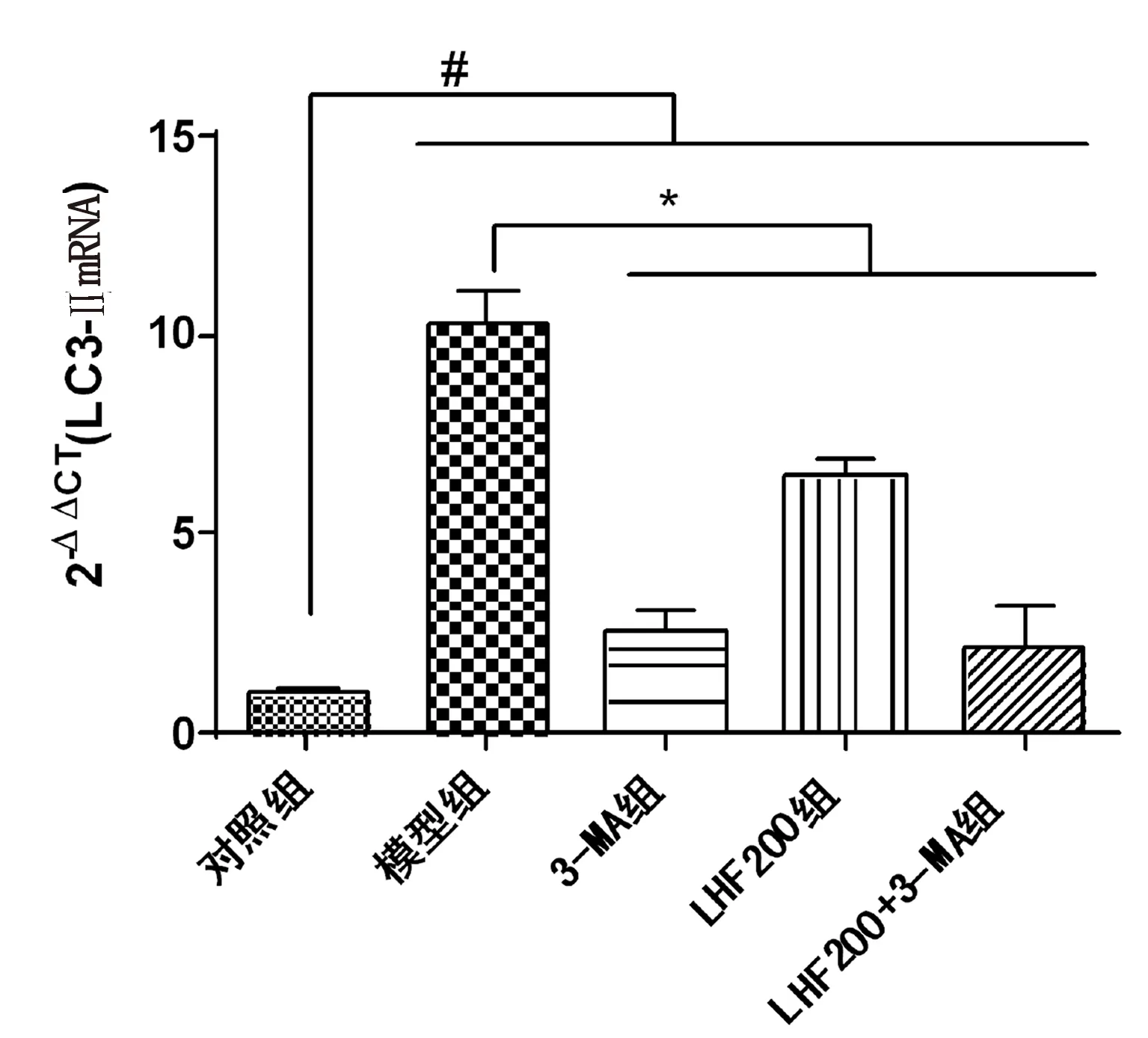
与对照组比较,#P<0.001;与模型组比较,*P<0.001
3 讨 论
自噬是细胞利用溶酶体降解自身过多或有功能缺陷的细胞内成分,从而维持细胞能量水平,更新胞质成分的过程[8]。根据细胞物质运送溶酶体途径不同,分为3种自噬:大自噬、小自噬和分子伴侣介导的自噬[9-10]。其中大自噬是主要的自噬形式(本研究提到的“自噬”均指大自噬),在生理状态下,机体存在一种程度较低的基础状态自噬,这种状态通过降解损坏的细胞器和无用蛋白质起到调控细胞存活、维持机体稳态的作用[11]。在病理状态下,面对各种应激,自噬对细胞存亡影响有两种不同的观点:一种认为自噬的启动是细胞凋亡的前奏,主要起到加速细胞凋亡的作用[10];另一种认为,自噬是应对外界刺激的保护性行为,及时清除部分坏死组织和不良代谢产物,从而为总体细胞存活提供机会[11]。相关实验研究提示,自噬的启动和发生程度与不同的应激类型、持续时间和细胞种类相关[12]。应激状态下,一定程度的自噬,通过清扫损坏细胞器、循环利用细胞内营养及消化聚集蛋白,从而阻止或减弱内质网反应、DNA损伤和能量耗竭等导致细胞凋亡的发生[13]。
干细胞领域相关研究显示,在多种应激下,自噬能提高干细胞抗凋亡能力[1-3]:骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BM-MSCs)存在较高的基础自噬状态,应用无血清环境诱导BM-MSCs可增强自噬,结果提示蛋白Bcl-2和Bcl-xL能刺激自噬体生成,促进保护性自噬的发生,增强营养缺乏应激下BM-MSCs存活能力;阿托伐他汀可激活自噬,从而减少低氧无血清应激下BM-MSCs死亡,并应用自噬抑制剂3-MA和自噬诱导剂rapamycin验证自噬与抗细胞凋亡之间的关系;自噬的增强对降低氧化应激下BM-MSCs死亡率起重要作用。可见适当的自噬有利于提高BM-MSCs的存活率,而其是否亦能对CSCs的存活率产生影响,国内外相关报道较少。
本研究结果显示,与对照组相比,模型组Beclin-1和LC3-Ⅱ蛋白和mRNA表达显著增加,提示缺血缺氧环境刺激细胞启动自噬;LHF200组自噬蛋白和其基因表达显著高于3-MA组,低于模型组,免疫荧光结果与之一致,LHF200组细胞凋亡程度最低。提示LHF通过调节自噬降低缺血缺氧环境下CSCs凋亡率。
现代中医认为,自噬现象符合中医正邪相争理论,自噬是对机体正虚邪实做出的一种自我调节方式[14];细胞自噬与机体脏腑功能低下,内生痰浊、瘀血之实邪的自我清除以维持内环境的阴阳平衡及中医气虚情况下通过“精化气”,维持机体生命活动机制一致[15]。LHF以补肾活血法为治疗大法,由鹿角片、红花、补骨脂、淫羊藿、山萸肉、女贞子和沉香组成。方中鹿角片温补肝肾、补益精血,使肾气有根,自然上通于心,红花活血化瘀通经兼凉血解毒,共为君药;补骨脂补肾助阳、纳气平喘,淫羊藿温肾壮阳,二药共同协助鹿角温补肾阳,均为臣药;山萸肉补益肝肾、收敛固涩,女贞子补益肝肾之阴,在方中含“阴中求阳”之意,沉香温肾纳气、降逆平喘,三药共为佐使药。诸药合用,共奏补肾活血之功效。有研究发现,补肾活血类方剂具有抑制卵巢颗粒细胞过度自噬作用[16];活血类方剂通过调节自噬活性,保护心肌细胞缺血损伤[17]。
综上所述,补肾活血的LHF通过调节肾之真阴真阳平衡,从而调节五脏阴阳,通过活血理气,增强CSCs抗凋亡能力。由于LHF调节细胞自噬的具体机制复杂,尚有较多问题如自噬程度的调控机制,适当自噬的标准等是今后深入研究的内容。
