酸敏感型自组装苯硼酸治疗系统的制备及体外抗肿瘤活性
2019-07-25郑翠霞
唐 岩,李 渊,郑翠霞,王 蕾,丁 波
(1.南阳市第一人民医院普外科,河南 南阳 473000;2.郑州大学药学院,河南 郑州 450001)
多西紫杉醇(docetaxel,DTX)是临床上常用的化学治疗药物,DTX作为一种小分子药物,由于半衰期短,缺乏肿瘤靶向性,限制了其在临床中的应用[1-2]。苯硼酸(phenylboronic acid,PBA)能够与1,2-或1,3-二羟基化合物(如糖类、儿茶酚等)形成苯硼酸酯键[3-5]。唾液酸(sialic acid,SA)是分布在细胞膜表面糖基最末端的单糖,在多种肿瘤细胞表面高表达[6-7]。含有PBA结构的纳米粒能够与肿瘤细胞表面高表达的SA相结合,并通过受体介导进入肿瘤细胞。当纳米粒进入细胞后,能够快速释放药物,这对化学治疗药物发挥抗肿瘤作用至关重要[3,8-9]。肿瘤微环境响应性药物释放已经被广泛应用于纳米药物递送系统,且已达到增强疗效、降低毒副作用的目的[10]。苯硼酸酯在中性或碱性环境中相对稳定,在酸性环境中发生裂解,能够对肿瘤部位的弱酸性环境产生快速响应[11-12]。DTX/苯硼酸酯纳米粒(phenylboronic acid-based self-assembly nanoparticles,PNPs)可以通过受体介导,增强其进入细胞的能力,并快速响应肿瘤细胞内的酸性环境,从而达到高效递送药物、增强DTX抗肿瘤效果的目的。本研究将DTX装载于共价自组装PNPs中,制备DTX/PNPs系统,并探讨其体外抗肿瘤活性。
1 材料与方法
1.1 细胞、试剂与仪器人肝癌HepG2细胞(中国科学院细胞库);DTX(大连美仑生物技术有限公司),对苯二胺和3、4-二羟基苯甲醛(阿拉丁生化科技股份有限公司),4-甲酰基苯硼酸(山东西亚化学工业有限公司),泊洛沙姆188(德国BASF公司);WSJB-03恒温磁力搅拌器(河南中良科学仪器有限公司),H1850R高速离心机(湖南湘仪科学仪器厂),AB135-S型分析天平(瑞士Mettler Toledo公司),Waters e2695 高效液相色谱仪(美国Waters公司),Nano-ZS 90型激光粒度分析仪(英国Marvin公司),Mili-Q超纯水器(美国Millipore公司),实验所用其他试剂均为分析纯;缓冲溶液和样品溶液配制用水均为超纯水。
1.2 DTX/PNPs的制备
1.2.1 B,B′-[1,4-亚苯基双(亚硝基甲基炔-1,4-亚苯基)]苯硼酸(Im-Ba)的合成合成路线见图1。称取50 mg对苯二胺、15 mg 4-甲酰基苯硼酸置于圆底烧瓶中,加入20 mL甲醇,得到黄色透明溶液。室温搅拌,溶液逐渐由澄清变浑浊,12 h后结束反应,12 000×g离心5 min,弃上清液;沉淀用冰甲醇洗涤3次,得到的黄色固体即为Im-Ba,真空干燥备用[13]。
1.2.2 4,4′-[1,4-亚苯基双(亚甲氧基甲基)]1,2-苯二醇(Im-Ca)的合成合成路线见图1。称取150 mg对苯二胺、400 mg 3,4-二羟基苯甲醛溶于 10 mL 无水乙醇中,室温、氩气保护、避光条件下搅拌12 h。反应结束后,12 000×g离心5 min,弃上清液;沉淀用预冷无水乙醇洗涤3次,得到的棕色固体即为Im-Ca,真空干燥备用[13]。
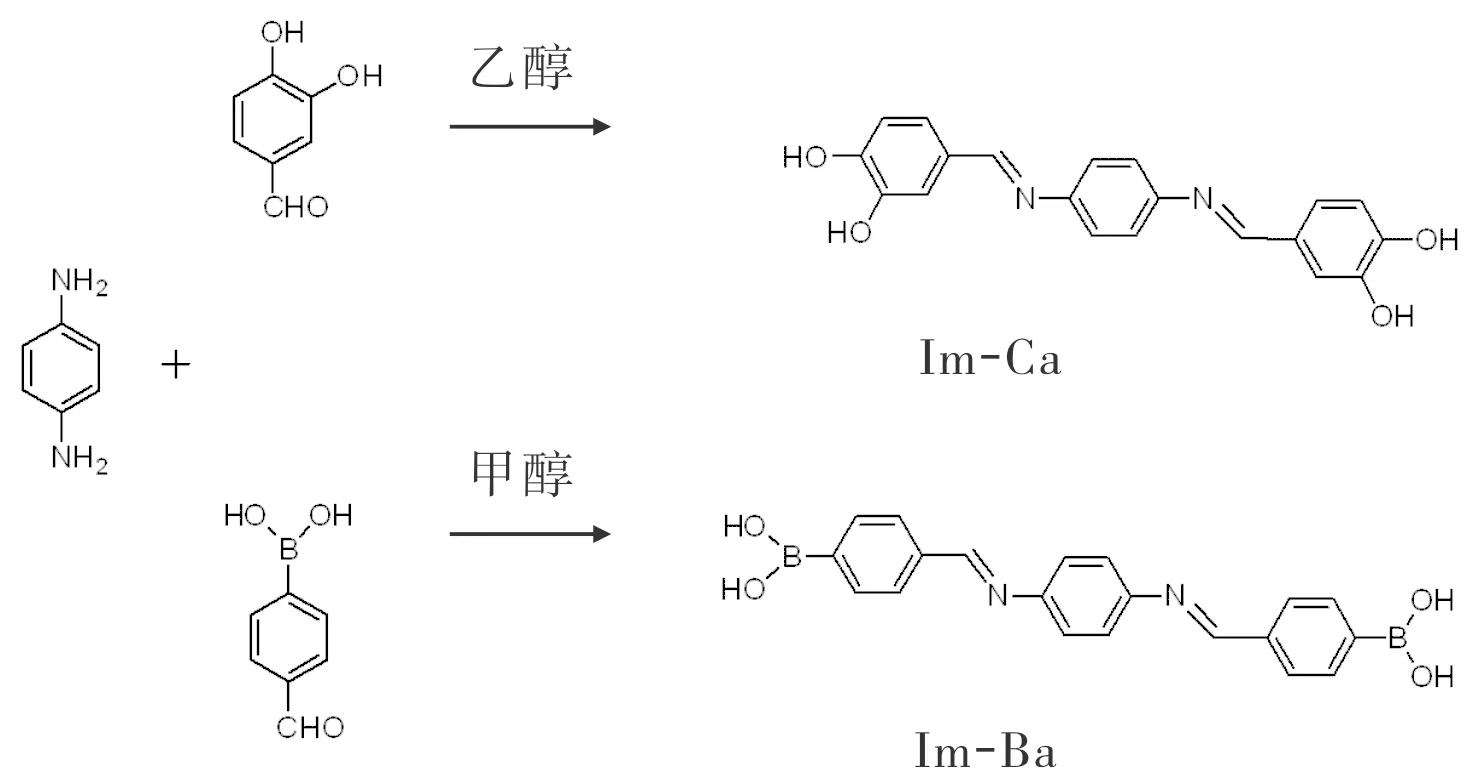
图1 Im-Ba、Im-Ca的合成路线
Fig.1 Synthesis routes of Im-Ca and Im-Ba
1.2.3 DTX/PNPs的制备采用乳化溶剂挥发法制备DTX/PNPs。称取10 mg Im-Ca和400 mg泊洛沙姆188置于15 mL EP管中,加入10 mL超纯水,60 ℃水浴10 min使其溶解,冷却至室温,转移到圆底烧瓶中。称取10 mg Im-Ba和20 mg DTX置于 15 mL EP管中,加入10 mL甲醇,超声使其溶解,然后在搅拌过程中滴加到Im-Ca和泊洛沙姆188水溶液中,室温、避光、敞口搅拌24 h。反应结束后,将反应液在超纯水中透析8 h以除去游离的DTX,所用透析袋截留相对分子量为8 000 000~14 000 000。
1.3 DTX/PNPs的质量评价
1.3.1 制剂外观取1.5 mL DTX/PNPs的水溶液于小玻璃瓶中,拍照观察其外观。
1.3.2 形态观察取200 mg·L-1DTX/PNPs水溶液适量,滴加到铜网超薄碳膜上,自然晾干,用透射电镜(TEM-1400)观察其形态特征。
1.3.3 粒径和电位表征配置200 mg·L-1DTX/PNPs水溶液适量,用Nano-ZS90型激光纳米粒度仪测定其粒径和Zeta电位。
1.3.4 稳定性考察将DTX/PNPs稀释至200 mg·L-1,室温保存,每日测量其粒径及电位,连续测量1周。
1.4 高效液相色谱法(high performance liquid chromatography,HPLC)测定DTX含量
1.4.1 色谱条件色谱柱为Inertex C18柱(250.0 mm×4.6 mm,5 μm),流动相为甲醇乙腈(3665,V/V),检测波长为230 nm,柱温为(30±5) ℃,进样量为20 μL,流速为1.0 mL·min-1,检测时间为12 min。
1.4.2 标准曲线建立精密称取DTX对照品10 mg,用甲醇溶解定容至50 mL容量瓶中,得到浓度为200 mg·L-1的DTX储备液,并依次稀释成0.1、0.5、2.5、5.0、10.0、50.0 mg·L-1的系列浓度溶液,分别进样20 μL,以峰面积(A)为纵坐标,浓度(C)为横坐标,进行线性回归,得回归方程A=10 384×C-4 404.9(R2=0.999 8),线性范围为0.10~50.00 mg·L-1。
1.4.3 载药量测定将300 μL DTX/PNPs溶液分散到2.7 mL甲醇溶液中,并将该混悬液在冰浴条件下超声处理30 min,确保DTX完全溶解于甲醇中,15 000×g离心10 min,按公式计算载药率。载药率=荷载的DTX量/(荷载的DTX量+所投PNPs量)×100%。
1.5 体外释药分别以pH值为5.0磷酸盐缓冲液(phosphate buffer saline,PBS)、pH值为6.0 PBS、pH值为7.4 PBS作为释放介质。取2 mL的DTX/PNPs溶液置于透析袋中,再向透析袋中加入 2 mL 透析介质,透析袋两端用绳子系紧,浸入30 mL释放介质中,置于摇床上,37 ℃恒温,转速为100 r·min-1条件下释药。分别在0.25、0.5、1、2、4、6、8、10、12、24、36 h时,取释放介质500 μL,再加入500 μL相应空白释放介质。按照“1.4.1”项中的色谱条件检测样品,然后根据标准曲线计算不同时间点释放介质中DTX浓度,并按照公式计算DTX的累计释放百分数,绘制释放曲线。
1.6 体外抗肿瘤实验
1.6.1 细胞培养采用人肝癌HepG2细胞[14]为实验细胞株。将人肝癌HepG2细胞置于含体积分数10%胎牛血清和含1%双抗(100 U·mL-1青霉素、100 mg·L-1链霉素)的达尔伯克改良伊格尔培养基,在含体积分数5%CO2、37 ℃饱和湿度的培养箱中培养,隔天换液或传代处理。
1.6.2 四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)法检测PNPs对细胞增殖的抑制情况取对数生长期HepG2细胞,接种于96孔板中,细胞密度调整为每孔7×103个,继续培养24 h。当细胞贴满孔底时,弃去原来的培养基,并加入含3.125、6.250、12.500、25.000、50.000 mg·L-1PNPs的完全培养基,每组设置3个复孔。平行做2组,分别培养24、48 h后,加入1 mg·L-1MTT。继续培养4 h,弃去含MTT的培养基,每孔加入150 μL 二甲基亚砜,置于摇床中,37 ℃ 100 r·min-1振摇 10 min;于 490 nm 处测量各孔的吸光度值,计算细胞存活率。细胞存活率=实验组吸光度值/对照组吸光度值×100%。
1.6.3 MTT法检测纳米药物对细胞增殖的抑制情况收集对数生长期HepG2细胞,接种于96孔板中,细胞密度调整为每孔7×103个,每孔加 100 μL 细胞悬液,置于37 ℃ 恒温培养箱中培养 24 h。将细胞分为空白对照组、DTX组、DTX/PNPs(pH值为6.0)组、DTX/PNPs(pH值为7.4)组。分别使用pH值为6.0、7.4的细胞培养基稀释DTX/PNPs,使DTX浓度分别为0.135、0.270、0.800、2.500、5.000 mg·L-1。待细胞贴壁后,弃去原来的培养基,分别加入空白培养基、含DTX培养基、含DTX/PNPs(pH值为6.0)培养基和含DTX/PNPs(pH值为7.4)培养基2 mL,继续培养4 h,弃去含药培养基,加入等体积的新鲜培养基。每组设置3个复孔,培养48 h,按 “1.6.2”项下方法,使用MTT法检测其在490 nm处的吸光度值,计算细胞抑制率。细胞抑制率=(1-实验组吸光度值/对照组吸光度值)×100%。
1.6.4 流式细胞术检测纳米药物对细胞周期分布的影响取对数生长期HepG2细胞接种于6孔板中,细胞密度调整为每孔3×105个,置于恒温培养箱中培养24 h;将细胞分为空白对照组、PNPs组、DTX组、DTX/PNPs组。待细胞贴壁后,弃去原来的培养基,PNPs组、DTX组、DTX/PNPs组、空白对照组分别加入含PNPs(pH值为6.0)、DTX(pH值为6.0)、DTX/PNPs (pH值为6.0)和不含药的新鲜培养基2 mL,其中DTX浓度为 3 mg·L-1,置于培养箱中培养48 h。用不含乙二胺四乙酸的胰蛋白酶消化收集细胞,预冷的体积分数75%乙醇在4 ℃ 固定细胞24 h。弃去乙醇固定液,PBS洗涤2次,然后加入100 mg·L-1RNA酶作用30 min。弃去RNA酶溶液,用PBS洗涤2次,加入50 mg·L-1碘化丙啶(propidium iodide,PI)500 μL,避光条件下作用30 min 后,使用流式细胞仪进行检测各组细胞的细胞周期分布情况。
1.6.5 PI染色法检测纳米药物诱导细胞凋亡情况取对数生长期HepG2细胞接种于6孔板中,细胞密度调整为每孔3×105个,置于恒温培养箱中培养24 h;将细胞分为空白对照组、PNPs组、DTX组、DTX/PNPs组。待细胞贴壁后,弃去原来的培养基,并分别加入含PNPs(pH值为6.0)、DTX(pH值为6.0)、DTX/PNPs (pH值为6.0)和不含药的新鲜培养基2 mL,其中DTX浓度为3 mg·L-1,置于培养箱中培养 48 h。收集各组细胞,1 000 r·min-1离心5 min,弃上清液;加入5 μL Binding Buffer和0.5 mL膜联蛋白V-异硫氰酸荧光素轻轻吹打重悬细胞,室温避光作用30 min后,加入5 μL PI混匀,室温避光作用 15 min 后,使用流式细胞仪进行检测,计算各组细胞的凋亡指数,凋亡指数=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数 × 100%。

2 结果
2.1 DTX/BNPs纳米粒质量评价
2.1.1 DTX/PNPs的制备Im-Ba和Im-Ca的红外光谱如图2所示,3 409 cm-1和3 374 cm-1为对苯二胺中伯胺N-H的伸缩振动峰,在合成的Im-Ba和Im-Ca中,叔胺无N-H,故无N-H伸缩振动峰。4-甲酰基苯硼酸在2 844 cm-1和2 749 cm-1出现羰基C-H伸缩振动峰,3、4-二羟基苯甲醛在2 872 cm-1和 2 766 cm-1出现羰基C-H伸缩振动峰;二者在分别形成Im-Ba和Im-Ca后,羰基C-H伸缩振动峰消失。证明成功制备前体化合物Im-Ba和Im-Ca。

A:Im-Ba;B:Im-Ca。
图2 Im-Ba、Im-Ca的傅里叶红外光谱图
Fig.2 Fourier infrared spectroscopy of Im-Ba,Im-Ca
2.1.2 DTX/BNPs的外观及粒径电位结果见图3。DTX/PNPs为球形,且在水溶液中稳定,纳米粒平均粒径为(180.0±1.7) nm,多分散系数为0.18,电位为(-20.0±0.9) mV。

A:DTX/PNPs的透射电镜图;B:DTX/PNPs的外观图;C:DTX/PNPs的粒径图;D:DTX/PNPs的电位图
图3 DTX/PNPs的TEM、外观、粒径和电位图
Fig.3 TEM image,appearance,size and zeta of DOX/PNPs
2.1.3 载药量测定DTX的载药量为(45.4±2.5)%。
2.1.4 稳定性考察室温条件下,DTX/PNPs在第1、2、3、5、7天的粒径分别为(211.6±3.8)、(219.1±2.7)、(218.4±4.1)、(226.5±1.9)、(224.4±3.2) nm;电位分别为 (-21.7±1.1)、(-21.9±1.4)、(-22.0±1.2)、(-21.8±9.9)、(-22.1±1.6)mV。
2.2 DTX/BNPs体外释药结果见表1。在pH值为5.0、pH值为6.0、pH值为7.4的PBS溶液中,36 h时DTX累积释放百分率分别为(80.61±3.09)%、(55.81±3.05)%、(11.88±1.90)%。DTX在pH值为5.0、pH值为6.0的PBS溶液中的累计释放百分数高于DTX在pH值为7.4的PBS溶液中的累计释放百分数,差异有统计学意义(P<0.05)。
2.3 DTX/PNPs体外抗肿瘤实验
2.3.1 PNPs、DTX、DTX/PNPS对细胞增殖的抑制作用结果见表2和表3。培养24、48 h后,浓度为3.125、6.250、12.500、25.000、50.000 mg·L-1PNPs组的细胞存活率均大于90%。药物作用48 h后,DTX浓度为0.135、0.270、0.800、2.500、5.000 mg·L-1时,DTX/PNPs(pH值为6.5)组、DTX/PNPs(pH值为7.4)组细胞抑制率高于DTX组,差异有统计学意义(P<0.01);DTX/PNPs(pH值为6.5)组细胞抑制率高于DTX/PNPs(pH值为7.4)组,差异有统计学意义(P<0.01)。
表1 不同pH条件下DTX累积释放百分数比较


时间/hDTX累计释放百分数/%pH7.4pH6.0pH5.00.253.74±1.5115.46±2.4414.74±3.610.505.64±2.0920.61±2.5029.33±2.001.008.21±2.3029.62±2.1843.18±3.062.0010.61±2.6242.17±2.9057.81±4.324.0012.82±1.8950.10±3.49a75.77±2.64a8.0011.64±2.5052.72±2.95a78.86±3.36a12.0011.54±1.7854.78±3.40a80.99±4.27a24.0011.83±2.4655.00±3.27a79.02±3.11a36.0011.88±1.9055.81±3.05a80.61±3.09a
注:与pH值为7.4条件下比较aP<0.05。
表2 不同浓度PNPs作用后的细胞存活率


时间细胞存活率/%3.125mg·L-16.250mg·L-112.500mg·L-125.000mg·L-150.000mg·L-124h99.51±2.5198.66±2.4497.84±4.6195.67±3.8296.00±5.1148h98.92±3.9098.81±3.0597.98±2.9995.37±4.6195.89±3.72
表3 不同DTX浓度作用48 h空白对照组、DTX组、DTX/PNPs (pH值为6.5)组、DTX/PNPs (pH值为7.4)组细胞抑制率比较


组别细胞抑制率/%0.135mg·L-10.270mg·L-10.800mg·L-12.500mg·L-15.000mg·L-1空白对照组0.00±0.000.00±0.000.00±0.000.00±0.000.00±0.00DTX组20.01±3.3235.54±2.4642.93±1.1853.59±1.9358.96±3.71DTX/PNPs(pH6.5)组52.44±3.58a64.16±2.65a72.81±2.29a80.73±2.14a89.06±1.52aDTX/PNPs(pH7.4)组39.29±3.97ab50.66±3.25ab57.15±2.92ab63.80±2.11ab73.36±1.67ab
注:与DTX组比较aP<0.001;与DTX/PNPs (pH 7.4)组比较bP<0.01。
2.3.2 各组细胞周期比较结果见表4。PNPs组G0/G1、S和G2/M期细胞所占百分比与空白对照组比较差异无统计学意义(P>0.05),DTX、DTX/PNPs组G0/G1期细胞所占百分比显著低于空白对照组,S期细胞所占百分比显著高于空白对照组,差异有统计学意义(P<0.01)。
2.3.3 PNPs、DTX、DTX/PNPs诱导细胞凋亡比较空白对照组、PNPs组、DTX组、DTX/PNPs组细胞凋亡指数分别为(4.6±1.3)%、(4.6±1.7)%、(38.1±2.1)%和(44.2±1.9)%;空白对照组与PNPs组细胞凋亡指数比较差异无统计学意义(P>0.05)。DTX组、DTX/PNPs组细胞凋亡指数高于空白对照组,差异有统计学意义(P<0.05)。
表4 空白对照组、PNPs组、DTX组、DTX/PNPs组细胞周期比较

组别细胞周期时相分布/%G0/G1期S期G2/M期空白对照组66.8±2.330.7±3.52.5±1.2PNPs组63.6±3.123.1±2.813.3±1.8DTX组41.7±1.2a48.7±2.9a9.5±2.3DTX/PNPs组26.3±1.9a59.6±2.3a14.1±4.2
注:与空白对照组比较aP<0.01。
3 讨论
癌症是威胁人类生命健康的重大疾病,发病率和病死率逐年上升。目前临床上癌症的治疗方法主要有化学治疗、放射治疗、手术治疗等,其中化学治疗是临床上最常用的治疗手段或者辅助治疗的手段。小分子化学治疗药物DTX由于其选择性较差,所以毒副作用较强。为了改善化学治疗药物的毒副作用,将纳米技术应用于抗肿瘤药物的递送,不仅能降低药物的毒副作用,还能够有效克服药物递送屏障,提高肿瘤治疗效果。本研究利用苯硼酸酯能够响应肿瘤微环境弱酸性的特点,以苯硼酸儿茶酚酯键为连接键,以泊洛沙姆188为稳定剂,以DTX为化学治疗药物模型,成功构建具有细胞识别作用和肿瘤微环境响应特性的共价自组装纳米粒。本研究所制备的DTX/PNPs pH双响应行为可描述为:在肿瘤弱酸性的微环境中,纳米粒表面的泊洛沙姆层脱落,纳米粒结构改变,暴露出能与SA结合的PBA;通过受体介导的细胞内吞,纳米粒进入细胞内部,由于肿瘤内部酸性环境更强,酯键快速断裂,纳米粒分崩离析,实现酸响应性药物快速释放[15-17]。
本研究首先对DTX/PNPs的性质进行了考察。纳米粒的形貌及粒径、电位等参数是评价纳米粒质量的重要标准,利用透射电镜对纳米粒的形貌进行了考察,利用动态光散射对DTX/PNPs的粒径分布和电位大小进行分析,发现DTX/BNPs纳米粒分散性好,粒形态均一,而且其粒径大小符合肿瘤深层渗透的条件。1周内纳米粒的电位和粒径变化结果表明,泊洛沙姆188的存在能够有效的维持了纳米粒的稳定性。体外释放实验表明,DTX/PNPs的酸敏感性良好,酸性环境能够有效地促进苯硼酸酯键的断裂,进而纳米粒崩解,实现定位释药。
本研究选取人肝癌HepG2细胞为模型[14,18],对DTX/PNPs的体外抗肿瘤活性进行了考察。PNPs浓度为50 mg·L-1时,培养48 h细胞存活率仍大于90%,说明PNPs安全性高,分析原因为组成PNPs纳米粒的单体化合物安全无毒,而且泊洛沙姆188的生物相容性好[15,19]。DTX/PNPs在弱酸性环境中能增强SA介导的细胞内吞,且在肿瘤内部快速释放药物[20-21],DTX、DTX/PNPs作用48 h后对HepG2细胞的生长抑制均表现出一定的剂量依赖性。DTX/PNPs对细胞抑制作用要高于DTX,主要是因为在pH值为6.0的弱酸性环境中,DTX/PNPs表面的泊洛沙姆脱落,PBA暴露,SA介导增强细胞内吞[16-17]。为进一步验证这个理论,对DTX/PNPs在不同pH环境中对细胞的抑制情况进行了研究,结果显示,DTX/PNPs在pH值为6.0的环境中对肿瘤的抑制效果强于pH值为7.4的环境中对细胞的抑制效果。利用化学治疗方法治疗肿瘤的机制之一就是对肿瘤细胞的DNA造成损伤[22-23]。空白对照组细胞主要分布于G0/G1期,与空白对照组相比,PNPs组细胞周期时相分布无明显变化,说明载体生物相容性好,无明显毒副作用。DTX和DTX/PNPs明显阻滞细胞周期于S和G2/M期。并且,与空白对照组比较,DTX/PNPs组G0/G1期细胞所占百分比减少,提示DTX/PNPs阻滞作用更明显。凋亡实验结果也表明,相对于空白对照组、DTX组、DTX/PNPs组可诱导更多的细胞发生凋亡。DTX/PNPs能够有效抑制肿瘤细胞的生长,主要是因为纳米粒能够特异性响应肿瘤酸性环境,定点释药,此外,也与脱落的泊洛沙姆188抑制了p-糖蛋白对药物的外排密切相关[22],综上所述,DTX/PNPs纳米粒的制备比较简单,靶向性强,生物相容性好,安全性高,能够提高药物的生物利用度,为实现肿瘤高效治疗提供了新途径。
