脐带间充质干细胞对急性卵巢缺血再灌注损伤小鼠卵巢组织中过氧化物歧化酶及白细胞介素-12表达的影响
2019-07-25邹晓萍叶豪奕回月彤商崇智董化江
邹晓萍,叶豪奕,程 虎,回月彤,商崇智,董化江,王 磊,徐 健
(1.中国人民武装警察部队特色医学中心妇产科,天津 300162;2.中国人民武装警察部队后勤学院,天津 300189;3.中国人民武装警察部队特色医学中心神经外科,天津 300161;4.中国医学科学院北京协和医学院生物医学工程研究所,天津 300192)
卵巢扭转为女性常见急症,多由于剧烈运动后及肿瘤压迫、肠扭转、肠套叠、嵌顿疝时肠系膜静脉和动脉受压等所致,如处理不及时可出现卵巢梗死或卵巢破裂,恢复血液供应是最为有效的治疗方法[1-2]。发生扭转的卵巢恢复正常解剖位置后血液供应得到恢复,卵巢组织损伤反而较单纯缺血阶段更为严重,即出现卵巢组织缺血再灌注损伤,其多由免疫微环境紊乱、炎症反应、氧化应激、自由基增多等因素引起,临床上尚无特效药物和效果好的处理手段[3-5]。近年来,部分干细胞技术应用于临床,取得了较好的治疗效果[6-8]。间充质干细胞(matrix stem cells,MSC)在免疫系统疾病及组织再生领域不断显示出其优势,其治疗效用的维持依赖于细胞替代及“伪旁观者效应”2种机制[9]。本研究选用脐带间充质干细胞(umbilical cord-matrix stem cell,UC-MSC)对卵巢扭转小鼠进行干预治疗,探讨其对缺血再灌注损伤卵巢炎症反应及氧化应激损伤的影响,为卵巢缺血再灌注损伤提供新的治疗手段。
1 材料与方法
1.1 实验动物及分组无特定病原体级C57BL/6NCrl雌性小鼠30只,体质量18~23 g,购自华阜康生物科技股份有限公司(北京),品系编码:213。将小鼠随机分为假手术组、模型组和干细胞组,每组10只。各组小鼠于18.5~21.5 ℃、湿度38.8%~43.5%环境分笼喂养,给予充足的洁净饮水和食物,每日日光灯照射时间为12 h。
1.2 主要试剂与仪器UltraCULYURETM培养基(美国Lonza公司),白细胞介素-12(interleukin-12,IL-12)多克隆抗体(美国Sigma公司),胎牛血清、过氧化物歧化酶(superoxide dismutase,SOD)多克隆抗体(美国Gibco公司),CD90、CD73、CD105流式抗体(美国BD公司),RNA提取试剂盒[天根生化科技(北京)有限公司];反转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)仪(美国MJ Research公司),Western blotting 电泳仪、Western blotting电转仪(美国Bio-Rad 公司),CX23生物显微镜(日本Olympus公司),生物安全柜(苏州安泰空气技术有限公司)。
1.3 UC-MSC分离与扩增脐带来源于本院产妇,均经产妇本人及家属知情同意,并签订相关的医疗文书及脐带使用知情同意书。将洁净脐带去除血液和表皮组织,剥离脐带内的2条动脉及1条静脉,剩余组织为华通胶,将华通胶剪切成1 mm×1 mm×1 mm的组织块,加入培养基,置于37 ℃、含体积分数5%CO2的培养箱进行培养,第7天可见有UC-MSC自华通胶内爬出,第10天细胞长满培养瓶底部,按照1传5的比例进行传代扩增,然后按照1传2的比例进行扩增,选取第3代细胞用于本研究。质量控制标准为CD73、CD90、CD105阳性细胞数>95%,CD34阳性细胞数<3%,细胞活力 ≥95%,病原菌排查未检出细菌。
1.4 小鼠卵巢缺血再灌注模型制备及各组干预措施各组小鼠仰卧位固定于手术操作台上,给予100 g·L-1水合氯醛(0.004 mL·g-1)麻醉,切开下腹部皮肤、肌肉,暴露卵巢组织;其中假手术组小鼠仅在卵巢动脉下穿线,不阻断卵巢动脉的血流供应;模型组与干细胞组小鼠阻断卵巢动脉血液供应30 min,而后剪断卵巢动脉的结扎线,恢复卵巢血液供应。干细胞组小鼠于恢复卵巢血液供应后24 h后经尾静脉注射1.0×106个UC-MSC,假手术组、模型组小鼠均于同时间点尾静脉注射相同体积的生理盐水;各组小鼠均于尾静脉注射72 h后采用安乐死方法处死,取手术侧卵巢组织标本待检。
1.5 实时定量PCR检测各组小鼠卵巢组织中IL-12和SOD mRNA表达应用TRIzol试剂提取各组小鼠手术侧卵巢组织总RNA,根据试剂盒说明反转录合成cDNA。IL-12引物序列:上游引物序列为5′-TTTCTAGATGCTGGCCAATACA-3′,下游引物序列为5′-ATCTCGGTGGACCAAATTCC-3′。SOD引物序列:上游引物序列为5′-AGCGTGACTTTGGGTCTTT-3′,下游引物序列为5′-GCGACCTTGCTCCTTATTG-3′。β-actin引物序列:上游引物序列为5′-GTGTGGATTGGTGGCTCTATC-3′,下游引物序列为5′-CAGTCCGCCTAGAAGCATTT-3′。反应条件:94 ℃预变性 3 min,变性30 s,60 ℃退火30 s,72 ℃延伸 30 s,共29个循环;72 ℃再延伸10 min。PCR产物进行琼脂糖凝胶电泳,采用快速凝胶成像系统拍摄电泳图谱条带,利用图像分析软件分析条带灰度值。
1.6 Western blot法检测各组小鼠卵巢组织中IL-12和SOD蛋白表达取各组小鼠手术侧卵巢组织100 mg,加入1 mL蛋白磷酸酶细胞裂解液(4 g·L-1),液氮研磨,4 ℃、12 000 r·min-1、离心半径15 cm条件下离心20 min。取总蛋白样本 50 μg,分离胶进线分离总蛋白,将蛋白质转移至聚偏二氟乙烯膜,封闭5 h,加入一抗(IL-12多克隆抗体或SOD多克隆抗体),4 ℃孵育过夜,二抗室温孵育2 h,曝光、扫描底片,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,对各组目的基因条带的灰度值进行分析,计算其相对表达量,灰度值越高,表示蛋白表达量越大。

2 结果
2.1 3组小鼠卵巢组织中IL-12及SOD mRNA表达比较结果见表1。3组小鼠卵巢组织中IL-12、SOD mRNA表达比较差异均有统计学意义(F=3.761、3.134,P<0.01)。模型组小鼠卵巢组织中IL-12 mRNA表达显著高于假手术组,差异有统计学意义(P<0.05);干细胞组小鼠卵巢组织中IL-12 mRNA表达显著低于模型组,差异有统计学意义(P<0.05);干细胞组与假手术组小鼠卵巢组织中IL-12 mRNA比较差异无统计学意义(P>0.05)。模型组和干细胞组小鼠卵巢组织中SOD mRNA表达高于假手术组,差异有统计学意义(P<0.05);干细胞组小鼠卵巢组织中SOD mRNA表达水平高于模型组,差异有统计学意义(P<0.05)。
表1 3组小鼠卵巢组织中IL-12及SOD mRNA表达比较


组别nIL-12mRNASODmRNA假手术组100.194±0.0410.258±0.109模型组100.568±0.186a0.290±0.131a干细胞组100.309±0.163b0.741±0.228abF3.7613.134P<0.01<0.01
注:与假手术组比较aP<0.05;与模型组比较bP<0.05。
2.2 3组小鼠卵巢组织中IL-12及SOD蛋白表达比较结果见表2、图1。3组小鼠卵巢组织中IL-12、SOD蛋白表达比较差异均有统计学意义(F=2.520、4.458,P<0.01)。模型组小鼠卵巢组织中IL-12蛋白表达显著高于假手术组,差异有统计学意义(P<0.05);干细胞组小鼠卵巢组织中IL-12蛋白表达显著低于模型组,差异有统计学意义(P<0.05);干细胞组与假手术组小鼠卵巢组织中IL-12蛋白表达比较差异无统计学意义(P>0.05)。模型组和干细胞组小鼠卵巢组织中SOD蛋白表达高于假手术组,差异有统计学意义(P<0.05);干细胞组小鼠卵巢组织中SOD蛋白表达高于模型组,差异有统计学意义(P<0.05)。
表2 3组小鼠卵巢组织中IL-12及SOD蛋白表达比较

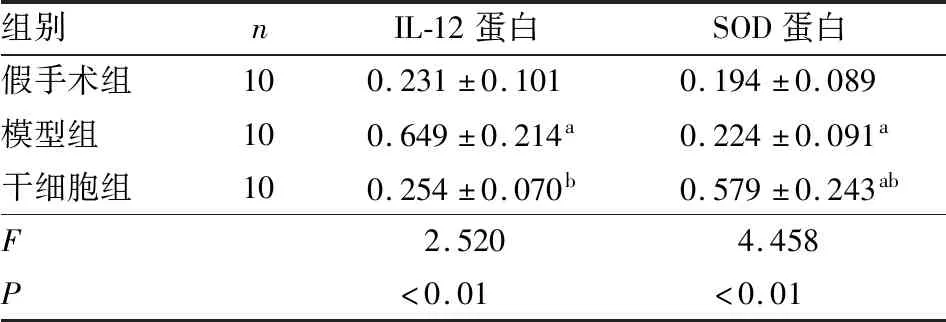
组别nIL-12蛋白SOD蛋白假手术组100.231±0.1010.194±0.089模型组100.649±0.214a0.224±0.091a干细胞组100.254±0.070b0.579±0.243abF2.5204.458P<0.01<0.01
注:与假手术组比较aP<0.05;与模型组比较bP<0.05。
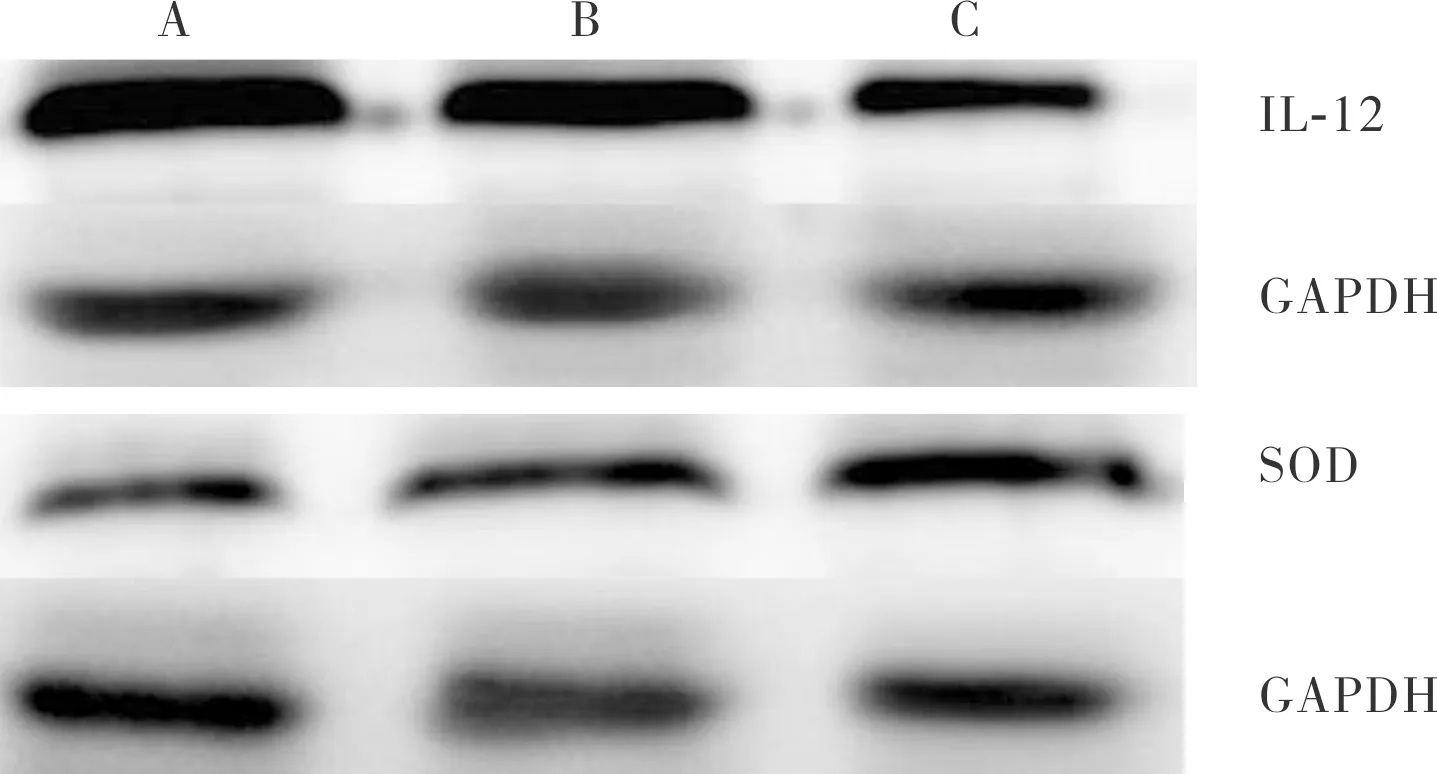
注:A:假手术组;B:模型组;C:干细胞组。
图1 3组小鼠卵巢组织中IL-12及SOD蛋白表达(Western blot)
Fig.1 Expression of IL-12 and SOD protein in ovarian tissues of mice in the three groups(Western blot)
3 讨论
卵巢扭转是女性常见病,可见于剧烈运动后及血管外肿瘤压迫、肠扭转、肠套叠、嵌顿疝时肠系膜静脉和动脉受压等情况下,如果处理不当,轻者可出现输卵管粘连、阻塞,重者可出现卵巢梗死、破裂等[1-3]。恢复血流灌注是该病的有效治疗方法,但在扭转的卵巢恢复正常解剖部位及血液供应后,往往卵巢组织损伤较缺血阶段更为严重,相继出现各类并发症,临床处理棘手,治疗效果差,因此,对卵巢扭转的处理仍需高度重视[3-5]。
MSC是一类具有体外扩增和多向分化潜能的细胞,可分化为神经元、胶质细胞、心肌细胞、骨细胞、软骨细胞、脂肪细胞等[6-8]。研究表明,不同组织来源的MSC及其分泌的细胞因子和外泌体可通过改善卵巢组织微环境、免疫调节而促进卵泡发育,恢复卵巢早衰患者的卵巢功能及生育能力[9]。另有研究证实,UC-MSC及骨髓来源的MSC外泌体可通过调节血清激素水平,降低顺铂对卵巢的损伤,修复卵巢功能[10]。在体外培养的UC-MSC可通过旁分泌或自分泌方式产生多种具有生物活性的因子,如缺血诱导的因子、神经源性生长因子、血管生成素、血管内皮生长因子、基质起源的因子、肝细胞生长因子、胰岛素样生长因子、纤维母细胞生长因子等,对损伤组织的恢复及组织重建具有促进作用[8]。UC-MSC在抑制炎症反应和免疫调节过程中具有双重作用,可通过抑制炎症进程及发挥免疫调节作用而抑制炎症反应,维持机体免疫微环境稳定[8,11-12]。本课题组前期研究亦发现,使用UC-MSC培养上清液提取物进行治疗亦可起到与细胞治疗类似的效果,UC-MSC的治疗作用机制涵盖细胞替代作用及 “无细胞”的“伪旁观者效应”2种途径[9,13-14]。
IL-12作为促进炎症反应的重要炎性因子,在炎症进程中的作用不可轻视,阻断IL-12的炎症反应通路对有效控制炎症有重要意义。缺氧或局部缺血情况下可引发活性氧(reactive oxygen specie,ROS)大量产生,过多的ROS可直接损伤细胞膜、DNA和蛋白质,导致细胞功能的改变和丧失,并抑制细胞增殖,诱导凋亡[13-17]。樊志刚等[13]研究证实,胚胎干细胞可以通过抑制氧化应激反应进程而逆转糖尿病肾病的发生、发展。袁春菊[17]研究显示,依那普利对梗死心肌微环境的调节有助于提高UC-MSC的疗效,其主要作用机制为抑制炎症级联放大及降低氧化应激反应,而这二者对损伤心室的重构具有促进作用。基于上述研究,本课题组推测UC-MSC可通过抑制炎症反应及降低氧化应激反应而保护受损卵巢组织。脐带作为医疗废品,重新再利用可实现“变废为宝”;同时,UC-MSC体外扩增及分化能力强,是良好的“种子细胞”[6,8,15]。基于上述原因,本研究选用无伦理学争议的UC-MSC,观察其对炎症因子IL-12及氧化应激损伤的代表性酶SOD的影响,以探讨其对卵巢扭转小鼠的治疗效果。
本研究结果显示,模型组小鼠卵巢组织中IL-12 mRNA、IL-12蛋白表达显著高于假手术组;而经过UC-MSC干预后,干细胞组小鼠卵巢组织中IL-12 mRNA、IL-12蛋白表达显著低于模型组,且干细胞组与假手术组小鼠卵巢组织中IL-12 mRNA、IL-12蛋白表达比较差异无统计学意义;提示UC-MSC干预可有效下调卵巢缺血再灌注小鼠卵巢组织中IL-12表达,因此,UC-MSC可作为卵巢扭转后控制炎症反应的重要干预手段之一。另外,本研究发现,模型组和干细胞组小鼠卵巢组织中SOD mRNA、SOD蛋白表达显著高于假手术组,且干细胞组小鼠卵巢组织中SOD mRNA、SOD蛋白表达高于模型组;提示卵巢缺血再灌注损伤小鼠卵巢组织中SOD表达有所上调,UC-MSC干预可进一步上调SOD表达,从而有效减轻小鼠缺血再灌注损伤卵巢组织的氧化应激反应和氧化损伤。
综上所述,UC-MSC移植可降低小鼠缺血再灌注损伤卵巢组织中IL-12表达,提高SOD表达,抑制炎症反应,改善氧化应激损伤,有益于受损卵巢功能的恢复。本研究为卵巢缺血再灌注损伤的干细胞治疗提供了理论基础和依据,但不足之处在于尚不能明确其分子机制及UC-MSC的作用机制,有待后续进一步研究。
